
- •1. Метрологические характеристики анализа. Ход анализа
- •2. Погрешности в анализе. Классификация погрешностей. Правильность, воспроизводимость и точность анализа.
- •3. Общая характеристика реакций в растворах. Активность, коэффициент активности.
- •4. Протолитическая теория диссоциации. Кислоты и основания, амфолиты. Автопротолиз.
- •11. Техника приготовления растворов. Стандартизация растворов. Расчеты в титриметрическом анализе.
- •12. Кривые кислотно-основного титрования. Скачок на кривой титрования. Зависимость величины скачка от различных факторов.
- •13. Кислотно-основные индикаторы. Ионно-хромофорная теория индикаторов. Принцип выбора индикаторов.
- •14. Рабочие и стандартные растворы в кислотно-основном титровании.
- •15. Определение слабых многоосновных кислот, смесей кислот и солей слабых многоосновных кислот.
- •16. Окислительно-восстановительных потенциал. Зависимость потенциала от различных факторов.
- •17. Стандартный и формальный окислительно-восстановительный потенциалы. Константа равновесия Red-Ox реакций.
- •18. Расчет и построение кривых окислительно-восстановительного титрования.
- •19. Способы фиксации точки эквивалентности в red-ox титровании. Red-Ox индикаторы.
- •21. Йодометрия. Рабочие и стандартные растворы.
- •22. Условия йодометрических определений. Йодометрическое определение окислителей и восстановителей с примерами.
1. Метрологические характеристики анализа. Ход анализа
Целью аналитики является обеспечить зависимости от поставленной задачи, точность, высокая чувствительность, избирательность анализа. Бывает качественный и количественный анализ. Количественный анализ – определение концентраций или масс. Качественный анализ – обнаружение компонентов анализируемого образца. Выбирая метод анализа, необходимо знать цели и задачи, которые были поставлены при проведении анализа и учитывать массу анализируемого вещества (микроанализ), чувствительность (минимальная концентрация вещества, которую можно определить), избирательность (возможность определения нескольких компонентов анализируемого вещества), точность (качество анализа), стоимость. Ход анализа – отбор и усреднение пробы (метод квартавания), растворение пробы без потерь, разделение пробы (осаждение, возгонка), качественное определение, расчет результата анализа.
2. Погрешности в анализе. Классификация погрешностей. Правильность, воспроизводимость и точность анализа.
Погрешности
– систематические, случайные, грубые.
Систематическая погрешность – погрешность
измерения, которая при повторных
измерениях остается постоянной или
закономерно изменяется (абсолютная
(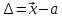 ),
относительная (
),
относительная (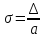 )).
Характеризует правильность анализа,
т.е. близость к 0. Случайные погрешности
– погрешности, которые при повторных
измерениях изменяются случайно.
Характеризует воспроизводимость анализа
– такое качество анализа, которое
характеризует близость результата в
разных условиях. Причин нету. Грубые
погрешности – существенно превышающие
ожидаемый результат при данных условиях.
Точность – такое качество анализа,
которое характеризует близость
полученного результата к истинному
значению.
)).
Характеризует правильность анализа,
т.е. близость к 0. Случайные погрешности
– погрешности, которые при повторных
измерениях изменяются случайно.
Характеризует воспроизводимость анализа
– такое качество анализа, которое
характеризует близость результата в
разных условиях. Причин нету. Грубые
погрешности – существенно превышающие
ожидаемый результат при данных условиях.
Точность – такое качество анализа,
которое характеризует близость
полученного результата к истинному
значению.
3. Общая характеристика реакций в растворах. Активность, коэффициент активности.
Требования
к реакциям, применяемом в объемном
анализе: 1) Реакция должна протекать в
строгом стехиометрическом соотношении;
2) Реакция должна протекать до конца; 3)
Реакция должна протекать с высокой
скоростью и без побочных продуктов; 4)
Должна существовать возможность фиксации
точки эквивалентности; 5) Изменение
внешних условий, в которых выполняется
анализ, не должно влиять на ход реакции
и свойства конечных продуктов. Активность
– количество эффективных столкновений
частиц, приводящих к химическому
взаимодействию (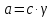 ).
Коэффициент активности (
).
Коэффициент активности ( )
– величина, которая показывает, какую
часть эффективное столкновение составляет
отношение частиц в растворе, т.е.
концентрация.
)
– величина, которая показывает, какую
часть эффективное столкновение составляет
отношение частиц в растворе, т.е.
концентрация.
4. Протолитическая теория диссоциации. Кислоты и основания, амфолиты. Автопротолиз.
Протолитическая
теория диссоциации Бренстеда-Лоури –
реакция взаимодействия кислоты и
основания приводит к образованию новой
кислоты. По этой теории кислота –
вещество, которое в растворе отдает
протон водорода, а основание – принимает
этот протон. Протолиты – либо отдают,
либо принимают ион водорода. Амфолиты
– и отдают, и принимают ион водорода
(аммиак, вода). Автопротолиз – то, что
происходит с растворителем.
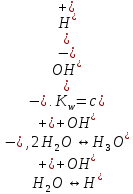 .
.
5. Равновесия в растворах сильных и слабых кислот и оснований. Расчет концентрации ионов водорода и рН в растворах сильных и слабых кислот и оснований.
6. Расчет концентрации ионов водорода и рН в растворах сильных кислот очень малой концентрации и в растворах очень слабых кислот малой концентрации.
7. Равновесия в растворах гидролизующихся солей. Расчет концентрации ионов водорода и рН в растворах гидролизующихся солей.
8. Буферные растворы. Расчет концентрации ионов водорода и рН в буферных растворах.
Буферные
растворы – растворы, при добавлении
небольших количеств сильной кислоты и
сильного основания, рН практически не
меняется или меняется незначительно.
Буферным действием обладает сильная
кислота или сильное основание. Состоит
из: 1) Слабой кислоты и ее соли, либо
слабого основания и ее соли; 2) Средней
и кислой соли; 3) 2-х кислых солей. Уравнение
Гендерсона
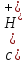
9. Равновесия в растворах слабых многоосновных кислот и смесей кислот. Расчет концентрации ионов водорода и рН в растворах слабых многоосновных кислот.
10. Сущность титриметрического анализа. Требования к реакциям, применяемым в титриметрии. Приемы титрования.
Анализу могут подвергаться кислоты, основания, гидролизующиеся соли. Кислота – вещество, которое в растворе диссоциирует на иона Н+ и анионы кислотного остатка. Щелочь – вещество, которое диссоциирует с образованием иона Ме+ и гидроксогрупп. При диссоциации соединений, имеющих ионную связь, происходит разрыв связей и образование гидратированных ионов. При диссоциации вещества, имеющего ковалентно-полярную связь за счет диполей Н2О, происходит поляризация связей, увеличивается длина связей и уменьшается ее прочность, а потом связь разрывается.
