
Классификация реакций
В рассмотренных примерах наблюдается гетеролитический тип образования связи. Одна из классификаций реакций основывается на природе реагента - реакции электрофильного и нуклеофильного замещения. По механизму превращения различают также реакции присоединения реагентов к молекуле или отщепления заместителя от молекулы.
Если реагирующие частицы содержат по одному неспаренному электрону, тип образования связи гомолитический (радикальные реакции). В особую группу выделяют перициклические реакции с циклическим переносом электронов, при котором нет заряженных или свободнорадикальных частиц. Примером служит реакция Дильса – Альдера. Различают по механизму также мономолекулярные и бимолекулярные реакции. Если, например, лимитирующей стадией процесса является разрыв связи в субстрате реакции и быстрое взаимодействие образовавшегося иона с другой молекулой, то реакции называют мономолекулярными. Если в лимитирующей стадии процесса участвуют две молекулы – бимолекулярные. По принятой номенклатуре реакции кратко обозначают с помощью букв и цифр, учитывающих тип реакции, реагент и число участвующих молекул. Первая буква – тип реакции: S (substitution), A (addition), E (elimination) – замещение, присоединение и отщепление. Вторым подстрочным символом обозначают тип реагента – N (nucleophilic), E (electrophilic), R (radical) – нуклеофильный, электрофильный и радикальный. Третий символ – цифра, 1 – мономолекулярные реакции, 2 – бимолекулярные. Например, SN1, SR2, SE2. Специфику реакций ароматических соединений обозначают – Ar. Так реакции электрофильного замещения в ароматическом цикле обозначают SE2Ar или более кратко - SEAr.
Реакции, использующиеся в промышленном органическом синтезе, как правило, хорошо изучены. Это можно продемонстрировать на примере реакций электрофильного замещения в ряду ароматических и гетероароматических соединений SEAr. Механизм и закономерности проведения других процессов будут рассмотрены в соответствующих разделах.
Механизм и кинетика реакций
Реакции электрофильного ароматического замещения имеют общий механизм, который можно представить следующей схемой:
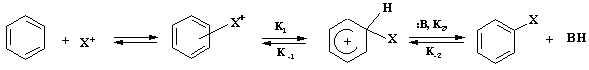 ,
,
p-комплекс s- комплекс (s-аддукт)
где: реагент Х+ - электрофильная частица, имеющая целочисленный или частично положительный заряд, а бензольный цикл является обобщенной формулой ароматического соединения; К1 - константа скорости прямой реакции образования s-аддукта, К-1 – обратной реакции, К2 – константа скорости образования целевого продукта, К-2 – обратной реакции, :В – основание, связывающее уходящий протон.
Для понимания закономерностей реакций полезно использовать формальный кинетический анализ. Рассмотрим общее кинетическое уравнение. Скорость реакции - увеличение концентрации конечного продукта во времени прямо пропорциональна константе скорости реакции - К2, концентрации s-аддукта и концентрации агента, связывающего уходящий протон:
V=
![]() =K2
[Ar HX+][B]
(уравнение 3)
=K2
[Ar HX+][B]
(уравнение 3)
Накопления s-аддукта в реакционной массе не наблюдается. Поэтому текущую, стационарную концентрацию этого продукта можно вычислить, приравняв ее приход расходу:
Скорость образования промежуточного продукта
![]() =
K1 [ArH]
[X+] (уравнение 4)
=
K1 [ArH]
[X+] (уравнение 4)
Скорость расхода промежуточного продукта
![]() =
K2[ArHX+][B]
+ K –1 [ArHX+]
(уравнение 5)
=
K2[ArHX+][B]
+ K –1 [ArHX+]
(уравнение 5)
Приравниваем правые части уравнений 4 и 5:
K1 [ArH] [X+] = (K2 [B] + K-1) [ArHX+] (уравнение 6)
После чего легко найти формулу расчета текущей концентрации сигма-аддукта:
![]() (уравнение
7)
(уравнение
7)
Зная формулу расчета концентрации s-аддукта, выраженную через экспериментально определяемые величины, можно рассчитать скорость реакции:
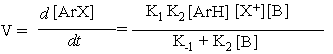 (уравнение
8)
(уравнение
8)
С помощью анализа уравнения 8 довольно сложно проследить влияние реагентов на скорость процесса. Необходимо определить или знать лимитирующую стадию реакции. Во многих случаях величина К-1 существенно меньше, чем К2[B] и этим слагаемым можно пренебречь. В связи с этим кинетическое уравнение существенно упрощается:
V = k1[ArH][X+] (уравнение 9)
Поэтому главными являются константа скорости реакции образования s-аддукта и концентрация электрофильной частицы. Энергетическая диаграмма реакции, графически отображающая этот вариант, приведена в начале раздела.
Во втором случае лимитирующей стадией процесса является отрыв протона. Тогда K-1 >> K2[B] и последним слагаемым знаменателя можно пренебречь. Кинетическое уравнение имеет следующий вид:
