
Теоретические аспекты выбора метода синтеза
Классификация реагентов и реакций, механизмы реакций, энергетика, кинетика, влияние заместителей и растворителей.
При разработке оптимального плана синтеза субстанции лекарственного препарата необходимо использовать весь богатый арсенал методов органической химии, применительно к возможности их использования в технологически приемлемых условиях. Необходимо знать как сами методы, так и условия проведения реакций, закономерности их протекания, использующееся технологическое оборудование, способы выделения и очистки соединений.
При рассмотрении закономерностей процессов, использующихся при разработке методов синтеза препарата, в первую очередь необходимо знать классификацию реагентов и реакций, механизмы реакций, их энергетику, кинетику, влияние заместителей и растворителей.
Хорошо известно, что реакции протекают в результате эффективного соударения двух частиц. Атакуемую частицу называют субстратом реакции, атакующую – реагентом. Возможность прохождения реакции с точки зрения термодинамики контролируется изменением свободной энергии системы:
DG = DH - TDS
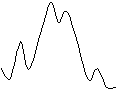
где DH, DS – энтальпийная и энтропийная составляющие. Если свободная энергия исходной системы выше свободной энергии продуктов реакции, то принципиально реакция может идти без подвода энергии извне. Однако при этом скорость реакции может быть ничтожно мала. Для того, чтобы осуществить реакцию с заметной скоростью, необходимо преодолеть энергетический барьер, называемый свободной энергией активации (DG ¹). При этом возникает переходное состояние или образуется промежуточное соединение либо конечный продукт. В переходном состоянии наблюдается частичное образование связи, в промежуточном соединении и конечном продукте возникает новая ковалентная связь. Эту ситуацию можно отразить с помощью энергетической диаграммы реакции. Для ряда реакций замещения в ряду ароматических соединений диаграмма имеет следующий вид:
![]() DG
DG
![]()
![]() Ордината
– изменение свободной энергии системы
реагентов, абсцисса– координата реакции,
Ордината
– изменение свободной энергии системы
реагентов, абсцисса– координата реакции,
1 - p-комплекс субстрата и реагента;
2 - s- комплекс;
![]() 3
– второй p-комплекс.
3
– второй p-комплекс.
![]()
1 2 3
Субстрат и реагент через небольшой барьер образуют p-комплекс, при преодолении более высокого энергетический барьера - s-комплекс и далее через один или два барьера (два - с получением преддиссоциативного p-комплекса) конечный продукт. В субстрате реакции чаще всего имеется несколько атомов, на которые может быть направлена атака реагента. Для образования связи необходимо электростатическое притяжение реакционных центров, то есть реагирующие атомы субстрата и реагента должны иметь различные по знаку заряды. Кроме того, на занятой молекулярной орбитали (ЗМО) электронодонорной молекулы необходимо иметь пару электронов, которая способна при сближении частиц взаимодействовать со свободной молекулярной орбиталью (СМО) (дыркой) электроноакцепторной молекулы.
Рассмотрим реакцию между электронодонорной молекулой S и электроноакцепторной молекулой T. Занятая молекулярная орбиталь (ЗМО) молекулы S, содержащая пару электронов, взаимодействует со свободной орбиталью (СМО) молекулы T, в результате чего возникает новая связь:
![]()
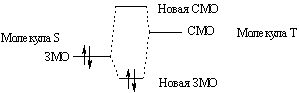
Таким образом, для протекания реакции на атоме s, который является реакционным центром электронодонорной молекулы S, имеется пара электронов, отрицательный или частично отрицательный заряд и относительно большой коэффициент атомной орбитали (АО) высшей занятой молекулярной орбитали (ВЗМО). На реакционном центре t электроноакцепторной молекулы T имеется положительный или частично положительный заряд и относительно высокое значение коэффициента АО низшей свободной молекулярной орбитали (НСМО). ВЗМО и НСМО называют граничными орбиталями. По общей многоэлектронной теории возмущений (метод ВМО) изменение полной энергии DЕполн. при частичном образовании связи между атомами s и t молекул S и T в растворителе с эффективной диэлектрической константой e описывается следующим фундаментальным уравнением (уравнение Клопмана):
