
- •Введение
- •Раздел I. Теоретические основы общей и медицинской генетики. Глава 1. Вопросы молекулярной генетики
- •1.1. Структура и функции нуклеиновых кислот. Строение молекул днк и рнк
- •1.3. Генетический код и этапы реализации генетической информации.
- •Генетический код мРнк
- •1 Рис.11. Четвертичная структура Молекулы гемоглобина человека .4. Регуляция активности генов
- •Тестовые задания
- •Глава 2. Закономерности наследования признаков. Внутриаллельные отклонения от законов наследования
- •2.1. Учение о законах наследования различных признаков.
- •2.2. Затруднения в интерпритации наследования признаков при неполном доминировании.
- •Стадии четырех хроматид в пахинеме мейоза
- •2.3. Группы крови. Резус - система
- •Тестовые задания
- •Тестовые задания для самоконтроля по наследованию групп крови:
- •Глава 3. Взаимодействие неаллельных генов
- •Тестовые задания
- •Глава 4. Биология и генетика пола
- •4.1. Теории определения пола
- •Примеры формирования пола в животном мире
- •4.2. Признаки пола
- •4.3. Формирование пола человека
- •4.4. Гоносомное наследование (частичное, полностью сцепленное, голандрическое)
- •4.5. Гипотеза м. Лайон
- •Тестовые задания и вопросы для самоконтроля
- •Глава 5. Методы исследования в генетике человека. Кариотип
- •5.1. Строение хромосом и их морфология
- •5.2. Денверская классификация хромосом
- •Группы хромосом и их характеристика
- •5.3. Парижская классификация хромосом
- •Тестовые задания
- •Глава 6. Изменчивость, ее виды и механизмы
- •6.1. Виды изменчивости
- •6.2. Генетические концепции канцерогенеза
- •Тестовые задания
- •Глава 7. Популяционная генетика
- •7.1. Популяционная структура вида
- •7.2. Старение и смерть
- •Тестовые задания
- •Раздел II. Освоение практических навыков.
- •Занятие 4. Биология и генетика пола.
- •Занятие 5. Методы исследования в генетике человека. Кариотип.
- •Задачи на составление и анализ родословных
- •Занятие 6. Изменчивость, ее виды и механизмы.
- •Занятие 7. Популяционная генетика
- •Краткий терминологический словарь
- •Список литературы
- •Оглавление
- •Общая и медицинская генетика Учебное пособие
- •428015 Чебоксары, Московский просп., 15
1 Рис.11. Четвертичная структура Молекулы гемоглобина человека .4. Регуляция активности генов
Существуют различные системы регуляции активности (экспрессии) генов, которые функционируют на разных этапах реализации генетической информации. Первая модель генетического контроля биосинтеза белков была предложена французскими учеными Ф.Жакобом и Ж. Моно (F.Jacob, J.Monod, 1961). Авторы ввели понятие об опероне как единице координированной экспрессии генов (единице генетической регуляции).
На примере регуляции синтеза ферментов, необходимых для использования углевода лактозы, было установлено, что клетками кишечной палочки (Escherichia coli) оперон регулирует активность структурных генов на этапе транскрипции генетической информации.
В лактозном опероне Е.соli находятся структурные гены (обозначены символами А,В,С), которые кодируют синтез трех различных белков-ферментов, участвующих в утилизации лактозы. Так, фермент ß-галактозидаза расщепляет молекулу лактозы с образованием двух моносахаридов (глюкозы и галактозы); галактозидпермеаза обеспечивает активный транспорт лактозы в бактериальную клетку из окружающей среды. Роль же третьего фермента (трансацетилазы) еще точно не установлена.
Помимо указанных генов в структуре оперона выделяются акцепторные участки (специфические нуклеотидные последовательности ДНК), к которым прикрепляются РНК-полимеразы (промотор), белок-активатор (инициатор), белок-регулятор, или репрессор, (оператор) и участок, обеспечивающий прекращение синтеза мРНК—терминатор.
Функционирование лактозного оперона Е.соli основано на принципе негативной индукции. Данное название было получено вследствие того, что регулирующий белок (репрессор) оказывает отрицательный эффект, блокируя при связывании с опероном транскрипцию структурных генов. Лактоза же выступает в качестве индуктора этого процесса, связывая белок-репрессор, активируя ген-оператор, что сопровождается синтезом соответствующих ферментов (рис.12).
П
Рис. 12. Лактозный
оперон Е. coli:
структурный ген
А несет информацию о строении
ß-галактозидазы, В – о строении
галактозидпермиазы,
С – трансацетилазы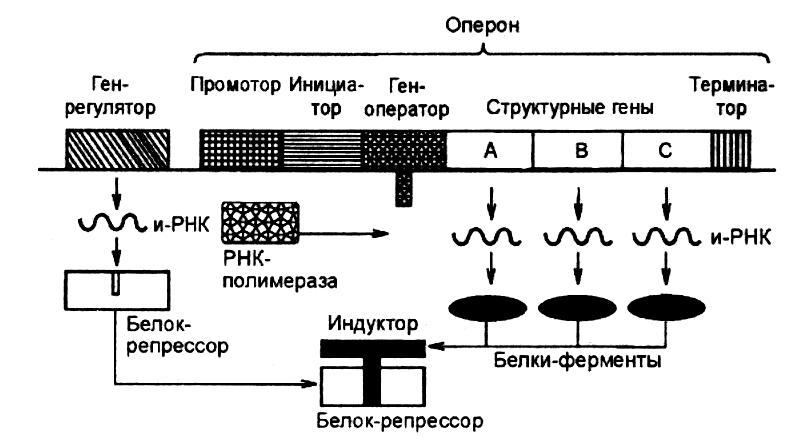
Появление лактозы в среде обитания бактерий может сопровождаться проникновением небольших ее количеств в бактериальную клетку. При этом лактоза начинает выступать в роли эффектора. Она присоединяется к определенному участку молекулы белка-репрессора, тем самым изменяя конфигурацию этой молекулы и ее инактивируя (аллостерический эффект). Неактивный репрессор теряет способность соединяться с оператором, что делает возможным инициацию транскрипции с последующим синтезом полигенной молекулы мРНК. На этапе трансляции генетической информации осуществляется синтез трех указанных ферментов, необходимых для усвоения бактериальной клеткой лактоз. Транскрипция вновь будет заблокирована непрерывно синтезируемым репрессором после расщепления всей лактозы, имеющейся в клетке и при ее отсутствии в окружающей среде.
Таким образом, можно заключить, что работа лактозного оперона (как и других изученных бактериальных оперонов) осуществляется по принципу саморегуляции на основе обратной связи. Согласно данному принципу время синтеза и количество синтезируемого белка-фермента определяются его необходимостью для обеспечения того или иного метаболического процесса, связанного с жизнедеятельностью клетки.
При дальнейшем изучении работы лактозного и других оперонов бактерий было выявлено, что помимо негативного (репрессорного) механизма регуляции транскрипции в этих оперонах имеется также позитивный механизм, приводящий белки через определенные активации к транскрипции. Так, в случае лактозного оперона установлено существование такого белка, который активируется путем связывания с циклическим аденозинмонофосфатом (АМФ). Затем белок-активатор соединяется со специфическим участком в начале промоторной части и обеспечивает нормальное прикрепление и дальнейшее функционирование РНК-полимеразы.
Было установлено также, что такой белок, активированный цАМФ, является фактором позитивной регуляции транскрипции не только лактозного оперона, но и нескольких других катаболизирующих оперонов Е. сoli. Если в клетке имеется достаточное количество глюкозы либо другого легко усваиваемого моносахарида, то активируется работа соответствующего оперона, тем самым происходит утилизация углеводов. При снижении концентрации цАМФ происходит репрессия группы оперонов, включая лактозный. Если в клетке нет достаточного количества глюкозы и других моносахаридов, то концентрация синтезируемого цАМФ возрастает. В связи с этим при наличии лактозы становится возможной активация paботы лактозного оперона с помощью белка-активатора, обеспечивающего нормальное функционирование РНК-полимеразы в этом опероне, т.е. бактерии начинают использовать менее выгодный, чем глюкоза, источник углерода.
Е
Рис. 13. Схема
регуляции транскрипции
у эукариот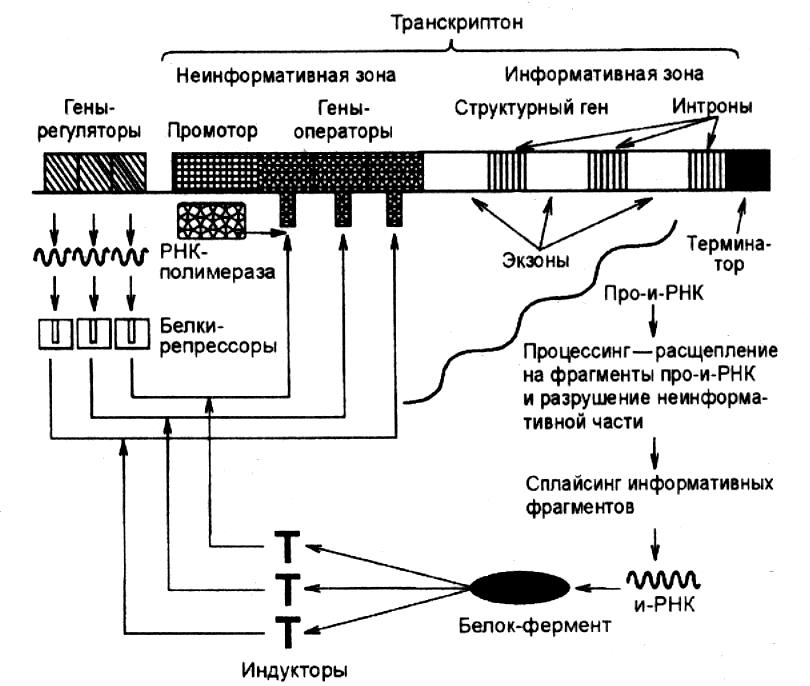
Как известно, к числу особенностей эукариот относится прерывистая (мозаичная) структура их генов и связанный с этим процессинг РНК. Так, например, если при типичном варианте сплайсинга мРНК, состоящей из 5 экзонных участков, происходит их соединение в последовательности 1—2—3—4—5, то при альтернативном сплайсинге возможны иные варианты (2—3—1—4—5, 3—4—2—1—5 и др.). В результате на основе одной и той же нуклеотидной последовательности конкретного гена могут формироваться разные варианты белковых молекул, которые будут представлять собой структуры, состоящие из разных сочетаний одних и тех же аминокислотных блоков. Следовательно, в этом случае проявляется принцип достаточно экономного использования имеющейся генетической информации эукариотического организма в разные периоды его жизнедеятельности. У эукариот наблюдается также групповая регуляция активности генов на этапе транскрипции, связанная с особенностями организации гетерохроматиновых и эухроматиновых участков их хромосом.
В настоящее время известны механизмы регуляции активности генов, которые действуют и на этапе трансляции генетической информации в клетке. У бактерий имеется не менее трех белковых факторов, участвующих в регуляции инициации трансляции, которые обозначаются символами IF- 1, IF- 2, IF- 3 (от англ. initiation factor — фактор инициации).
При образовании инициирующего комплекса фактор IF-3 связывается с 30S-субъединицей рибосомы, препятствуя преждевременному объединению малой и большой субъединиц. Фактор инициации IF-1 соединяется с инициирующей аминоацил-тРНК, несущей формилметионин, и при участии IF-2 обеспечивает ее правильное прикрепление к а-участку малой субъединицы рибосомы, завершая формирование инициирующего комплекса. Инициация заканчивается объединением рибосомных субъединиц 30S и 50S, которое сопровождается освобождением всех трех факторов инициации, покидающих рибосому. У эукариот имеется другой набор инициации трансляции, механизм действия которого является менее изученным. Стадии элонгации и терминации трансляции также регулируются соответствующими белковыми факторами как у прокариот, так и у эукариот. Как уже отмечалось, завершение трансляции связано с вступлением в а-участок рибосомы одного из терминирующих кодонов мРНК (УАА, УАГ, УГА). Эти кодоны узнаются соответствующими белковыми факторами терминации, которые обеспечивают разрушение связи между последней тРНК и мРНК в р-участке рибосомы и освобождение синтезированного полипептида, а также диссоциацию рибосомных субъединиц.
Можно полагать, что регуляция экспрессии генов осуществляется и на этапе посттрансляционной модификации полипептидов, однако механизмы такой регуляции исследованы недостаточно. Оценивая особенности генетической регуляции биосинтеза белков у эукариот, необходимо отметить, что в случае многоклеточных организмов, включая человека, ее механизмы являются исключительно сложными и имеют многоуровневый характер, не ограничиваясь лишь процессами, происходящими в рамках одной клетки.
