
- •2. Матеріали та методи дослідження
- •2.1 Етапи дослідження матеріалу в бактеріологічній лабораторії
- •2.2 Визначення чутливості до антибіотиків
- •3.Результати та їх обговорення
- •3.1 Аналіз складу мікрофлори вагітних жінок.
- •3.2 Оцінка мікроорганізмів виявлених при обстеженні урогенітального тракту вагітних.
- •6.3 Визначення чутливості до антибіотиків мікроорганізмів виділених при обстежені урогенітального тракту.
3.Результати та їх обговорення
Дипломна робота виконана у бактеріологічній лабораторії при медико-діагностичному центрі «Север» міста Кривого Рогу. В задачі дослідження входило проведення визначення складу мікрофлори урогенітального тракту жінок визначення змін мікрофлори урогенітального тракту, що відбуваються під час вагітності та при патологіях. В ході виконання роботи було обстежено 500 жінок на склад мікрофлори. В експериментальну частину включено результати які були отримані протягом 2012 року .
3.1 Аналіз складу мікрофлори вагітних жінок.
Результати бактеріологічного дослідження урогенітального тракту наведено в таблицях 3.1 та 3.2. За весь період дослідження було обстежено 500 жінок на різних термінах вагітності. Із 500 обстежених жінок відхилення у складі мікрофлори урогенітально тракту було виявлено у 210 жінок, що склало 42% від всіх обстежених (таблиця 3.1).
Таблиця 3.1
Результати бактеріологічного дослідження урогенітально тракту вагітних
Загальна кількість обстежених |
Кількість жінок з нормальною мікрофлорою |
Кількість виявлених порушень нормальної мікрофлори |
||
абс. |
% |
абс. |
% |
|
500 |
290 |
58 |
210 |
42 |
Із 500 жінок 200 знаходились на І триместрі вагітності , 200 - на ІІ триместрі і 100 на ІІІ триместрі. Із 200 жінок в період І триместру вагітності було виявлено відхилення від норми у 92 осіб, що склало 46%. При обстежені жінок в ІІ триместрі відхилення від норми спостерігалось у 79 осіб (39,5%). На третьому триместрі вагітності склад нормальної мікрофлори був виявлений у 61 особи, що склало 61% від обстежених. Відхилення від нормального складу мікрофлори спостерігалось у 39 осіб (39%). Результати наведені в таблиці 3.2
Таблиця 3.2
Результати бактеріологічного дослідження урогенітально тракту вагітних
Термін вагітності |
Загальна кількість обстежених |
Кількість жінок з нормальною мікрофлорою |
Кількість виявлених порушень нормальної мікрофлори |
||
абс. |
% |
абс. |
% |
||
І триместр |
200 |
108 |
54 |
92 |
46 |
ІІ триместр |
200 |
121 |
60,5 |
79 |
39,5 |
ІІІ триместр |
100 |
61 |
61 |
39 |
39 |
Таким чином, аналіз складу мікрофлори на різних термінах вагітності показав, що найбільший відсоток відхилень від норми спостерігається в І триместрі вагітності, і поступово знижується.
3.2 Оцінка мікроорганізмів виявлених при обстеженні урогенітального тракту вагітних.
Аналіз структури мікроорганізмів, виявлених у досліджуємому матеріалі з урогенітального тракту показав, що із 210 штамів 25 (11,9%) були представлені грампозитивними бактеріями, 35 (16,7%) грамнегативними бактеріями, 150 - (71,4%) грибами роду Candida. Співвідношення грамнегативної , грампозитивної мікрофлори та грибів , наведено на рис.3.1.

Рис.3.1.Співвідношення грамнегативних, грампозитивних мікроорганізмів та грибів, виявлених при обстежені урогенітального тракту вагітних.
Ідентифікацію виділених культур проводили за морфологічним та фізіолого-біохімічними ознаками .
Грампозитивна мікрофлора, що склала 25 штамів від загальної кількості виявлених мікроорганізмів, була представлена коками.
Всі 25 штамів коків у мазках формували скупчення, що нагадували грони винограду (рис.3.2).
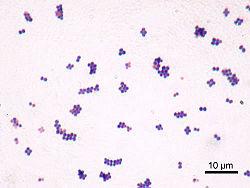
Рис. 3.2 Скупчення коків при мікроскопії.
Після закінчення терміну інкубації (18-24 години) утворились гладкі випуклі колонії кремового кольору. На середовищі ЖСА навколо колоній спостерігалась зона лецитовітелазної активності (рис.3.3).
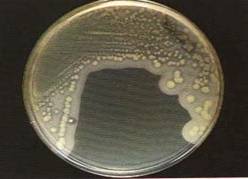
Рис.3.3 Ідентифікуємі колонії на сережовищі ЖСА.
На кров’яному агарі навколо утворених колоній спостерігалась зона повного гемолізу(рис.3.4).

Рис.3.4 Ідентифікуємі колонії на кров’яному агарі.
Для ідентифікації колоній був проведений тест на плазмокоагулазну активність. Для цього була використана свіжа кроляча суха плазма. В пробірку вносили 1 петлю добової агарової культури досліджуємого штаму, котру суспендували в плазмі. Штатив з пробірками поміщали до термостату при 370С і реєстрували результати реакції через 1, 2, 4, та 18 годин інкубації. Приклад позитивної та негативної реакції зображено на рис.3.5.
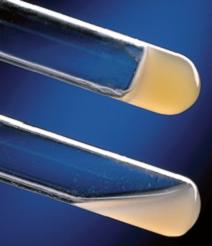
Рис.3.5 Приклади позитивного(верхній) та негативного(нижній) результатів.
Результати реакції досліджуємих штамів були отримані позитивні.
Для остаточної ідентифікації було проведено визначення ДНК-ази . Для цього добову агарову культуру досліджуємого штаму засіяли короткими штрихами на поверхні підсушеного агару. Після 18 – 24 годин інкубації при 370С поверхню агара залили невеликою кількістю розчину HCL. Через 2-3 хвилини кислоту злили. В результаті навколо культури спостерігалась прозора зона котра в 4 рази перевищувала зону мікробного росту, що свідчило про позитивний результат реакції. Всі проведені тести підтверджували що виявлені бактерії належать до роду Staphylococcus виду Staphylococcus aureus.
При аналазі кількості грампозитивної мікрофлори на різних термінах вагітності було виявлено, що найбільше грампозитивних коків виявлено в І триместрі вагітності – 15осіб це складає 60% від всіх виявлених стафілококів. На другому триместрі виявлено 7 осіб носіїв Staphylococcus aureus, що склало 28%, на третьому триместрі виявлено 3 носії це 12% (рис.3.6).

Рис.3.6 Кількість випадків виявлення Staphylococcus aureus на різних термінах вагітності
Представники грамнегативної мікрофлори виявлені при обстежені урогенітального тракту вагітних були представлені 35 штамами. Ці штами були представлені прямими рухливими паличками розташованими парами чи поодиноко.
На щільних середовищах давали плоскі опуклі каламутні S-колонії з рівними або злегка хвилястими краями чи сухі плоскі R-колонії з нерівними краями. На середовищі Єндо ці штами утворювали червоні колонії з металевим блиском або рожеві колонії (рис3.7).

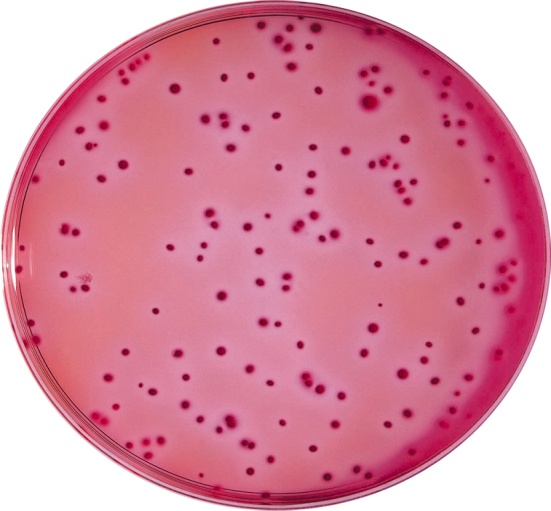
Рис.3.7 Колонії що виросли на Ендо
Деякі штами при рості на щільних поживних середовищах утворювали феномен «роїння» на середовищі Ендо такі штами мали безкольорні колонії. Отримані колоній зображено на рисунку 3.8
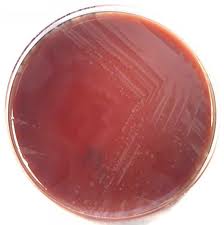
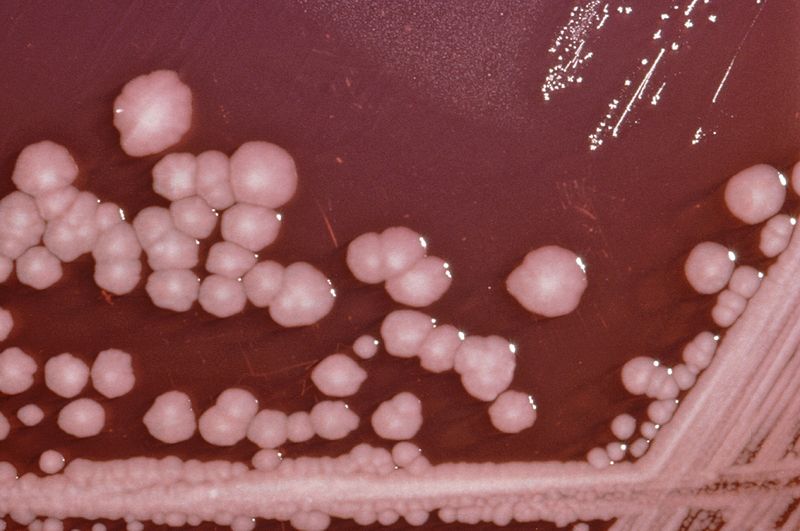
Рис.3.8 Колонії що виросли на кров’яному агарі та Ендо.
Намічені колонії було знято бактеріологічною петлею та засіяно штрихом покосяку та уколом у стовпчик на комбіноване середовище Олькеницького для первинної ідентифікації. На наступний день на поверхні скошеного середовища Олькеницькаго спостерігався однорідний вологий ріст. Завдяки цьому досліду було визначено ферментацію глюкози, сахарози, лактози. Було виявлено, що один з досліджуємих штамів ферментує всі ці цукри, це проявилось зміненням кольору стовпчика середовища. Другий досліджуємий штам не змінив кольору середовища що могло вказувати на його здатність гідролізувати сечовину котра була наявна у складі середовища. Таким чином було визначено гідроліз сечовини досліджуємими штамами. У першого штаму цей тест був позитивним (змінився колір середовища), у іншого штаму – негативний (колір середовища не змінився). Завдяки посіву на середовище Олькеницького було визначено утворення H2S, що проявилось почорнінням середовища у другого штаму. Результати зображені на рис.3.9.
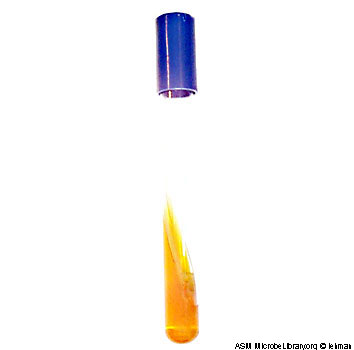

Рис.3.9 Результат посіву на середоище Олькеницького.
Для ідентифікації виявлених штамів було проведено мінімально необхідні тести для встановлення родової та видової належності. Серед таких тестів було визначено синтез феніланіндезамінази. Для цього було приготоване спеціальне середовище на котре було здійснено посів досліджуємих штамів. Після проведення інкубації при 370С протягом 20-24 годин на посів було ненесено декілька крапель 10% розчину хлористого заліза. В результаті один з посівів змінив колір на світло зелений, що говорить про позитивний результат реакції. Посів з другим досліджуємим штамом не змінився – негативний результат реакції. Результат зображено на рисунку 3.9.

Рис. 3.10 Позитивний та негативний результат реакції синтезу феніланіндезамінази
Для ідентифікації культур також було проведено реакцію Фогеса-Проскауера та реакцію з метиловим червоним. Для цього досліджуємі штами було засіяно на середовище Кларка посіви помістили до термостату при 370С на 24 години. По закінчення терміну інкубації було проведено тест з метиловим червоним. Для цього до добової культури досліджуємого штаму було додано 5 крапель розчину метилового червоного. Поява червоного забарвлення свідчить про позитивний результат котрий спостерігався у обох досліджуємих штамів. Приклад позитивного та негативного результату зображено на рис.3.10

Рис.3.11 Приклад позитивної та негативної реакції з метиловим червоним.
Додатково було проведена раекція Фогеса – Проскауера. Для проведення рекції було обрано модифікацію Барріта так як вона є більш чутливою. Для проведення було використано добову культуру досліджуємого штаму засіяну на середовище Кларка в котре додали 3 мл 5% альфа-нафтолу в абсолютному спирті та 1 мл 40% КОН. Протягом 5-15 хвилин спостерігалась поява рожевого забарвлення в верхній частині середовища. З двох досліджуємих штамів позитиний результат спостерігався в одному.
Для ідентифікації також було зроблено посіви досліджуємих штамів на цитрат Сімонса. Посіви інкубували в термостаті при 370С протягом 24 годин. В результаті один з досліджуємих штамі змінив колір середовища з зеленого на синій що свідчило про позитивний результат. Другий посів не змінився – негативний результат реакції. Приклад позитивного та негативного результату зображено на рис.3.12

Рис.3.12 Посів на середовище Сімонса (праворуч – позитивний, ліворуч-негативний).
Під час ідентифікації також було визначено рухливість досліджуємих штамів. Для цоьго було використане середовище ТТХ. Після проведення інкубації посіву при 370С протягом 24 годин ріст досліджуємих штамів спостерігався по всьому стовпчику середовища що говорить про рухливість досліджуємих штамів. Приклад позитивного та негативного результату зображено на рис.3.13.

Рис.3.13 Визначення рухливості досліджуємих штамів (праворуч позитивний результат, ліворуч - негативний)
В результаті отриманих даних 25 з досліджуємих штамів було віднесено до роду Escherichia виду Escherichia coli , 10 – до виду Proteus mirabilis. Структура грамнегативної мікрофлори виявленої у піхві вагітних представлена на рис.3.14.

Рис.3.14. Структура грамнегативної мікрофлори урогенітального тракту вагітних жінок.
Таким чином , серед грамнегативної мікрофлори переважали бактерії виду Escherichia coli , які було виявлено у 25 випадках, що склало 71,4%. Рідше зустрічались бактерії виду Proteus mirabilis – 10 штамів, що склало 28,6% від всієї виявленої грамнегативної мікрофлори.
При аналізі виявленої грамнегативної мікрофлори на різних термінах вагітності виявлено, що найбільша кількість випадків припадає на І триместр вагітності 17 осіб – 48,6% від всієї виявленої грамнегативної мікрофлори. В період ІІ триместру кількість виявлення грамнегативної мікрофлори дещо знижується 15 осіб – 42,8%. В ІІІ триместрі кількість виявлення найнижча 3 особи – 8,6% (рис.3.15)
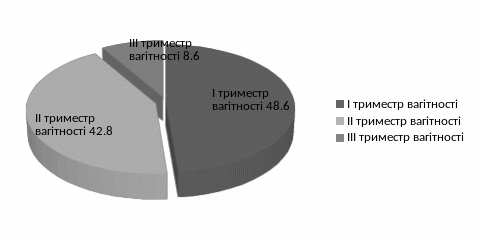
Рис.3.15.Кількість випадків виявлення грамнегативних бактерій на різних термінах вагітності.
Інші представники мікрофлори урогенітального тракту були представлені грибами роду Candida. Кількість виявлених штамів склала 150. Всі виявлені штами добре росли на середовищі Сабуро. Колонії мали круглу або злегка овальну форму, білувато-кремового кольору , були блискучими, гладкими, мали м’яку консистенцію рис.3.16
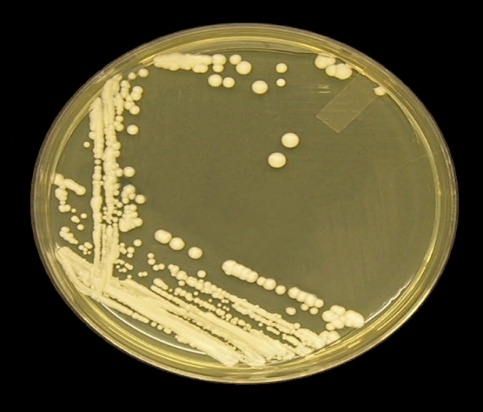
Рис.3.16 Колонії грибів на середовищі Сабуро.
Першим етапом ідентифікації отриманих колоній було проведення мікроскопічного дослідження. Під час мікроскопії було виявлено овальні клітини рис.3.17.
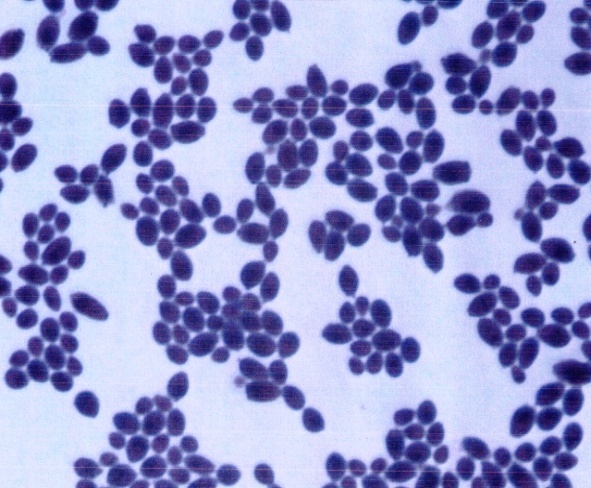
Рис.3.17 Клітини виявлені при мікроскопії
Проведення мікроскопії дало змогу підтвердити що колонії отримані на середовищ Сабуро належать до грибів. Для подальшої ідентифікації та встановлення виду виявлених грибів було проведено визначення біохімічних властивостей. Для цього було виконано посіви на середовища з лактозою, глюкозою, мальтозою, сахарозою, галактозою. В результаті було визначено що виділені штами ферментують глюкозу, мальтозу та галактозу до кислоти та газу, але не ферментують лактозу та сахарозу. Сукупність проведених тестів по морфологічним, культуральним та біохімічним властивостям виявлених штамів дозволив ідентифікувати виявлений мікроорганізм. Виявлені штами було віднесено до грибів роду Candida виду Candida albicans. Морфологічні, культуральні та біохімічні властивості грибів наведено у таблиці 3.3.
Таблиця 3.3
Морфологічні, культуральні та біохімічні властивості грибів роду Candida
Вид гриба
|
Морфологія |
Характер росту на середовищах |
Ферментація вуглеводів |
||||||
форма клітин |
особливі прикмети |
щільні (колонії) |
рідкі |
лактоза |
глюкоза |
мальтоза |
сахароза |
галактоза |
|
C.albicans |
Круглі або злегка овальні |
Хламі-доспори |
Гладкі,випуклі, кремово-білого кольору, м’якої консистенції |
Рихлий осад на дні, злегка мутний бульйон |
- |
кг |
кг |
- або к |
кг |
C.tropicalis |
Овальні |
Псевдо-конідії |
Морщкуваті, біло-сірого кольору, кожистої або кришко-видної консистенції |
Кільце, осад, мутний бульйон, на поверхні ніжна сіра плівка, переходить на стінки |
- |
кг |
кг |
кг |
кг |
C.pseudo-tropicalis |
Мілкі-овальні |
- |
Плоскі з куполо-подібним центром, сірого кольору, сметан-ноподібної консистенції |
Осад, середовище прозоре |
кг |
кг |
- |
кг |
кг |
C. krusei |
Злегка витягнуті |
- |
Плоскі, гладкі, матові, буро-сірого кольору |
Широке кільце, заповзає на стінки, каламутить середовище |
- |
кг |
- |
- |
- |
C.guiller-mondi |
Овальні |
Немає або мало бласто-спор |
Випуклі, гладкі, блискучі, біло-кремового кольору |
Осад,слабке пристінне кільце |
- |
кг |
кг
|
кг |
кг
|
Умовні позначення кг- ферментація до кислоти та газу.
При аналізі кількості виявлених грибів на різних термінах вагітності були отримані такі результати. В І триместрі виявлена найбільша кількість грибів роду Candida – 60 осіб що склало 40% від всіх виявлених грибів. На другому триместрі виявлено 57 носіїв грибів – 38%, на третьому 33 особи носіїв це – 22% (Рис3.4.)

Рис.3.4. Кількість випадків виявлення грибів роду Candida на різних термінах вагітності.
