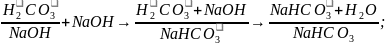- •Раздел 1. Общая биохимия Тема: Введение. Химический состав организма человека.
- •1. Введение в биохимию.
- •2 . Химический состав организма человека и его особенности.
- •2. Сухой остаток:
- •3. Свойства внутренней среды организма.
- •4. Понятие об обмене веществ. Роль обмена веществ в организме
- •Тема: Ферменты
- •1. Ферменты как биологические катализаторы.
- •2. Классификация ферментов.
- •3. Строение и механизм действия ферментов.
- •4. Специфические свойства ферментов.
- •Тема: Витамины
- •1. Витамины и их биологическая роль.
- •2. Классификация витаминов.
- •3. Особенности строения водо и жиро растворимых витаминов.
- •4. Понятие о механизмах действия витаминов.
- •Тема: Гормоны
- •1. Гормоны и их биологические свойства.
- •2. Классификация гормонов.
- •1. Биохимические изменения:
- •2. Физиологические изменения
- •3. Морфологические изменения
- •Тема: Биоэнергетика
- •1. Биоэнергетические процессы, основы жизнедеятельности организма.
- •2. Биологическое окисление веществ в организме.
- •3. Ферменты биологического окисления.
- •4. Биохимические механизмы биологического окисления в митохондриях.
- •Тема: Обмен углеводов
- •1. Биологическая роль углеводов.
- •2. Классификация углеводов.
- •Углеводы
- •3. Переваривание и усвоение пищевых углеводов.
- •4. Превращения углеводов в ткань.
- •5. Регуляция обмена углеводов.
- •Тема: Обмен липидов
- •1. Биологическая роль липидов.
- •2. Классификация липидов.
- •3. Переваривание и усвоение пищевых жиров.
- •4. Превращение липидов в тканях.
- •Тема: Белки
- •1. Биологическая роль белков.
- •2. Классификация белков.
- •3. Переваривание и усвоение пищевых белков
- •4. Превращение белков и аминокислот в тканях.
- •Раздел 2. Биохимия спорта Тема: Биохимия мышечной ткани.
- •1. Биологическая роль и строение мышечных волокон (клеток).
Раздел 1. Общая биохимия Тема: Введение. Химический состав организма человека.
Вопросы:
1. Введение в биохимию.
2. Химический состав организма человека и его особенности.
3. Свойства внутренней среды организма.
4. Понятие об обмене веществ. Роль обмена веществ в организме.
1. Введение в биохимию.
Биохимия – это наука о молекулярных основах жизни. Она изучает химический состав организма и биохимические процессы его жизнедеятельности.
Связана с анатомией, физиологией, спортивной медициной, теорией и методикой спортивной тренировки, курсом специализации по виду спорта.
2 раздела:
1. Общая биохимия – изучает химический состав организма и особенности обмена веществ в нём при обычных условиях жизнедеятельности.
2. Биохимия спорта – изучает особенности биохимической адаптации организма к интенсивным тренировочным и соревновательным нагрузкам, при систематическом занятием спорта и физической культуры.
2 . Химический состав организма человека и его особенности.
Элементарный состав.
В организме человека обнаруживают не менее 60 химических элементов.
Все элементы в зависимости подразделяют на три группы:
1. Основные: C, O, H, N – до 98%.
2. Макроэлементы: содержится в количествах >0,001% P, S, Ca, Na, K, Cl.
3. Микроэлементы: <0,001%: Cu, Fe, Co, B, Zn, Si, Mo.
Химический состав по веществам
Организм:
1. H2O (60-65%)
2. Сухой остаток:
органические (углеводы 1,5-2% , липиды 12-15%, белки 18-20%);
минеральные 3-5% (соли: карбонаты, фосфаты, хлориды, сульфаты и др.; кислоты: HCl; ионы: K+, Na+, Ca++, HCO3,).
Химический состав организма изменяется в зависимости от возраста и занятие спорта. В растущем организме больше воды и меньше УБЖ минеральных веществ. В пожилом возрасте содержание воды уменьшается, снижается содержание белков, может увеличивается содержание жиров.
При скоростно-силовых нагрузках в организме более значительно увеличивается содержание белков, креатин фосфата, ферментов анаэробного энергообеспечения, меньше накапливаются углеводы в мышцах и печени. При нагрузках на выносливость, более значительно увеличивается содержание углеводов в мышцах и печени. В меньшей степени увеличивается содержание белков. Лучше развиты системы ферментов аэробного обеспечения.
3. Свойства внутренней среды организма.
Под внутренней средой организма понимают – водные растворы различных веществ образующих биологические жидкости (кровь, лимфа, слюна, пищеварительные соки, моча, цитоплазма клеток, межклеточная жидкость и др.).
Одним из наиболее важных свойств внутренней среды является её активная реакция.
Под активной реакции среды понимают способность водных растворах влиять на химические и биологические свойства веществ в зависимости от концентрации ионов [H+], [OH-]. Другие ионы на активную реакцию среды не влияют.
Различают три вида реакции среды:
1. Нейтральная [H+]=[OH-], pH=7,0
2. Кислая среда [H+]>[OH-], pH<7,0
3. Щелочная среда [H+]<[OH-], pH>7,0
Активная реакция среды отражается в значениях водородного показателя pH=-lg[H+].
pHводы=-lg[10-7]=7,0
Ионное произведение воды – это произведение концентрации ионов водорода на концентрацию ионов OH. В любых растворах эта величина постоянная.
Величины pH в биологических жидкостях:
слюна – рН=6,8 (близкая к нейтральной).
желудочный сок – pH=1,5-2 (кислая).
кишечный сок – pH=7,9-9 (щелочная).
кровь – pH=7,4 (слабо щелочная).
моча – pH=5,5
Буферные системы организма.
Буферные системы – это двухкомпонентные химические системы обеспечивающие постоянство pH и активной реакции среды. При добавлении к буферному раствору сильной кислоты или щёлочи, один компонент нейтрализует избыток ионов H+, другой компонент – избыток ионов OH.
Сохранение стабильности pH обеспечивает стабильность биохимических процессов в клетках. Мы более чувствительны к изменению pH среды – ферменты, которые являются катализаторами химических процессов.
Буферные системы препятствуют снижению рН.
Основными буферными системами в организме являются:
бикарбонатная – H2CO3+NaHCO3
фосфатная – NaH2PO4+Na2HPO4
ацетатная – CH3COOH+CH3COONA
аммонийная – NH4Cl+NH4OH
белковая – белок-кислота+белок-соль
Молекулы белков содержат аминокислоты, в составе которых имеются свободные амина группы и карбоксильные группы.
Пример буферного действия: