- •Модуль 1
- •Модуль 3
- •Модуль 4
- •Содержательный модуль 1 «термодинамика»
- •1. Предмет и метод термодинамики
- •2. Термодинамическая система
- •3. Параметры состояния рабочего тела.
- •Отнеся работу расширения к 1 кг массы рабочего тела, получим
- •Лекция 4. Второй закон термодинамики (4) план
- •1. Энтропия
- •Из уравнения (2) следует, что в равновесном процессе
- •2. Общая формулировка второго закона
- •3. Прямой цикл карно
- •4. Обобщенный (регенеративный) цикл карно
- •5. Обратный цикл карно
- •7. Статистическое толкование второго
- •8. Эксергия
- •1. Изохорный процесс
- •При переменной теплоемкости
- •2. Изобарный процесс
- •3. Изотермический процесс
- •4. Адиабатный процесс.
- •5. Политропный процесс
- •Содержательный модуль 2 «реальные газы. Водяной пар»
- •Лекция 6. Термодинамические процессы
- •Реальных газов (4)
- •Содержательный модуль 3 «теплопередача» лекция 7. Основные случаи теплообмена. Теплопроводность (4) план
- •1. Определения
- •3. Теплоотдача между стенкой и жидкостью
- •4. Теплопередача через плоскую стенку
- •5. Теплопередача через цилиндрическую стенку
- •Лекция 8. Теплообмен соприкосновением (4) план
- •2. Вычисление коэффициентов теплоотдачи
- •3. Эмпирические формулы
- •5. Теплопередача к кипячей жидкости.
- •Лекция 9. Теплообмен излучением план
- •1. Физические законы излучения
- •3. Излучение газов
- •Лекция 10. Теплообменный аппарат план
- •1. Основные определения
- •2. Определение поверхности нагрева теплообменного аппарата. Средняя разность температур
- •Содержательный модуль 4 «топливо» лекция. Топливо и основы теории горения
- •1. Состав топлива.
- •2. Характеристика топлива
- •3. Моторные топлива для поршневых двс
- •4. Котельный агрегат и его элементы.
- •5. Вспомогательное оборудование котельной установки.
- •6. Тепловой баланс котельного агрегата.
- •Тема 15. Топочные устройства.
- •15.1. Топочные устройства.
- •15.2. Сжигание топлива.
- •15.3. Теплотехнические показатели работы топок.
- •Тема 16.Горение топлива.
- •16.1. Физический процесс горения топлива.
- •16.2. Определение теоретического и действительного расхода воздуха на горение топлива.
- •16.3. Количество продуктов сгорания топлива.
- •Тема 17. Компрессорные установки.
- •17.1. Объемный компрессор.
- •17.2. Лопаточный компрессор.
- •Литература
- •Теплотехника / Баскаков а. П., Берг в. В., Вит о. К. И др. - м.: Энергоиздат, 1991.- 224 с.
- •Теплотехника / Хазен м. М., Матвеев г д., Грицевский м. Е. И др.- м.: Высш. Школа,1981.- 480 с.
- •Швец и.Т., Толубинский в.И., Алабовский а.Е. И др. Теплотехника - к.: "Вища школа", Головное изд - во, 1976.- 517 с.
Лекция 4. Второй закон термодинамики (4) план
1. ЭНТРОПИЯ
2. ОБЩАЯ ФОРМУЛИРОВКА ВТОРОГО ЗАКОНА
3. ПРЯМОЙ ЦИКЛ КАРНО
4. ОБОБЩЕННЫЙ (РЕГЕНЕРАТИВНЫЙ) ЦИКЛ КАРНО
5. ОБРАТНЫЙ ЦИКЛ КАРНО
6. СТАТИСТИЧЕСКОЕ ТОЛКОВАНИЕ ВТОРОГО
НАЧАЛА ТЕРМОДИНАМИКИ
7. ЭКСЕРГИЯ
1. Энтропия
Как уже указывалось,
величина
![]() не является полным дифференциалом.
Действительно, для того чтобы
проинтегрировать правую часть этого
выражения, нужно знать зависимость р
от
,
т.е. процесс, который совершает газ.
не является полным дифференциалом.
Действительно, для того чтобы
проинтегрировать правую часть этого
выражения, нужно знать зависимость р
от
,
т.е. процесс, который совершает газ.
В математике
доказывается. Что дифференциальный
двучлен всегда можно превратить в
полный дифференциал путем умножения
(или деления) на интегрирующий множитель
(или делитель). Таким интегрирующим
делителем для элементарного количества
теплоты
![]() является абсолютная температура Т.
является абсолютная температура Т.
Покажем это на примере изменения параметров идеального газа в равновесных процессах:
![]() (1)
(1)
Выражение
![]() при равновесном изменении состояния
газа есть полный дифференциал некоторой
функции состояния. Она называется
энтропией, обозначается для 1 кг газа
через
при равновесном изменении состояния
газа есть полный дифференциал некоторой
функции состояния. Она называется
энтропией, обозначается для 1 кг газа
через
![]() и измеряется в Дж/(кгК).
Для произвольного количества газа
энтропия, обозначаемая через S,
равна S=Ms
и измеряется в Дж/К
и измеряется в Дж/(кгК).
Для произвольного количества газа
энтропия, обозначаемая через S,
равна S=Ms
и измеряется в Дж/К
Таким образом, аналитически энтропия определяется следующим образом:
![]() (2)
(2)
Формула (2) справедлива как для идеальных газов, так и для реальных тел.
Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
![]() .
.
![]() .
.
![]()
Значение энтропии для заданного состояния определяется интегрированием уравнения (2):
![]()
где
![]() - константа интегрирования.
- константа интегрирования.
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906 г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т. е. = 0 при Т = 0 оК. Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
![]() (3)
(3)
поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня.
Получим формулы,
позволяющие вычислить изменение
энтропии идеального газа. Для этого
проинтегрируем уравнение (3.1), положив
для простоты
![]() =
const:
=
const:
![]() (4)
(4)
Из уравнения Клапейрона, записанного для состояний 1 и 2, следует:
![]()
После подстановки
отношений
![]() и
и
![]() в выражение (4) получим следующие
формулы для изменения энтропии
идеального газа:
в выражение (4) получим следующие
формулы для изменения энтропии
идеального газа:
![]() (5)
(5)
![]() (6)
(6)
Поскольку энтропия есть функция состояния рабочего тела, уравнениями (4)…(6) можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет.
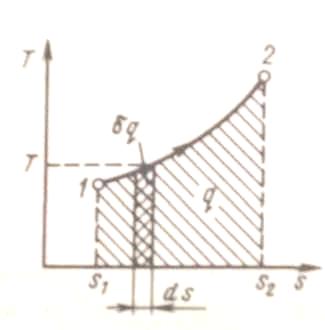
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов Т, s - диаграмму, на которой (как и на р, -диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией (рис. 1).
|
Рис. 1. Графическое изображение теплоты в Т, s-координатах
|