
- •Модуль 1
- •Модуль 3
- •Модуль 4
- •Содержательный модуль 1 «термодинамика»
- •1. Предмет и метод термодинамики
- •2. Термодинамическая система
- •3. Параметры состояния рабочего тела.
- •Отнеся работу расширения к 1 кг массы рабочего тела, получим
- •Лекция 4. Второй закон термодинамики (4) план
- •1. Энтропия
- •Из уравнения (2) следует, что в равновесном процессе
- •2. Общая формулировка второго закона
- •3. Прямой цикл карно
- •4. Обобщенный (регенеративный) цикл карно
- •5. Обратный цикл карно
- •7. Статистическое толкование второго
- •8. Эксергия
- •1. Изохорный процесс
- •При переменной теплоемкости
- •2. Изобарный процесс
- •3. Изотермический процесс
- •4. Адиабатный процесс.
- •5. Политропный процесс
- •Содержательный модуль 2 «реальные газы. Водяной пар»
- •Лекция 6. Термодинамические процессы
- •Реальных газов (4)
- •Содержательный модуль 3 «теплопередача» лекция 7. Основные случаи теплообмена. Теплопроводность (4) план
- •1. Определения
- •3. Теплоотдача между стенкой и жидкостью
- •4. Теплопередача через плоскую стенку
- •5. Теплопередача через цилиндрическую стенку
- •Лекция 8. Теплообмен соприкосновением (4) план
- •2. Вычисление коэффициентов теплоотдачи
- •3. Эмпирические формулы
- •5. Теплопередача к кипячей жидкости.
- •Лекция 9. Теплообмен излучением план
- •1. Физические законы излучения
- •3. Излучение газов
- •Лекция 10. Теплообменный аппарат план
- •1. Основные определения
- •2. Определение поверхности нагрева теплообменного аппарата. Средняя разность температур
- •Содержательный модуль 4 «топливо» лекция. Топливо и основы теории горения
- •1. Состав топлива.
- •2. Характеристика топлива
- •3. Моторные топлива для поршневых двс
- •4. Котельный агрегат и его элементы.
- •5. Вспомогательное оборудование котельной установки.
- •6. Тепловой баланс котельного агрегата.
- •Тема 15. Топочные устройства.
- •15.1. Топочные устройства.
- •15.2. Сжигание топлива.
- •15.3. Теплотехнические показатели работы топок.
- •Тема 16.Горение топлива.
- •16.1. Физический процесс горения топлива.
- •16.2. Определение теоретического и действительного расхода воздуха на горение топлива.
- •16.3. Количество продуктов сгорания топлива.
- •Тема 17. Компрессорные установки.
- •17.1. Объемный компрессор.
- •17.2. Лопаточный компрессор.
- •Литература
- •Теплотехника / Баскаков а. П., Берг в. В., Вит о. К. И др. - м.: Энергоиздат, 1991.- 224 с.
- •Теплотехника / Хазен м. М., Матвеев г д., Грицевский м. Е. И др.- м.: Высш. Школа,1981.- 480 с.
- •Швец и.Т., Толубинский в.И., Алабовский а.Е. И др. Теплотехника - к.: "Вища школа", Головное изд - во, 1976.- 517 с.
Отнеся работу расширения к 1 кг массы рабочего тела, получим
![]() ;
;
![]() (7)
(7)
Величина l, представляющая собой удельную работу, совершаемую системой, содержащей 1 кг газа, равна
 (8)
(8)
Поскольку в общем случае р - величина переменная, то интегрирование возможно лишь тогда, когда известен закон изменения давления р = р( ).
Формулы (4)…(8) справедливы только для равновесных процессов, при которых давление рабочего тела равно давлению окружающей среды.
В термодинамике
для исследования равновесных процессов
широко используют р,
- диаграмму,
в которой осью абсцисс служит удельный
объем, а осью ординат - давление. Поскольку
состояние термодинамической системы
определяется двумя параметрами, то
на р,
-диаграмме
оно изображается точкой. На рис. 2 точка
1 соответствует начальному состоянию
системы, точка 2 - конечному, а линия 12 -
процессу расширения рабочего тела от
![]() до
.
до
.
При бесконечно
малом изменении объема
![]() площадь заштрихованной вертикальной
полоски равна
площадь заштрихованной вертикальной
полоски равна
![]() следовательно, работа процесса 12
изображается площадью, ограниченной
кривой процесса, осью абсцисс и
крайними ординатами. Таким образом,
работа изменения объема эквивалентна
площади под кривой процесса в диаграмме
р,
.
следовательно, работа процесса 12
изображается площадью, ограниченной
кривой процесса, осью абсцисс и
крайними ординатами. Таким образом,
работа изменения объема эквивалентна
площади под кривой процесса в диаграмме
р,
.
Каждому пути
перехода системы из состояния 1 в
состояние 2 (например, 12, 1а2
или 1b2)
соответствует своя работа расширения:
![]() >
>![]() >
>
![]() .
Следовательно, работа зависит от
характера термодинамического процесса,
а не является функцией только исходного
и конечного состояний системы. С
другой стороны,
.
Следовательно, работа зависит от
характера термодинамического процесса,
а не является функцией только исходного
и конечного состояний системы. С
другой стороны,
![]() зависит от пути интегрирования и,
следовательно, элементарная работа
зависит от пути интегрирования и,
следовательно, элементарная работа
![]() не является полным дифференциалом
и не может быть представлена
соотношением, аналогичным (1).
не является полным дифференциалом
и не может быть представлена
соотношением, аналогичным (1).
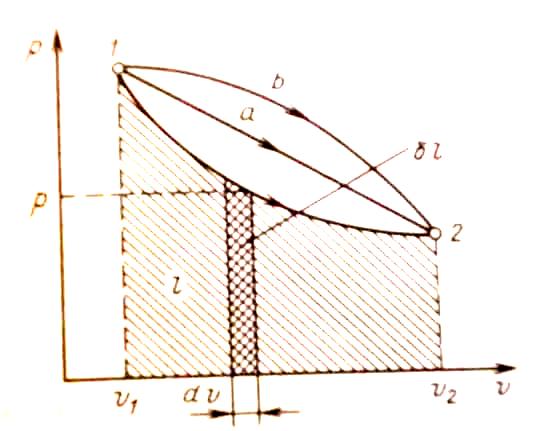
Рис. 2. Графическое изображение работы.
Работа всегда связана с перемещением макроскопических тел в пространстве, например перемещением поршня, деформацией оболочки, поэтому она характеризует упорядоченную (макрофизическую) форму передачи энергии от одного тела к другому и является мерой переданной энергии.
Поскольку величина пропорциональна увеличению объема, то в качестве рабочих тел, предназначенных для преобразования тепловой энергии в механическую, целесообразно выбирать такие, которые обладают способностью значительно увеличивать свой объем. Этим качеством обладают газы и пары жидкостей. Поэтому, например, на тепловых электрических станциях рабочим телом служат пары воды, а в двигателях внутреннего сгорания — газообразные продукты сгорания того или иного топлива.
Помимо макрофизической формы передачи энергии - работы существует также и микрофизическая, т. е. осуществляемая на молекулярном уровне форма обмена энергией между системой и окружающей средой. В этом случае энергия может быть передана системе без совершения работы. Мерой количества энергии, переданной микрофизическим путем, служит теплота. Теплота может передаваться либо при непосредственном контакте между телами (теплопроводностью, конвекцией), либо на расстоянии (излучением), причем во всех случаях этот процесс возможен только при наличии разности температур между телами.
Как будет показано
ниже, элементарное количество теплоты
![]() Q,
так же как и
L,
не является полным дифференциалом
в отличие от дифференциала внутренней
энергии dU.
За этой математической символикой
скрыт глубокий физический смысл
различия понятий внутренней энергии,
теплоты и работы.
Q,
так же как и
L,
не является полным дифференциалом
в отличие от дифференциала внутренней
энергии dU.
За этой математической символикой
скрыт глубокий физический смысл
различия понятий внутренней энергии,
теплоты и работы.
Внутренняя энергия - это свойство самой системы, она характеризует состояние системы. Теплота и работа - это энергетические характеристики процессов механического и теплового взаимодействий системы с окружающей средой. Они характеризуют те количества энергии, которые переданы системе или отданы ею через ее границы в определенном процессе.
2. Аналитическое выражение первого закона термодинамики
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям. В соответствии с уравнением Эйнштейна Е = mс2 надо рассматривать единый закон сохранения и превращения массы и энергии. Однако в технической термодинамике мы имеем дело со столь малыми скоростями объекта, что дефект массы равен нулю, и поэтому закон сохранения энергии можно рассматривать независимо.
Закон сохранения и превращения энергии является фундаментальным законом природы, который получен на основе обобщения огромного количества экспериментальных данных и применим ко всем явлениям природы. Он утверждает, что энергия не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
В числе первых ученых, утверждавших принцип сохранения материи и энергии, был наш соотечественник М. В. Ломоносов (1711 -1765 гг.).
Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление p, сообщается извне бесконечно малое количество теплоты Q. В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU. Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу L против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
![]() (9)
(9)
т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть положительным, отрицательным или равным нулю.
Рассмотрим некоторые частные случаи.
1. Q = 0 - теплообмен системы с окружающей средой отсутствует, т. е. теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется адиабатным. Для него уравнение (9) принимает вид
![]() .
(10)
.
(10)
Следовательно, работа расширения, совершаемая системой в адиабатном процессе, равна уменьшению внутренней энергии данной системы. При адиабатном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внутренней энергии системы.
2. L = 0 - при этом объем тела не изменяется, dV = 0. Такой процесс называется изохорным, для него
Q = dU, (11)
т.е. количество теплоты, подведенное к системе при постоянном объеме, равно увеличению внутренней энергии данной системы
dU = 0 - внутренняя энергия системы не изменяется и
![]() ,
(12)
,
(12)
т. е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю работу.
Для системы, содержащей 1 кг рабочего тела
![]() (13)
(13)
Проинтегрировав уравнения (9) и (13) для некоторого процесса, получим выражение первого закона термодинамики в интегральной форме:
![]() ;
;
![]() (14)
(14)
где
![]()
