
- •Модуль 1
- •Модуль 3
- •Модуль 4
- •Содержательный модуль 1 «термодинамика»
- •1. Предмет и метод термодинамики
- •2. Термодинамическая система
- •3. Параметры состояния рабочего тела.
- •Отнеся работу расширения к 1 кг массы рабочего тела, получим
- •Лекция 4. Второй закон термодинамики (4) план
- •1. Энтропия
- •Из уравнения (2) следует, что в равновесном процессе
- •2. Общая формулировка второго закона
- •3. Прямой цикл карно
- •4. Обобщенный (регенеративный) цикл карно
- •5. Обратный цикл карно
- •7. Статистическое толкование второго
- •8. Эксергия
- •1. Изохорный процесс
- •При переменной теплоемкости
- •2. Изобарный процесс
- •3. Изотермический процесс
- •4. Адиабатный процесс.
- •5. Политропный процесс
- •Содержательный модуль 2 «реальные газы. Водяной пар»
- •Лекция 6. Термодинамические процессы
- •Реальных газов (4)
- •Содержательный модуль 3 «теплопередача» лекция 7. Основные случаи теплообмена. Теплопроводность (4) план
- •1. Определения
- •3. Теплоотдача между стенкой и жидкостью
- •4. Теплопередача через плоскую стенку
- •5. Теплопередача через цилиндрическую стенку
- •Лекция 8. Теплообмен соприкосновением (4) план
- •2. Вычисление коэффициентов теплоотдачи
- •3. Эмпирические формулы
- •5. Теплопередача к кипячей жидкости.
- •Лекция 9. Теплообмен излучением план
- •1. Физические законы излучения
- •3. Излучение газов
- •Лекция 10. Теплообменный аппарат план
- •1. Основные определения
- •2. Определение поверхности нагрева теплообменного аппарата. Средняя разность температур
- •Содержательный модуль 4 «топливо» лекция. Топливо и основы теории горения
- •1. Состав топлива.
- •2. Характеристика топлива
- •3. Моторные топлива для поршневых двс
- •4. Котельный агрегат и его элементы.
- •5. Вспомогательное оборудование котельной установки.
- •6. Тепловой баланс котельного агрегата.
- •Тема 15. Топочные устройства.
- •15.1. Топочные устройства.
- •15.2. Сжигание топлива.
- •15.3. Теплотехнические показатели работы топок.
- •Тема 16.Горение топлива.
- •16.1. Физический процесс горения топлива.
- •16.2. Определение теоретического и действительного расхода воздуха на горение топлива.
- •16.3. Количество продуктов сгорания топлива.
- •Тема 17. Компрессорные установки.
- •17.1. Объемный компрессор.
- •17.2. Лопаточный компрессор.
- •Литература
- •Теплотехника / Баскаков а. П., Берг в. В., Вит о. К. И др. - м.: Энергоиздат, 1991.- 224 с.
- •Теплотехника / Хазен м. М., Матвеев г д., Грицевский м. Е. И др.- м.: Высш. Школа,1981.- 480 с.
- •Швец и.Т., Толубинский в.И., Алабовский а.Е. И др. Теплотехника - к.: "Вища школа", Головное изд - во, 1976.- 517 с.
3. Параметры состояния рабочего тела.
Основными параметрами состояния рабочего тела (газа или пара) являются: давление (р), температура (t, Т) и удельный объем (v). Предварительно отметим, что плотностью вещества ρ называют массу (кг) единицы объема (м3) его. Так, если масса объема V какого-либо газа равна G, то
![]()
![]() , кг/м3
(1)
, кг/м3
(1)
Давление р означает силу, приходящуюся на единицу площади, и определяется формулой
![]() ,
Па (2)
,
Па (2)
где N - сила, нормальная к поверхности и равномерно распределенная по площади, Н;
F – площадь, м2.
Давление измеряется в кГ/см2, кГ/м2, Н/м2, а иногда в метрах или миллиметрах столба жидкости (воды, ртути, спирта).
В термодинамике давление рабочего тела иногда измеряют в физических или технических атмосферах.
Абсолютное или истинное давление определяется суммой избыточного и барометрического давлений (рис.1):
![]() (3а)
(3а)
Если в сосуде давление ниже атмосферного, то имеет место разряжение. Разность между барометрическим и абсолютным давлением называется вакуумом, или разряжением, т.е.
![]() (3б)
(3б)

Рисунок 1- К определению абсолютного давления
Размер- ность
Наимено-вание |
кгс/см2 |
кгс/м2 |
мм. рт. ст. |
м. рт. ст. |
мм. вод. ст. |
м. вод. ст. |
1 физ. атм-ра |
1,033 |
1,03·10 |
760 |
0,76 |
1,03·10 |
10,3 |
1 техн. атм-ра |
1,0 |
1·10 |
735,6 |
0,735 |
1·10 |
10 |
1 бар |
1,02 |
1,02·10 |
750 |
0,75 |
1,02·10 |
10,2 |
Давление окружающей среды, например, атмосферного воздуха, фиксируется, как известно, прибором барометром и называется барометрическим.
Давление выше барометрического измеряется манометром и называется избыточным, или манометрическим.
Давление ниже барометрического (вакуум, или разрежение) измеряется вакуумметрами или тягомерами.
Если показание
ртутного барометра при температуре t°С
равно
![]() ,
то приведение этого показания к нулю
можно производить по формуле
,
то приведение этого показания к нулю
можно производить по формуле
![]() (4)
(4)
С увеличением высоты Н в пределах тропосферы (до 11 000 м) барометрическое давление снижается по закону
![]() ,
(5)
,
(5)
где
![]() - барометрическое давление на высоте Н
при 0°С;
- барометрическое давление на высоте Н
при 0°С;
Н - высота над уровнем моря, м.
Замеряя давление газа в емкости по манометру, узнаем, насколько истинное давление в емкости превышает давление окружающей среды. Поэтому, чтобы отыскать истинное или абсолютное давление газа в емкости, следует всегда к показанию манометра прибавить давление окружающей среды (т. е. прибавить величину барометрического давления рб)
Температура - мера нагретости тела, характеризующая его тепловое состояние. Однако хорошо всем известное качественно воспринимаемое ощущение температуры количественно (физически) определяется сложно. Измерение температуры основано на следующем факте если два тела, взятых порознь, находятся в термическом равновесии при соприкосновении с третьим телом, то все три тела имеют одну и ту же температуру. В основу прибора, измеряющего температуру (термометра), положено явление расширения тел при нагревании. С тем же успехом можно воспользоваться другими свойствами, например э. д. с. термопары, электросопротивлением материалов, радиацией и пр. Все эти способы измерения температуры не позволяют, однако, определить ее как некоторую величину, не зависящую от свойств термометрического вещества,
В 1721 г. голландцем Фаренгейтом был предложен термометр, в котором за 0° принята температура смеси равных частей льда и нашатыря. В этой шкале температура таяния льда равна +32°F, а температура кипения химически чистой воды равна -212°F. Этот термометр имеет распространение главным образом в странах США, Канаде и др.
Шкала Реомюра (°R) имеет следующие базисные (реперные) точки температуры: 0° - соответствует температуре таяния льда, +80° - соответствует температуре кипения воды при нормальном атмосферном давлении. Реперными точками стоградусной шкалы Цельсия(°С) соответственно являются: 0°С - температура таяния льда и + 100°С - температура кипения воды при нормальном атмосферном давлении. На рис. 3 приведены указанные шкалы. Связь между ними устанавливается следующими формулами:
![]() ;
(6)
;
(6)
![]() ;
(7)
;
(7)
![]() ;
(8)
;
(8)
Основной единицей измерения температуры является градус, цена деления которого разная в различных шкалах.
Решением XI Генеральной конференции по мерам и весам (1960 г.) и ГОСТ 8550 - 61 предусматривается применение двух температурных шкал: термодинамической и международной - практической. Единицей измерения температуры по термодинамической шкале является Кельвин (К). Кельвин впервые ввел абсолютную температуру как величину, не зависящую от свойств вещества. В основу термодинамической шкалы температур положена одна экспериментальная постоянная величина - тройная точка воды, температура которой принята равной 273,15 К и которая является точкой температурного равновесия для всех трех агрегатных состояний воды (лед, жидкость, пар). Значение температуры тройной точки воды в настоящее время определяется с очень высокой точностью в 0,0001°. Таким образом, градус Кельвина составляет 1/273,15 части интервала от абсолютного нуля температуры до температуры тройной точки.
![]() ,
К
,
К
(9)
![]() ,
оС.
,
оС.
Молекулярно-кинетичеекая теория газов позволяет оценивать температуру как меру кинетической энергии движения молекул тела, или, иначе говоря, как функцию скорости движения их.
В Украине принята стоградусная шкала температур, по существу совпадающая со шкалой Цельсия.
Удельным объемом
вещества называют объём
![]() единицы массы (кг) его т.е.
единицы массы (кг) его т.е.
![]() м3/кг
(10)
м3/кг
(10)
Нетрудно заметить, что
![]() .
(11)
.
(11)
Нормальные физические условия: давление равно 1 атм (р0=760 мм рт. ст., или 101 325 Н/м2), а температура t0 = 0 °С.
Нормальные технические условия соответствуют давлению в 1 aт. (р0 = 735,6 мм рт. ст., или 980 665 Н/м2) и t0 = 15°С.
ЛЕКЦИЯ 2. УРАВНЕНИЕ СОСТОЯНИЯ РАБОЧЕГО ТЕЛА И СМЕСИ ГАЗОВ
План
1. Вывод характеристического уравнения.
2. Законы идеальных газов.
3. Уравнение состояние для смеси идеальных газов.
Литература:
1. Теплотехника / Баскаков А. П., Берг В. В., Вит О. К. и др. - М.: Энергоиздат, 1991.- 224 с.
2. Теплотехника / Хазен М. М., Матвеев Г Д., Грицевский М. Е. и др.- М.: Высш. школа,1981.- 480 с.
3. Швец И.Т., Толубинский В.И., Алабовский А.Е. и др. Теплотехника - К.: "Вища школа", Головное изд - во, 1976.- 517 с.
4. Нащокин В.В. Техническая термодинамика и теплопередача. Учебн. Пособие для вузов.- 3-е изд.- М.: Высшая школа, 1980.- 469 с.
5. Кафаров В.В. Основы массопередачи. Учеб. пособие для вузов.- М.: Высшая школа, 1972.- 494 с.
1. Вывод характеристического уравнения
Рассмотренные
нами газовые законы, как известно,
справедливы при определенных условиях,
а именно: закон Гей - Люссака верен при
соблюдении условия р
= const,
справедливость закона Шарля
ограничивается условием V
= const, а закон
Бойля - Мариотта имеет силу при соблюдении
Т = const.
Такие процессы, когда остается неизменным
какой-либо из перечисленных параметров,
встречаются в технике довольно часто.
Однако значительно чаще встречаются
более важные в практике процессы,
течение которых имеет место при переменном
значении всех параметров. В этом случае
необходимо такое уравнение, которое
связывало бы между собой все три
параметра (р,
![]() и Т).
Оказывается, такое уравнение есть. Оно
было впервые выведено Клайпероном
и обобщено Д. И. Менделеевым.
и Т).
Оказывается, такое уравнение есть. Оно
было впервые выведено Клайпероном
и обобщено Д. И. Менделеевым.
Пусть имеется 1 кг
некоторого рабочего тела (газа), состояние
(I) которого определяется параметрами
![]() .
Требуется перевести это рабочее тело
из данного состояния в другое (II),
характеризующееся параметрами р2,
v2,
T2.
.
Требуется перевести это рабочее тело
из данного состояния в другое (II),
характеризующееся параметрами р2,
v2,
T2.
Допустим, что p2>p1 тогда, чтобы достигнуть значения р2 , видимо, газ надо сжать. Однако сжатие газа будем производить медленно, чтобы в процессе сжатия температура газа не изменилась (рис.1, состояние III).
Тогда, обращая
внимание на состояние I-III, замечаем, что
у них общая (неизменяемая) температура
![]() .
Это обстоятельство позволяет использовать
в процессе перехода из состояния I в
состояние
III закон Бойля - Мариотта, по которому
.
Это обстоятельство позволяет использовать
в процессе перехода из состояния I в
состояние
III закон Бойля - Мариотта, по которому
![]() ,
(1)
,
(1)
откуда
![]() (2)
(2)
Сравнивая состояния III и II, замечаем, что у них общим (неизменным) является р2, что позволяет воспользоваться законом Гей - Люссака, по которому
![]() ,
(3)
,
(3)
откуда
![]() (4)
(4)
Заметим, что переход
из состояния III в состояние II возможен
(при р2
= const) либо при нагревании (тогда
![]() >
),
либо при охлаждении (тогда
<
)
(см. рис. 1). Сравнивая правые части формул
(2-2) и (2-4), получим:
>
),
либо при охлаждении (тогда
<
)
(см. рис. 1). Сравнивая правые части формул
(2-2) и (2-4), получим:
![]() (5)
(5)
откуда
![]() .
.
Деля обе части
этого уравнения на
![]() получим:
получим:
![]() (6)
(6)
или
![]() (7)
(7)
Полученное уравнение
называется удельным уравнением состояния
(или уравнением Клапейрона), и является
справедливым для 1 кг рабочего тела
(газа), поскольку значение объема,
входящего в него, соответствует
удельному объему (об этом напоминает
единица, стоящая в правой части этого
равенства). Это уравнение позволяет
производить расчеты при переменном
значении параметров состояния
![]() ,
а связывает их между собой величина R,
которая называется удельной (поскольку
речь идет об 1 кг рабочего тела) газовой
постоянной. Если оперировать не единицей,
а произвольной массой G
кг, то в
правую часть выражения (7) следует вместо
1 поставить G,
а в левую - вместо
величину V =
G
(где V
- объем произвольной массы G газа), т. е.
,
а связывает их между собой величина R,
которая называется удельной (поскольку
речь идет об 1 кг рабочего тела) газовой
постоянной. Если оперировать не единицей,
а произвольной массой G
кг, то в
правую часть выражения (7) следует вместо
1 поставить G,
а в левую - вместо
величину V =
G
(где V
- объем произвольной массы G газа), т. е.
pV = GRT.
Если же взять
количество рассматриваемого газа,
равное его молекулярной массе
![]() ,
или, иначе говоря, одну килограмм-молекулу
его, то объем этого количества газа
будет соответствовать объему моля этого
газа, и тогда
,
или, иначе говоря, одну килограмм-молекулу
его, то объем этого количества газа
будет соответствовать объему моля этого
газа, и тогда
![]() .
(8)
.
(8)
Полученное выражение называется универсальным характеристическим уравнением.
При практическом использовании уравнения pV = GRT следует всегда помнить о соответствии между массой вещества и его объемом.
Физический смысл газовой постоянной вытекает из рассмотрения формулы (6). Внося размерности в эту формулу, получим
![]() (или
Дж/кг град)
(или
Дж/кг град)
Величины кГ и кг не сокращаются, так как их природа разная: кГу стоящий в числителе, - силовая функция (вообще говоря, величина переменная в зависимости от того, где именно, в какой географической точке происходит измерение); кг, стоящий в знаменателе, - массовая функция (величина неизменная). Для примера скажем, что сила тяжести (вес), измеренная в разных точках земли, будет в принципе разной, а масса вещества в этих же точках остается неизменной.
Таким образом, получается, что газовая постоянная рабочего тела физически понимается как механическая работа (кГ×м), совершенная 1 кг газа при нагревании его на один градус (при постоянном давлении). Отметим также, что поскольку разность температур по шкале Кельвина и стоградусной одна и та же, то безразлично, к какой температуре относить эту работу газа. Иначе говоря, величина R характеризует работу газа и в значительной мере облегчает оценку и исследование процессов преобразования теплоты в работу.
Если использовать формулу (6) для нормальных условий, то получим
![]() (10)
(10)
Из уравнения (10) вытекает, что для двух газов можно написать
![]() (11)
(11)
Пользуясь уравнением (8) для нормальных условий, будем иметь
![]() (12)
(12)
откуда
![]() (13)
(13)
Полученная константа называется универсальной газовой постоянной.
Для двух газов можно написать
![]()
откуда
![]() (14)
(14)
Так, например:
для кислорода
![]() =
=
![]() = 260 Дж/(кг
= 260 Дж/(кг![]() К);
К);
для азота
![]() =
=
![]() =295,5 Дж/(кг
К);
=295,5 Дж/(кг
К);
для метана
![]() =
=
![]() = 519,8 Дж/(кг
К);
= 519,8 Дж/(кг
К);
для водорода
![]() =
=![]() = 4124,7 Дж/(кг
К).
= 4124,7 Дж/(кг
К).
Суммируя все ранее сказанное, можно написать «формулу цепочки»
![]() (15)
(15)
где
![]() - теплоемкости газов.
- теплоемкости газов.
Приведение объема газа к нормальным условиям и подсчет плотности р в зависимости от р и Т графически легко осуществляются с помощью номограмм.
2. Законы идеальных газов.
Некоторые экспериментально установленные факты, многократно проверенные опытом, получили название основных газовых законов. Впоследствии развившаяся молекулярно-кинетическая теория газов дала возможность вывести эти же законы аналитически. Знание этих законов позволяет производить анализ так называемых термодинамических процессов.
Закон Бойля – Мариотта. Из кинетической теории газов известно, что давление р может быть выражено формулой
![]() (13)
(13)
где т - масса молекулы;
п - число молекул;
![]() - скорость молекул.
- скорость молекул.
Массу молекул в
единице объема (т п) можно представить
как величину плотности, т.е.
![]() ,
где g - ускорение силы тяжести. Имея в
виду, что
,
где g - ускорение силы тяжести. Имея в
виду, что
![]() (где
-
удельный объем газа), получим:
(где
-
удельный объем газа), получим:
![]()
откуда
![]() (14)
(14)
При неизменной
скорости движения молекул, что
соответствует значению Т = const, будем
иметь
![]() =
const. Это позволяет написать:
=
const. Это позволяет написать:
![]() ,
(15)
,
(15)
т. е. расширяя или сжимая газ при постоянной температуре, произведение давления газа на его объем остается неизменным, откуда
![]() .
(16)
.
(16)
Это соотношение впервые было получено экспериментально Бойлем (1662 г.), а впоследствии также и Мариоттом (1676 г.), которое может быть сформулировано следующим образом: при неизменной температуре Т = const) давление газа изменяется обратно пропорционально изменению объема. Этот закон справедлив для любых значений объемов газа, в том числе и для удельных объемов, а это означает, что
![]() .
(17)
.
(17)
Формула (17) позволяет считать, что при неизменной температуре плотность газа изменяется прямо пропорционально давлению.
Уравнение (15) в системе р - координат представляет собой кривую второго порядка, равнобокую гиперболу.
Закон Гей-Люссака.
Экспериментально доказано, что все газы
при нагревании расширяются на одну и
ту же величину, равную
![]() ,
с повышением температуры на 1°С.
,
с повышением температуры на 1°С.
Из этого закона вытекает весьма важное следствие.
При нагревании или охлаждении газа при неизменном давлении объем его изменяется (увеличивается при нагревании и уменьшается при охлаждении) прямо пропорционально изменению абсолютных температур.
![]() .
(18)
.
(18)
Полученная связь справедлива для любого количества газа, в том числе и для 1 кг газа. Тогда
![]() ,
(19)
,
(19)
т. е. при неизменном давлении плотность газа изменяется обратно пропорционально абсолютным температурам. Из формулы (21) следует
![]() (19a)
(19a)
т. е. при р = const произведение плотности газа на абсолютную температуру есть величина постоянная.
Закон Шарля.
Все газы в процессе их нагревания или
охлаждения в условиях неизменного
объема изменяют свое давление на
![]() от своего первоначального значения
давления.
от своего первоначального значения
давления.
Следствием этого закона является следующее положение. По мере нагревания или охлаждения газа при = const давление его изменяется прямо пропорционально изменению абсолютных температур.
По аналогии с предыдущим выводом можно написать
![]() (20)
(20)
Закон Авогадро.
При одинаковых давлениях и температурах
в равных объемах двух или нескольких
газов содержится одинаковое число
молекул. Возьмем два равных объема V
двух разных газов. Пусть в первом из них
содержится всего
![]() молекул при числе молекул в единице
объема этого газа, равном
молекул при числе молекул в единице
объема этого газа, равном
![]() .
Аналогично для второго газа имеем
N2
и п2.
Массы молекул и давления газов равны
соответственно Т1,
р1,
Т2,
р2.
Если допустить, что давления газов
одинаковы, т. е. р1
= р2,
то
.
Аналогично для второго газа имеем
N2
и п2.
Массы молекул и давления газов равны
соответственно Т1,
р1,
Т2,
р2.
Если допустить, что давления газов
одинаковы, т. е. р1
= р2,
то
![]() .
(21)
.
(21)
При одинаковых температурах кинетическая энергия поступательного движения молекул одинакова, т. е.
![]() .
(22)
.
(22)
Тогда
![]() (23)
(23)
откуда
![]()
Умножая обе части
уравнения на
![]() получим
получим
N1 = N2. (24)
Известно, что каждый газ характеризуется определенной молекулярной массой , которая часто именуется грамм-молекулой или килограмм-молекулой по массе (последняя в 1000 раз больше первой).
Объем указанной массы газа составляет соответственно грамм или килограмм-моль газа по объему.
Авогадро определил число молекул в грамм-молекуле (грамм-моле):
N = 6,0251023.
Объем одного килограмм-моля газа, или, что одно и то же, объем килограмм-молекулы любого газа, взятого в одних и тех же условиях, есть величина постоянная. Так, например, при нормальных физических условиях р = 101 325 Н/м2 и t = 0°С этот объем равен 22,4 м3 для любых газов и не зависит от природы этих газов, а при нормальных технических условиях составляет 24,4м3.
Таким образом, известные газовые законы являются частными случаями, вытекающими из общего уравнения состояния.
3. Уравнение состояние для смеси идеальных газов.
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальтона. В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
![]() (25)
(25)
Парциальное давление pi - давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси. Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Mi к массе смеси Мсм:
![]() (26)
(26)
Очевидно, что
![]() и
и
![]() .
.
Массовые доли
часто задаются в процентах. Например,
для сухого воздуха
![]()
Объемная доля
представляет собой отношение приведенного
объема газа V![]() к полному
объему смеси Vсм:
к полному
объему смеси Vсм:
![]() (27)
(27)
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
![]() ,
(28)
,
(28)
![]() (29)
(29)
Первое уравнение
относится к состоянию компонента газа
в смеси, когда он имеет парциальное
давление
![]() ,
и занимает полный объем смеси, а
второе уравнение - к приведенному
состоянию, когда давление и температура
компонента равны, как и для смеси, р
и Т.
,
и занимает полный объем смеси, а
второе уравнение - к приведенному
состоянию, когда давление и температура
компонента равны, как и для смеси, р
и Т.
![]() откуда
откуда
![]() .
Объемные доли также часто задаются в
процентах. Для воздуха
.
Объемные доли также часто задаются в
процентах. Для воздуха
![]()
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N
Пусть газовая
смесь состоит из N![]() молей первого
компонента, N
молей первого
компонента, N![]() молей второго
компонента и т. д. Число молей смеси
молей второго
компонента и т. д. Число молей смеси
![]() ,
а мольная доля компонента будет
равна
,
а мольная доля компонента будет
равна
![]() .
(30)
.
(30)
В соответствии с
законом Авогадро объемы моля любого
газа при одинаковых р
и T,
в частности при температуре и давлении
смеси, в идеально газовом состоянии
одинаковы. Поэтому приведенный объем
любого компонента может быть вычислен
как произведение объема моля
![]() на число молей этого компонента, т.
е.
на число молей этого компонента, т.
е.
![]() ,
а объем смеси
- по формуле
,
а объем смеси
- по формуле
![]() .
Тогда
.
Тогда
![]() ,
и, следовательно,
задание смеси идеальных газов мольными
долями равнозначно заданию ее
объемными долями.
,
и, следовательно,
задание смеси идеальных газов мольными
долями равнозначно заданию ее
объемными долями.
Газовая постоянная смеси газов.
Для смеси справедливо такое соотношение
![]() ,
(31)
,
(31)
где
![]() (32)
(32)
Смесь идеальных газов также подчиняется уравнению Клапейрона.
Поскольку
![]() то из (32) следует, что газовая постоянная
смеси [Дж/(кгК)]
имеет вид
то из (32) следует, что газовая постоянная
смеси [Дж/(кгК)]
имеет вид
![]() (33)
(33)
Кажущаяся молекулярная масса смеси.
Выразим формально газовую постоянную смеси Rсм, введя кажущуюся молекулярную массу смеси см:
![]() (34)
(34)
Сравнивая правые части соотношений (33) и (34), найдем
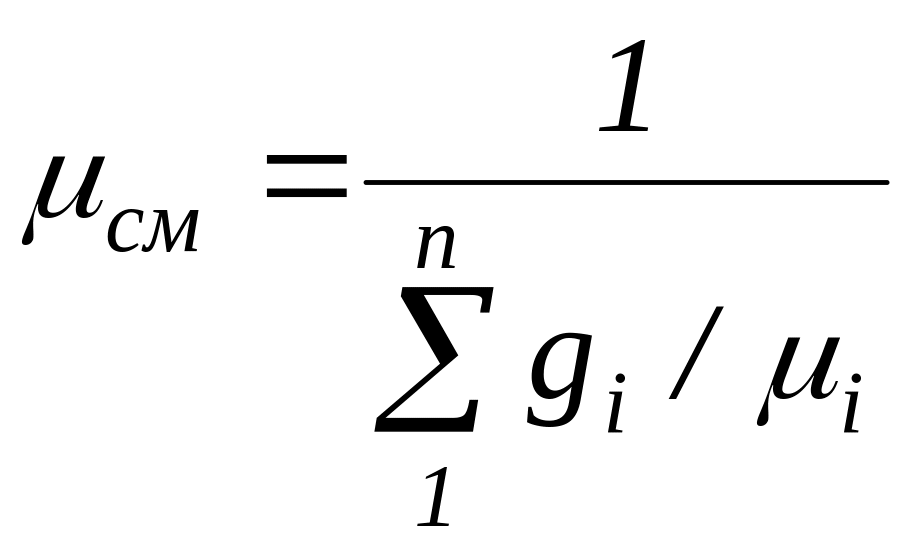 (35)
(35)
Из определения массовых долей следует, что
![]()
Просуммировав это
соотношение для всех компонентов и
учитывая, что
![]() ,
получим выражение для кажущейся
молекулярной массы смеси, заданной
объемными долями:
,
получим выражение для кажущейся
молекулярной массы смеси, заданной
объемными долями:
![]() (36)
(36)
Соотношение между объемными и массовыми долями. Учитывая (36), получаем
![]() (37)
(37)
Поскольку
![]() то
то
 (38)
(38)
Разделив числитель и знаменатель этой формулы на массу смеси М, получим
 (39)
(39)
Теплоемкость смесей идеальных газов. Если смесь газов задана массовыми долями, то ее массовая теплоемкость с определяется как сумма произведений массовых долей на массовую теплоемкость каждого компонента, т. е.
![]() ;
;
![]() (40)
(40)
При задании смеси объемными долями объемная теплоемкость смеси
![]() ;
;
![]() (41)
(41)
Аналогично мольная теплоемкость смеси равна произведению объемных долей на мольные теплоемкости составляющих смесь газов:
![]() ;
;
![]() (42)
(42)
ЛЕКЦИЯ 3. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ (4)
План
1. Понятия о внутренней энергии, работе расширения и теплоте.
2. Аналитическое выражение первого закона термодинамики
Литература:
1. Теплотехника / Баскаков А. П., Берг В. В., Вит О. К. и др. - М.: Энергоиздат, 1991.- 224 с.
2. Теплотехника / Хазен М. М., Матвеев Г Д., Грицевский М. Е. и др.- М.: Высш. школа,1981.- 480 с.
3. Швец И.Т., Толубинский В.И., Алабовский А.Е. и др. Теплотехника - К.: "Вища школа", Головное изд - во, 1976.- 517 с.
4. Нащокин В.В. Техническая термодинамика и теплопередача. Учебн. Пособие для вузов.- 3-е изд.- М.: Высшая школа, 1980.- 469 с.
5. Кафаров В.В. Основы массопередачи. Учеб. пособие для вузов.- М.: Высшая школа, 1972.- 494 с.
1. Понятия о внутренней энергии, работе расширения и теплоте.
Внутренняя энергия системы включает в себя:
кинетическую энергию поступательного, вращательного и колебательного движения частиц;
потенциальную энергию взаимодействия частиц;
энергию электронных оболочек атомов;
внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т.е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности.
![]() ,
кДж/кг (1)
,
кДж/кг (1)
Данная величина называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
В дальнейшем для краткости будем называть величину и просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние:
![]() ;
;![]() ;
;![]()
Ее изменение в
термодинамическом процессе Аи не зависит
от характера процесса и определяется
только начальным и конечным состояниями
тела:
 ,
где
,
где
![]() - значение внутренней энергии в начальном
состоянии, а
- значение внутренней энергии в начальном
состоянии, а
![]() -
в конечном. Математически это означает,
что бесконечно малое изменение
внутренней энергии du
есть полный дифференциал и; если выразить
внутреннюю энергию в виде функции
удельного объема и температуры, то
-
в конечном. Математически это означает,
что бесконечно малое изменение
внутренней энергии du
есть полный дифференциал и; если выразить
внутреннюю энергию в виде функции
удельного объема и температуры, то
![]() (2)
(2)
Внутренняя энергия
идеального газа, в котором отсутствуют
силы взаимодействия между молекулами,
не зависит от объема газа или давления
![]() ,
a определяется только его температурой,
поэтому производная от внутренней
энергии идеального газа по температуре
есть полная производная:
,
a определяется только его температурой,
поэтому производная от внутренней
энергии идеального газа по температуре
есть полная производная:
![]() (3)
(3)
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление 610,8 Па, а для идеальных газов - при 0 °С вне зависимости от давления.
Работа в термодинамике, так же как и в механике, определяется произведением действующей на рабочее тело силы на путь ее действия.
Рассмотрим газ массой М и объемом V, заключенный в эластичную оболочку с поверхностью F (рис. 1). Если газу сообщить некоторое количество теплоты, то он будет расширяться, совершая при этом работу против внешнего давлении р, оказываемого на него средой. Газ девствует на каждый элемент оболочки dF с силой, равной pdF и, перемещая ее по нормали к поверхности на расстояние dn совершает элементарную работу pdFdn Общую работу, совершенную в течение бесконечно малого процесса, получим, интегрируя данное выражение по всей поверхности F оболочки:
![]() (4)
(4)
|
Рис.1. К определению работы расширения
|
Из рис.1 видно, что
изменение объема dV
выражается в виде интеграла по
поверхности:
![]() ,
следовательно
,
следовательно
![]() (5)
(5)
При конечном изменении объема работа против сил внешнего давления, называемая работой расширения, равна
 (6)
(6)
Из (6) следует, что
![]() и
и
![]() всегда имеют одинаковые знаки:
всегда имеют одинаковые знаки:
если (dV>0, то и >0, т.е. при расширении работа тела положительна при этом тело само совершает работу
если же dV <0, то и <0, т. е. при сжатии работа тела отрицательна: это означает, что не тело совершает работу, а на его сжатие затрачивается работа извне.
Единицей измерения работы в СИ является джоуль (Дж).

