
- •Лабораторно-практическое занятие №2
- •§1 Типы химических связей: ковалентная, ионная, водородная. Механизм образования ковалентной связи: обменный и донорно-акцепторный.
- •§2 Характеристики и свойства ковалентной связи.
- •§3 Ионная связь, ее возникновение. Особенности ионной связи.
- •§4 Водородная связь; виды водородной связи.
- •§5. Индуктивный эффект.
- •§6 Сопряжение. Сопряженные системы с открытой и замкнутой цепью;
- •§7 Мезомерный эффект.
- •§8 Задачи для самостоятельного решения
- •Лабораторно-практическое занятие №3
- •§1 Основные положения теории Бренстеда-Лоури и Льюиса.
- •§2. Сила кислот и оснований Бренстеда. Шкала кислотности рКа и рКв.
- •§3. Факторы, определяющие кислотность.
- •§4. Теория Льюиса.
- •§5. Экспериментальная часть
- •§6 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №4
- •§1. Алканы. Номенклатура, изомерия. Способы получения.
- •§2.Физические свойства:
- •§3. Химические свойства
- •Сульфохлорирование и сульфоокисление.
- •Дегидрирование.
- •Изомеризация.
- •§4. Циклоалканы
- •§5. Химические свойства.
- •§6. Алкены. Номенклатура, изомерия. Способы получения.
- •§7. Химические свойства
- •Гидрогалогенирование.
- •3.Гидратация
- •Присоединение серной кислоты.
- •Окисление кислородом воздуха без катализатора.
- •Окисление кислородом воздуха в присутствии серебряного катализатора.
- •Гидроксилирование.
- •Жесткое окисление.
- •V. Полимеризация.
- •§8. Экспериментальная часть
- •§9 Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №5
- •§1. Алкины. Номенклатура, изомерия.
- •§2. Электронное строение
- •§3. Получение алкинов
- •§4. Физические свойства
- •§5. Химические свойства ацетиленовых углеводородов
- •§6. Алкадиены; классификация, изомерия, номенклатура. Получение диенов.
- •§7. Особенности химического строения алкадиенов с сопряженными связями
- •§8. Химические свойства
- •§9. Экспериментальная часть
- •§10. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №6
- •§1. Ароматические углеводороды. Общая характеристика,
- •§2. Физические свойства аренов. Способы получения.
- •§3. Электронное строение на примере бензола. Ароматичность;
- •§4. Химические свойства
- •§5. Понятие о многоядерных аренах. Конденсированные арены
- •§6. Химические свойства
- •§7. Экспериментальная часть
- •§8. Задачи для самостоятельного решения.
- •Лабораторно-практическое занятие №7 Итоговое занятие № 1
- •Мезомерный эффект. Электронодонорные и электроноакцепторные заместители.
- •Лабораторно-практическое занятие №10
- •§1. Амины. Классификация. Номенклатура.
- •§2. Методы получения
- •§3. Физические свойства
- •§4. Химические свойства
- •§5. Химические свойства ароматических аминов
- •§7. Биороль производных аммака.
- •§8. Диазосоединения. Классификация. Номенклатура. Строение солей диазония.
- •§9. Ароматические диазосоединения
- •§10. Реакции солей диазония
- •§11. Экспериментальная часть
- •§12. Задачи для самостоятельного решения
- •Лабораторно-практическое занятие № 11 Итоговое занятие № 2
Лабораторно-практическое занятие №2
Тема: Взаимное влияние атомов в молекуле.
Цель занятия: 1. Рассмотреть взаимное влияние атомов в молекулах
органических соединений.
Сформировать знания механизмов образования различных типов химической связи.
Контрольные вопросы:
Типы химических связей: ковалентная, ионная, водородная.
Ковалентная связь. Механизм образования ковалентной связи: обменный и донорно-акцепторный. Образования σ- и π- связей
Характеристики и свойства ковалентной связи.
Ионная связь, ее возникновение. Особенности ионной связи.
Водородная связь; виды водородной связи. Особенности водородной связи.
Индуктивный эффект.
Сопряжение. Сопряженные системы с открытой и замкнутой цепью; р-
 и
π-π- сопряжение.
и
π-π- сопряжение.Мезомерный эффект. Электронодонорные и электроноакцепторные заместители.
§1 Типы химических связей: ковалентная, ионная, водородная. Механизм образования ковалентной связи: обменный и донорно-акцепторный.
Химическая связь – это совокупность взаимодействий между ядрами и электронами, приводящая к соединению атомов в молекулы. Как известно, химическая связь между атомами возникает при взаимодействии внешних валентных электронов, при этом каждый атом завершает свою внешнюю электронную оболочку до наиболее устойчивой восьмиэлектронной структуры. Возникновение внутримолекулярной связи: при сближении атомов между их внешними электронами с противоположными спинами происходит сильное обменное взаимодействие, приводящее к появлению общей электронной пары. При этом возрастает электронная плотность в межъядерном пространстве, энергия системы уменьшается, ядра взаимодействующих атомов притягиваются и возникает химическая связь. По этому механизму возможно образование нескольких типов химических связей: ковалентная, ионная, металлическая.
Ковалентная связь – химическая связь, осуществляемая за счет одной или нескольких электронных пар, взаимодействующих с ядрами обоих соединяемых атомов. Ковалентная связь образуется между атомами элементов электроотрицательность которых одинаковы или различаются не слишком сильно (Н2, Сl2, CH4, C2H4).
В зависимости от того, как возникает общая электронная пара, ковалентная связь образуется по обменному и донорно-акцепторному механизму.
Обменный механизм.
При обменном механизме в образовании общей электронной пары от каждого атома участвуют атомные орбитали с неспаренными электронами:
Например, образование молекулы Н2
s-AO s-AO σ-MO
или образование молекулы аммиака NH3

 H
H

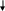


 N
+ H
N
H
N
+ H
N
H



 H
H
H
Донорно-акцепторный механизм
Донорно-акцепторный механизм возникновения ковалентной связи наблюдается в том случае, когда один атом (донор) имеет неподеленную пару электронов, а другой (акцептор) – свободную орбиталь. При перекрывании атомных орбиталей возникает молекулярная орбиталь, на которой находится общая электронная пара.
АО АО МО
А
акцептор донор
Например, образование аммония NH4+ :
Н
В молекуле аммиака у атома азота на внешнем уровне имеется неподеленная пара электронов, а у катиона водорода – свободная 1s- орбиталь.
При перекрывании атомных орбиталей пара электронов азота становится общей для соединяющихся атомов. Образующаяся четвертая ковалентная связь в катионе аммония полностью идентична по длине и энергии трем остальным ковалентным связям N – Н.
