
Химия природных органических соединений
Химия природных органических соединений (ХПОС) изучает химический состав природных организмов и химические процессы, лежащие в основе их жизнедеятельности.
Хи́мия приро́дных соедине́ний (ХПС) — раздел органической химии, изучающий химические соединения, входящие в состав живых организмов, природные пути их превращений и методы искусственного получения. Как наука, химия природных соединений возникла одновременно с органической химией. Необходимость выделить самостоятельную дисциплину, отделить её от классической органической химии, возникла после накопления большого количества данных, выделения и изучения структуры и свойств химических веществ, обнаруженных в живых организмах.
Основной особенностью природных органических соединений является их афтотрофность. Природные соединения способны усваивать солнечную энергию и осуществлять первичный синтез органических соединений из СО2, Н2О и других минеральных веществ. Таким образом, Химия природных соединений изучает Химические реакции фотосинтеза и минерального питания.
Благодаря процессу фотосинтеза у природных органических соединений происходит, во-первых, накопление природными соединениями запасных питательных веществ (углеводов, белков, липидов); во-вторых, способность синтезировать большое разнообразие соединений (гликозиду, алкалоиды, фенольные соединения, эфирные масла, смолы и др.).
Все эти вещества и их метаболизм изучает химия природных органических соединений.
Перейдем к этим веществам и их классификации.
Белковые вещества
Белки, или протеины (от греч. рroteos – первостепенный) – высокомолекулярные органические соединения (с молекулярной массой от 5 тыс. до 1 млн.), основными структурными единицами которых являются α- аминокислоты.
В составе белков найдено (или постоянно встречается) 17 α- аминокислот (аланин, лизин, глицин, серин и т. д.), 2 амида аминокислот (аспарагин и глютамин), а так же иминокислота (пролин); иногда встречается - орнитин

Эти 20 аминокислот называются протеиногенными. А те, которые не входят в состав белковых молекул (свыше 250), а содержатся только в свободном состоянии или встречаются в составе коротких пептидов, называются непротеиногенными.
Например:
СН3 CH2NH2
СНNH2 CH2
COOH COOH
α-аланин β-аланин
протеиногенная аминокислота непротеиногенная аминокислота
Аминокислоты – это гетерофункциональные соединения, которые содержат аминогруппу, карбоксильную группу и у/в радикал.
(аминогруппа
основные свойства)
![]() (карбоксильная
группа кислотные свойства)
(карбоксильная
группа кислотные свойства)
R*=-SH,
-OH, -COOH, -NH2
и
![]() .
.
В построении белковых молекул принимают участие только α- аминокислоты, в молекулах которых аминогруппа расположена у атома углерода, находящегося в α- положении относительно –СООН.
В молекулах аминокислот присутствуют асимметрические атомы углерода (который соединен с 4-мя различными по природе или длине заместителями), а значит, они оптически активны (т. е. способны вращать плоскость поляризации света) и имеют стереоизомеры: D и L –изомеры. (Стандартом для выяснения принадлежности аминокислот к D- или L- ряду является серин, который имеет только один ассиметрический атом углерода и одну пару стереоизотеров).
 D-серин
D-серин
 L-
серин
L-
серин
Все природные аминокислоты относятся к L ряду, а аминокислоты D-ряда содержатся в свободном состоянии или в составе коротких пептидов.
Пептиды, или полипептиды – это цепочки из нескольких аминокислот, связанных пептидными связями (-CO-NH-). В состав пептидов могут входить не только протеиногенные, но и непротеиногенные аминокислоты, (часто связанные с глютаминовой кислотой).
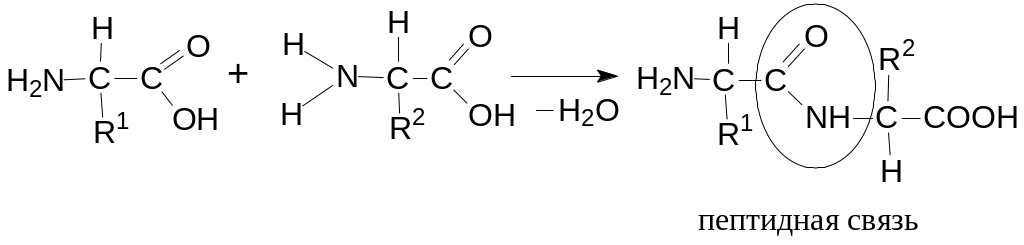


Молекулы белков содержат С, Н, О, N, всегда S и не которые P; селен замещает на S в белках.
Если в образовании пептида участвует 2 аминокислоты, то это дипептид, если 3 аминокислоты-то трипептид.
