
- •Часть II
- •Строение и функции почек
- •- Клубочек
- •Врожденные аномалии
- •Кистозные болезни почек
- •Гломерулярные болезни (общие сведения)
- •Острый гломерулонефрит
- •Нефротический синдром
- •I Ранние I - II стадии | | Поздние III - IV стадии [
- •Хронический гломерулонефрит
- •Повреждения почечных клубочков, связанные с системными заболеваниями
- •Диабетический гломерулосклероз
- •Амилоидоз
- •Другие системные заболевания
- •Наследственный нефрит
- •Заболевания почек, связанные с поражением канальцев и интерстиция
- •Пиелонефрит и инфекции мочевыводящих путей
- •Тубулоинтерстициальный нефрит, вызванный лекарствами и токсинами
- •Уратная нефропатия
- •Гиперкалыщемия и нефрокалыданоз
- •Множественная миелома
- •Доброкачественный нефросклероз
- •Злокачественная фаза гипертензии (злокачественный нефросклероз)
- •Стеноз почечной артерии
- •Тромботические микроангиопатии
- •Другие сосудистые заболевания почек
- •Обструкция мочевыводящих путей (обструктивная уропатия)
- •Уролитиаз (камни почек)
- •Опухоли почек
- •Заболевания мочеточников
- •Заболевания мочевого пузыря
- •Заболевания уретры
- •Болезни мужского полового члена
- •Болезни предстательной железы
- •Заболевания яичек и придатков яичек
- •Воспалительные и некротические заболевания
- •Фиброзно-кистозные заболевания
- •Опухоли
- •Заболевания грудных желез у мужчин
- •Заболевания вульвы и влагалища
- •Болезни матки
- •Секреторная фаза
- •Причины
- •Болезни маточных труб
- •Болезни яичников
- •Опухоли
- •Опухолей
- •Глава 22 патология беременности и послеродового периода- пре- и постнатальные расстройства, заболевания младенчества и детства
- •Патология плаценты
- •Патология беременности
- •Патология маточно - плацентарных (спиральных) артерий
- •Внутриутробный возраст и масса плода
- •Родовая травма и родовые повреждения
- •Болезни легких перинатального периода
- •Врожденные пороки развития
- •Внутриутробные инфекции
- •Гемолитическая болезнь новорожденных
- •Наследственные нарушения метаболизма
- •Гидроксилирование фенилалалина Фенил апанингидроксилаза
- •Нарушение гидроксилирования при фенилкетонурии Фенил апанингидроксилаза
- •II этап галакт030 _ 1 _ фосфат—
- •III этап
- •Синдром внезапной смерти ребенка
- •Опухоли у детей
- •Болезни щитовидной железы
- •Болезни околощитовидных желез
- •Болезни коркового вещества надпочечников
- •- Дегидроэпиандростерон
- •Болезни мозгового вещества надпочечников
- •Болезни тимуса (вилочковой железы)
- •Болезни шишковидной железы
- •Множественная эндокринная неоплазия
- •24.1. Общие сведения
- •24*2» Аномалии развития костей
- •Заболевания, связанные с аномалией матрикса кости
- •Остеогенеза
- •Наследования Сущность поражения коллагена
- •Заболевания, вызванные дисфункцией остеокластов
- •Заболевания, связанные с нарушениями минерального гомеостаза
- •Остеонекроз (аваскулярный остеонекроз, асептический некроз кости)
- •Остеомиелит
- •Опухоли и опухолеподобные заболевания костей
- •Опухоли, сгруппированные по источнику гистогенеза
- •Костеобразующие опухоли
- •Хрящеобразующие опухоли
- •Соединительнотканные (фиброзные) и фиброзно-костные опухоли
- •Опухоли разного происхождения
- •Метастатические опухолевые поражения скелета
- •Болезни суставов
- •Остеоартрит, или дегенеративное заболевание суставов
- •Ревматоидный артрит
- •Серонегативные спондилоартропатии
- •Инфекционный артрит
- •Артропатии с отложением кристаллов
- •Опухоли суставов и структур, связанных с суставами
- •Опухоли и опухолеподобные образования мягких тканей
- •Заболевания скелетных мышц
- •Мышечные дистрофии
- •Врожденные миопатии
- •Миопатии, связанные с врожденными ошибками метаболизма
- •Воспалительные миопатии
- •Поражения нервно-мышечного соединения
- •Опухоли скелетной мускулатуры
- •Глава 25 заболевания кожи
- •Общие сведения
- •Нарушения пигментации.
- •Маркерные признаки
- •Доброкачественные эпителиальные опухоли
- •Предраковые состояния и злокачественные опухоли эпидермиса
- •Опухоли дермы
- •Опухоли кожи, развивающиеся из «пришлых» клеточных элементов
- •Острые воспалительные дерматозы
- •Хронические воспалительные дерматозы
- •Буллезные заболевания кожи
- •25*10* Инфекционные и паразитарные заболевания кожи
- •Глава 26 заболевания центральной нервной системы, периферических нервов, глаз и ушей
- •Общие сведения
- •Основные проявления поражений мозговой ткани
- •181 /4. Зак. М. А. Пальцева, т. 2, ч. 2
- •Объемные (расширяющиеся) внутричерепные заболевания
- •Черепно-мозговая травма
- •Нарушения кровообращения
- •Головного мозга
- •ЬСхема 26.7. Инфаркты головного мозга в бассейне средней мозговой артерии
- •Инфекционные заболевания центральной нервной системы
- •Гнойные инфекции
- •Негнойные инфекции
- •Грибковые инфекции
- •Вирусные инфекции
- •19 /4. Зак. М. А. Пальцрня, т. 2, ч. 2
- •Демиелинизирующие заболевания
- •Метаболические заболевания центральной нервной системы
- •Заболевания центральной нервной системы, связанные с различными видами недостаточности, интоксикации и лучевой терапии
- •Изменения центральной нервной системы при старении, дегенеративных процессах и деменции (слабоумии)
- •Системные заболевания центральной нервной системы
- •Врожденные аномалии (пороки развития) центральной нервной системы. Повреждения головного мозга в перинатальном периоде
- •Заболевание спинного мозга
- •Поражением
- •Опухоли центральной нервной системы
- •Заболевания периферических нервов и параганглиев
- •Заболевания глаз
- •Стекловидное тело
- •Заболевания уха
- •3 Шейки матки II, 193
- •Часть II 1
Врожденные пороки развития
Определение и частота. Врожденным пороком развития называют морфологический дефект органа, его части или области тела, ведущий к нарушению функции органов. В случае, когда имеются изменения, «выходящие» за пределы нормальных вариаций развития, но не нарушающие функции органа, говорят о микроаномалиях, или морфогенетических вариантах.
Частота новорожденных с пороками развития составляет в среднем 3 %, при учете микроаномалий она превышает 10 %. В связи с продолжающимся ухудшением экологии частота рождения детей с врожденными пороками развития может повышаться. Как ни парадоксально, успехи здравоохранения в лечении ряда болезней приводят к увеличению распространенности пороков развития в популяции. Во-первых, благодаря успешному лечению фенилкетонурии, врожденных пороков сердца, желудочно-кишечного тракта и других аномалий больные становятся способными к деторождению. Известно, что частота врожденных пороков развития в потомстве таких больных значительно повышена. Во-вторых, улучшение медицинской помощи продлевает жизнь больных с пороками развития, и общее их число в популяции увеличивается. В то же время можно ожидать снижения частоты врожденных пороков развития у новорожденных в связи с широким внедрением в медицинскую практику ультразвукового пренатального обследования и прерывания беременности при выявлении пороков.
Среди причин смерти новорожденных врожденные пороки развития занимают одно из ведущих мест. Показатель удельного веса таких пороков в структуре смертности зависит от уровня медицинской помощи беременным и новорожденным. Чем меньше смертность новорожденных от родовой травмы, инфекций и других причин, тем больший удельный вес будут занимать пороки. В странах с высоким уровнем медицинской помощи врожденные пороки развития достигают 20 % среди причин смерти новорожденных.
Классификация. По распространенности в организме врожденные пороки развития подразделяют на изолированные (возникающие в одном органе, например порок сердца), системные (в пределах одной системы органов, например хондродисплазии) и множественные (в органах двух и более систем, например синдромы Патау, Эдвардса, Дауна). Пороки, возникшие в результате непосредственного воздействия наследственного или экзогенного тератогенного фактора, называют первичными. Вторичные пороки являются осложнением первичных и патогенетически связаны с ними. Например, при диафрагмальной грыже (первичный порок) развиваются гипоплазия легких и нарушение лобуляции печени (вторичные пороки). Для определения множественности учитывают лишь первичные пороки. Так, приведенный пример комплекса пороков не следует считать множественными пороками.
Изолированные и системные пороки классифицируют по системам органов. Множественные пороки подразделяют на синдромы и неуточненные комплексы. Синдромом множественных врожденных пороков развития называют устойчивые сочетания двух и более первичных пороков, при которых очевидна их патогенетическая связь и очерчена клиническая картина. Множественные аномалии, которые развиваются в виде «каскада» вслед за одним первичным нарушением, называют последовательностью.
Этиология. По этиологии врожденные пороки подразделяют на наследственно обусловленные, экзогенно обусловленные, пороки мультифакториальной этиологии. Остановимся на каждой группе.
Наследственно обусловленные пороки возникают вследствие хромосомных, геномных (хромосомные болезни), а также генных мутаций. Хромосомные мутации подробно освещены в главе 8. Там речь идет, в частности, о синдромах Дауна, Эдвардса (см. рис. 8.7) и Патау. В той же главе даны характеристики аутосомно-доминантным, аутосомно-рецессивным и А'-сцеп- ленным заболеваниям.
Врожденные пороки развития, обусловленные факторами внешней среды. Они возникают при действии на зародыш тера- тогенов. Тератогены — агенты, которые могут обусловливать пороки при влиянии на развивающийся эмбрион. Они способны вызывать гибель клеток, нарушение тканевого роста и дифференцировки. В результате их воздействий часто возникает сочетание врожденных пороков развития с задержкой роста плода, нарушением функции различных органов, в первую очередь центральной нервной системы. Тератогены часто вызывают внутриутробную гибель плода. Наибольшая чувствительность зародыша человека к действию этих агентов наблюдается в 1-й раз в конце 1-й — начале 2-й недели и 2-й раз — между
й и 6-й неделями внутриутробного развития. Эти сроки называют критическими периодами развития. Критические периоды связаны со временем наиболее интенсивного формирования органов.
Воздействие одного и того же тератогена в разные периоды эмбрионального развития может вызвать различные пороки и, наоборот, различные тератогены, примененные в одно и то же время, могут привести к формированию однотипных пороков. Однако некоторые тератогены обладают специфическим действием. Например, талидомид поражает преимущественно зачатки мезодермального происхождения, варфарин — эпифизы трубчатых костей, алкоголь — центральную нервную систему и лицевые структуры. Тератогенным эффектом обладают инфекционные агенты, лекарства и другие химические вещества, физические агенты, метаболические продукты при обменных заболеваниях матери. К основным тератогенам можно отнести следующие. Инфекции: краснуха, цитомегалия, токсоплазмоз. Лекарства и химические агенты: антикоагулянты (варфарин), про- тивосудорожные препараты (дифенилгидантоин, фенобарбитал), гипервитаминоз А, ретиноевая кислота, талидомид, литий, противоопухолевые алкилирующие средства, алкоголь, кокаин. Физические агенты: радиация, гипертермия. Заболевания матери: сахарный диабет, фенилкетонурия.
Тератогенное действие вирусов. Впервые оно было показано на примере вируса краснухи. Поражение плода происходит, если беременная заболевает краснухой. Максимальное трансплацентарное проникновение вируса отмечается в инкубационный период, соответствующий виремии. Поражение плода наблюдается в 50 % случаев при болезни женщины на 1-м месяце беременности, в 15—25 % при заболевании на 2—3-м месяце, и всего 3—8 % — во II и III триместрах беременности.
Проявления синдрома врожденной краснухи (краснушная эмб- риофетопатия) следующие: внутриутробная задержка роста, врожденные пороки развития глаз (катаракта, пигментная ретинопатия, микрофтальмия, глаукома), аномалии сердечно-сосу- дистой системы (открытый артериальный проток, стеноз легочной артерии и аорты, дефекты межпредсердной и межжелудоч- ковой перегородок), миокардит, аномалии центральной нервной системы, глухота. Персистирование вируса в организме новорожденного обусловливает такие изменения, как гепатоспле- номегалия, кожная сыпь, тромбоцитопения, иммунодефицит. Классической диагностической триадой являются катаракта, пороки сердца и глухота.
Цитомегаловирусная инфекция (CMV). Она встречается у 5—6 % беременных. Обычно инфекция протекает бессимптомно. У женщин с первичной инфекцией риск поражения плода достигает 30—40 %. При наличии в крови матери IgG-антител риск трансплацентарной передачи значительно уменьшается.
Врожденная цитомегаловирусная инфекция характеризуется поражениями центральной нервной системы (микроцефалия, микрогирия, паравентрикулярные кальцификаты, глухота, умственная отсталость, судороги) и глаз (хориоретинит, атрофия зрительных нервов, микрофтальмия). Возможны также гепато- спленомегалия, желтуха, тромбоцитопения, гемолитическая анемия, петехиальная сыпь.
Токсоплазмоз. Заражение плода происходит в основном в случае острого заболевания беременной. В отличие от вирусных заболеваний риск поражения плода увеличивается со сроком беременности: при заболевании женщины в I триместре риск поражения плода составляет 25 %, во II и III — 75 %. У пораженных новорожденных наблюдается картина генерализованной инфекции, микро- и гидроцефалия, микрофтальмия. В более старшем возрасте отмечают умственную отсталость, церебральный паралич, нарушение зрения и слуха.
Радиация. Тератогенный эффект ионизирующей радиации не вызывает сомнений, однако для его реализации доза облучения должна быть достаточно большой (техногенные аварии, терапевтическое облучение в области развивающегося зародыша, например при раке шейки матки). Дозы излучения, получаемые женщиной при диагностических манипуляциях, тератогенного действия не оказывают. Высокие дозы вызывают поражение центральной нервной системы, умственную отсталость.
Тератогенное действие лекарственного вещества. Оно зависит от его химического строения, способности проникать через плацентарный барьер, дозы препарата, генетически обусловленной скорости его метаболизма в организме матери. В эксперименте можно получить тератогенный эффект при назначении очень высоких доз лекарств, однако в клинической практике такие ситуации встречаются крайне редко. Некоторые препараты при длительном применении в невысоких дозах стимулируют выработку метаболизирующих ферментов, разрушающих препарат и таким образом препятствующих тератогенному эффекту. Для других препаратов, например гормонов, имеется обратная зависимость — длительное применение в малых дозах оказывает больший тератогенный эффект, чем однократное применение суммарной дозы.
К лекарственным препаратам с доказанным тератогенным эффектом относятся транквилизатор талидомид, антикоагулянты (варфарин), назначаемые женщинам при тромбофлебите и реже при протезировании сердечных клапанов, антиконвуль- санты (дифенилгидантоин), которые женщина, больная эпилепсией, вынуждена продолжать принимать во время беременности, ретиноевая кислота, используемая при лечении угрей.
Среди лекарственных агентов наиболее известным тератоге- ном является тринквилизатор талидомид, который при введении в организм женщины на 4—10-й неделе беременности вызывает тяжелое нарушение развития конечностей, а также ушей и глаз. В настоящее время талидомид в медицинской практике не применяется. При назначении варфарина в I триместре беременности риск гибели плода или развития у него пороков достигает 33 %. Период максимальной чувствительности к препарату — 6—9 нед. Характерные пороки: гипоплазия носа, атре- зия хоан, микроцефалия, агенезия мозолистого тела, аномалии глаз. Дифенилгидантоин вызывает пороки развития примерно в 10 % случаев: недоразвитие срединных структур лица, задержка роста, высокий риск расщелин губы и неба, гипоплазия дистальных фаланг и ногтей. Ретиноевая кислота обусловливает че- репно-лицевые аномалии [микротия, анотия (соответственно маленькие или отсутствующие ушные раковины), расщелина неба, аномалии лицевых костей], врожденные пороки сердца, пороки центральной нервной системы, аномалии конечностей.
Суммарный вклад лекарственных тератогенов в детскую патологию невелик — вызванные ими пороки составляют не более 1 % от всех врожденных пороков.
Хронический прием алкоголя во время беременности. В 40—50 % случаев это приводит к рождению ребенка с фетальным алкогольным синдромом. Дети рождаются с низкой для гестационного возраста массой тела. В постнатальном периоде наблюдают задержку умственного и физического развития, серьезные неврологические нарушения. При внешнем осмотре выявляются умеренная микро- и гидроцефалия, короткие и узкие глазные щели, эпикантус (вертикальная кожная складка, прикрывающая медиальный угол глазной щели), гипоплазия нижней челюсти. Повышена частота врожденных пороков сердца, скелета (воронкообразная грудная клетка), суставов и др.
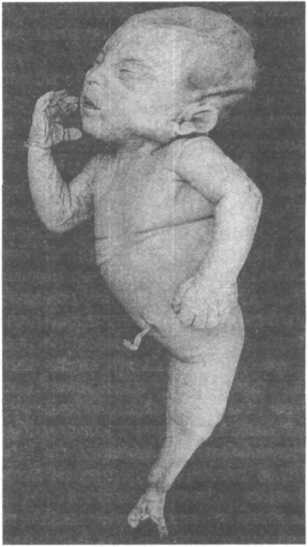
Сахарный диабет матери. Это заболевание может привести к врожденным порокам развития у плода (диабетическая эмбриопатия). Вероятно, тератогенный эффект при сахарном диабете обусловлен гипер- и гипогликемией, но не инсулином, который не проникает через плаценту. Наиболее характерны отсутствие крестца, копчика, иногда бедренных костей, си- реномелия (слияние нижних конечностей) (рис. 22.13). Повышена также частота пороков сердца, центральной нервной системы и мочеполовой системы. Дети от матерей, больных сахарным диабетом, обычно рождаются с большой массой тела за счет избыточного развития подкожной клетчатки. При деком- пенсированном диабете возможна, напротив, пренатальная гипоплазия. Характерным признаком является гиперплазия эндокринной части поджелудочной железы, обусловленная гипергликемией. У новорожденных от матерей с сахарным диабетом очень высок риск развития болезни гиалиновых мембран
.
Рис. 22.13. Сиреномелия (сращение костей нижних конечностей).
Мультифакториальными врожденными пороками развития называют такие формы патологии, которые вызваны взаимодействием наследственных и экзогенных факторов, причем ни один из них по отдельности не является причиной порока (см. главу 8). К мульти- факториальным порокам относят пилоростеноз, расщелины губы и неба, пороки развития нервной трубки (анэнцефалия. spina bifida), некоторые врожденные пороки сердца.
Из общего количества врожденных пороков генетически обусловленные формы (хромосомные и генные) составляют 20— 30 %, экзогенные формы — 2—5 %, мультифакториальные — 30— 40 % [по Cotran R.S., Kumar V., Collins Т., 1998]. В 25-50 % случаев, по данным разных авторов, этиология пороков остается невыясненной.
Патогенез. К основным клеточным механизмам тератогенеза относят нарушения размножения, миграции и дифференцировки клеток. В результате нарушения размножения клеток, обычно связанного со снижением митотической активности, развиваются гипоплазия или аплазия органа либо части его. Этот же механизм может вызвать нарушение слияния эмбриональных структур, происходящее в строго определенные периоды. В результате низкой пролиферативной активности нарушается контакт между эмбриональными структурами. Такой механизм лежит в основе некоторых дизрафий (незаращений анатомических структур по срединной линии) — расщелин губы и неба, спинномозговых грыж. Пролиферация клеток развивающегося зародыша обусловлена теми же регуляторными молекулами, ко
торые участвуют в процессах регенерации и неоплазии (см. главы 6 и 7). Появляется все больше наблюдений, согласно которым спонтанные или экспериментально индуцированные изменения факторов роста вызывают развитие врожденных пороков. Например, у мышей описана мутация трансформирующего фактора роста а, вызывающая расщелину неба.
В результате нарушения миграции клеток могут развиться ге- теротопии, агенезии и другие пороки. Миграция клеток при нормальном развитии происходит во внеклеточном матриксе при участии адгезивных гликопротеинов. Наследственные или экзогенно обусловленные изменения состава внеклеточного матрикса, действуя на миграцию клеток, приводят к формированию врожденных пороков развития. Например, такие пороки характерны для мышей с наследственно обусловленными дефектами интегринов и/или фибронектина. При введении кадмия беременным мышам у эмбрионов нарушается образование коллагенового матрикса, в связи с чем не происходит миграция клеток нейроэктодермального гребня в верхнечелюстные отростки и у плодов образуются черепно-лицевые аномалии. С нарушением миграции клеток в эмбриональном периоде у человека связывают развитие синдромов Робиноу (M.Robinow; карликовый рост, гипоплазия зубов и половых органов, аномалии лица и др.), Ди-Джорджи (см. главу 5), срединных расщелин лица.
Нарушение дифференцировки клеток может вызвать разнообразные пороки в зависимости от того, на каком этапе эмбриогенеза это происходит. Остановка дифференцировки может обусловить рост бесформенной массы недифференцированных клеток (у ранних абортусов), агенезию органов, их незрелость, персистирование эмбриональных структур.
К основным механизмам тератогенеза на тканевом уровне относят нарушение адгезии тканей, апоптоза в процессе нормального эмбриогенеза, некроз клеточных масс. Запрограммированная гибель клеток (апоптоз) наблюдается в норме при слиянии первичных анатомических структур, например небных отростков, реканализации кишечной трубки, регрессии межпальцевых перепонок. При недостаточности этого процесса формируются такие пороки, как атрезия кишечника, синдактилии (сращение пальцев), при избыточном апоптозе — дефекты перегородок сердца, свищи и др. Некроз клеток и тканей связан с циркуляторными расстройствами (тромбоз сосудов, их сдавление) или непосредственным цитолитическим действием повреждающего фактора, например вируса. Повреждение механизма адгезии может наблюдаться даже в тех случаях, когда пролиферация тканей была нормальной. Этот механизм лежит в основе дизра- фий.
Врожденные пороки развития, которые формируются на поздних этапах внутриутробного развития, т.е. после окончания основного органогенеза, это главным образом остановка в развитии (гипоплазия), задержка перемещения органа на место его окончательной локализации (крипторхизм), изменения, связанные с механическими воздействиями (деформация конечностей при маловодии, амниотические перетяжки).
