
- •Часть II
- •Строение и функции почек
- •- Клубочек
- •Врожденные аномалии
- •Кистозные болезни почек
- •Гломерулярные болезни (общие сведения)
- •Острый гломерулонефрит
- •Нефротический синдром
- •I Ранние I - II стадии | | Поздние III - IV стадии [
- •Хронический гломерулонефрит
- •Повреждения почечных клубочков, связанные с системными заболеваниями
- •Диабетический гломерулосклероз
- •Амилоидоз
- •Другие системные заболевания
- •Наследственный нефрит
- •Заболевания почек, связанные с поражением канальцев и интерстиция
- •Пиелонефрит и инфекции мочевыводящих путей
- •Тубулоинтерстициальный нефрит, вызванный лекарствами и токсинами
- •Уратная нефропатия
- •Гиперкалыщемия и нефрокалыданоз
- •Множественная миелома
- •Доброкачественный нефросклероз
- •Злокачественная фаза гипертензии (злокачественный нефросклероз)
- •Стеноз почечной артерии
- •Тромботические микроангиопатии
- •Другие сосудистые заболевания почек
- •Обструкция мочевыводящих путей (обструктивная уропатия)
- •Уролитиаз (камни почек)
- •Опухоли почек
- •Заболевания мочеточников
- •Заболевания мочевого пузыря
- •Заболевания уретры
- •Болезни мужского полового члена
- •Болезни предстательной железы
- •Заболевания яичек и придатков яичек
- •Воспалительные и некротические заболевания
- •Фиброзно-кистозные заболевания
- •Опухоли
- •Заболевания грудных желез у мужчин
- •Заболевания вульвы и влагалища
- •Болезни матки
- •Секреторная фаза
- •Причины
- •Болезни маточных труб
- •Болезни яичников
- •Опухоли
- •Опухолей
- •Глава 22 патология беременности и послеродового периода- пре- и постнатальные расстройства, заболевания младенчества и детства
- •Патология плаценты
- •Патология беременности
- •Патология маточно - плацентарных (спиральных) артерий
- •Внутриутробный возраст и масса плода
- •Родовая травма и родовые повреждения
- •Болезни легких перинатального периода
- •Врожденные пороки развития
- •Внутриутробные инфекции
- •Гемолитическая болезнь новорожденных
- •Наследственные нарушения метаболизма
- •Гидроксилирование фенилалалина Фенил апанингидроксилаза
- •Нарушение гидроксилирования при фенилкетонурии Фенил апанингидроксилаза
- •II этап галакт030 _ 1 _ фосфат—
- •III этап
- •Синдром внезапной смерти ребенка
- •Опухоли у детей
- •Болезни щитовидной железы
- •Болезни околощитовидных желез
- •Болезни коркового вещества надпочечников
- •- Дегидроэпиандростерон
- •Болезни мозгового вещества надпочечников
- •Болезни тимуса (вилочковой железы)
- •Болезни шишковидной железы
- •Множественная эндокринная неоплазия
- •24.1. Общие сведения
- •24*2» Аномалии развития костей
- •Заболевания, связанные с аномалией матрикса кости
- •Остеогенеза
- •Наследования Сущность поражения коллагена
- •Заболевания, вызванные дисфункцией остеокластов
- •Заболевания, связанные с нарушениями минерального гомеостаза
- •Остеонекроз (аваскулярный остеонекроз, асептический некроз кости)
- •Остеомиелит
- •Опухоли и опухолеподобные заболевания костей
- •Опухоли, сгруппированные по источнику гистогенеза
- •Костеобразующие опухоли
- •Хрящеобразующие опухоли
- •Соединительнотканные (фиброзные) и фиброзно-костные опухоли
- •Опухоли разного происхождения
- •Метастатические опухолевые поражения скелета
- •Болезни суставов
- •Остеоартрит, или дегенеративное заболевание суставов
- •Ревматоидный артрит
- •Серонегативные спондилоартропатии
- •Инфекционный артрит
- •Артропатии с отложением кристаллов
- •Опухоли суставов и структур, связанных с суставами
- •Опухоли и опухолеподобные образования мягких тканей
- •Заболевания скелетных мышц
- •Мышечные дистрофии
- •Врожденные миопатии
- •Миопатии, связанные с врожденными ошибками метаболизма
- •Воспалительные миопатии
- •Поражения нервно-мышечного соединения
- •Опухоли скелетной мускулатуры
- •Глава 25 заболевания кожи
- •Общие сведения
- •Нарушения пигментации.
- •Маркерные признаки
- •Доброкачественные эпителиальные опухоли
- •Предраковые состояния и злокачественные опухоли эпидермиса
- •Опухоли дермы
- •Опухоли кожи, развивающиеся из «пришлых» клеточных элементов
- •Острые воспалительные дерматозы
- •Хронические воспалительные дерматозы
- •Буллезные заболевания кожи
- •25*10* Инфекционные и паразитарные заболевания кожи
- •Глава 26 заболевания центральной нервной системы, периферических нервов, глаз и ушей
- •Общие сведения
- •Основные проявления поражений мозговой ткани
- •181 /4. Зак. М. А. Пальцева, т. 2, ч. 2
- •Объемные (расширяющиеся) внутричерепные заболевания
- •Черепно-мозговая травма
- •Нарушения кровообращения
- •Головного мозга
- •ЬСхема 26.7. Инфаркты головного мозга в бассейне средней мозговой артерии
- •Инфекционные заболевания центральной нервной системы
- •Гнойные инфекции
- •Негнойные инфекции
- •Грибковые инфекции
- •Вирусные инфекции
- •19 /4. Зак. М. А. Пальцрня, т. 2, ч. 2
- •Демиелинизирующие заболевания
- •Метаболические заболевания центральной нервной системы
- •Заболевания центральной нервной системы, связанные с различными видами недостаточности, интоксикации и лучевой терапии
- •Изменения центральной нервной системы при старении, дегенеративных процессах и деменции (слабоумии)
- •Системные заболевания центральной нервной системы
- •Врожденные аномалии (пороки развития) центральной нервной системы. Повреждения головного мозга в перинатальном периоде
- •Заболевание спинного мозга
- •Поражением
- •Опухоли центральной нервной системы
- •Заболевания периферических нервов и параганглиев
- •Заболевания глаз
- •Стекловидное тело
- •Заболевания уха
- •3 Шейки матки II, 193
- •Часть II 1
Гломерулярные болезни (общие сведения)
Гломерулярные (клубочковые) болезни являются причиной некоторых серьезных проблем в нефрологии. Например, хронический гломерулонефрит — одна из наиболее распространенных причин хронической почечной недостаточности. Клубочки могут быть повреждены под действием различных факторов, а также при системных заболеваниях. Аутоиммунные заболевания, такие как системная красная волчанка, сосудистые заболевания — гипертензия и узелковый периартериит, метаболические заболевания (сахарный диабет), а также некоторые врожденные заболевания (например, болезнь Фабри), часто повреждают клубочек. Различают первичный гломерулонефрит, при котором почка является единственным или преимущественно поврежденным органом, и вторичный гломерулонефрит, при котором этот парный орган повреждается в результате какого-либо общего заболевания.
Разные типы гломерулонефрита характеризуются одной (или более) из 4 основных тканевых реакций. Многокдеточность (гиперцеллюлярность) клубочков возникает при так называемых воспалительных поражениях, сопровождающихся увеличением количества клеток в клубочках. Эта многоклеточность связана с одной причиной или комбинацией двух следующих причин: пролиферацией мезангиальных, эндотелиальных, а в некоторых случаях и париетальных эпителиальных клеток; лейкоцитарной инфильтрацией, состоящей из нейтрофилов, моноцитов, а при некоторых заболеваниях и лимфоцитов. Наблюдают утолщение базальной мембраны. Под световым микроскопом это изменение проявляется в утолщении стенок капилляров, лучше всего видимом в срезах, окрашенных с помощью PAS-реакции. При электронной микроскопии можно распознать причину утолщения: утолщение собственно базальной мембраны, например при диабетическом гломерулосклерозе; осаждение аморфного электронно-плотного вещества, представляющего собой преципити- рованные белки на эндотелиальной или эпителиальной стороне базальной мембраны или в самой базальной мембране. Наиболее распространенный тип утолщения обусловлен появлением субэпителиальных депозитов, например при мембранозном гло- мерул онефрите.
При гломерулонефрите могут быть гиалиноз и склероз. Гиали- ноз клубочков связан с накоплением вещества, которое под световым микроскопом выглядит гомогенным и эозинофильным. При электронной микроскопии видно, что это вещество расположено вне клеток и состоит из преципитированных белков плазмы. Наблюдается также увеличение собственно базальной мембраны и мезангиального матрикса. Эти изменения приводят к облитерации капиллярных петель почечного клубочка (склероз) и развиваются обычно в исходе различных гломерулярных повреждений.
Дополнительные повреждения вызывают осаждение фибрина и аномальных веществ (амилоида, так называемых «плотных депозитов», липидов), интрагломерулярный тромбоз.
По масштабу и локализации поражения разделяют на глобальные, вовлекающие в патологию целый клубочек; сегментарные, поражающие лишь часть клубочка; диффузные, захватываю-
Схема 18.4. Виды повреждений почечных клубочков
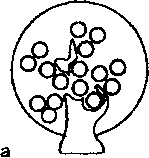
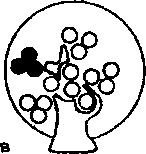
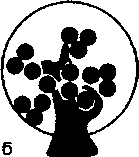
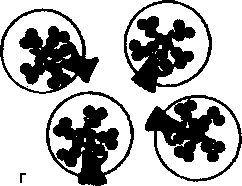
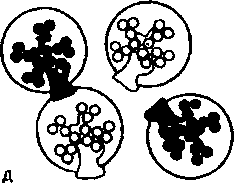
щие все клубочки; фокальные, повреждающие часть почечных клубочков (схема 18.4). Эти термины используют в гистологической классификации гломерулонефрита.
Хотя клиническая картина каждого типа гломерулонефрита имеет свои особенности, существует 4 основных правила, которые, хотя и не абсолютны, но приемлемы для большинства случаев.
а Структурные изменения гломерулярной базальной мембраны (в основном связанные с ее утолщением) или массивные накопления мезангиального матрикса приводят к массивной потере белка с мочой и развитию нефротического синдрома.
а Гломерулярные повреждения, обусловленные пролиферацией эндотелиальных или мезангиальных клеток, связаны с развитием гематурии, или нефритического синдрома.
а Если повреждения базальной мембраны сопровождаются клеточной пролиферацией, то говорят о наличии смешанного нефритического/нефротического синдрома.
а Если повреждения клубочков развиваются быстро и имеют диффузный характер, развивается картина острой почечной недостаточности.
Рассмотрим патогенез гломерулярных повреждений.
В основе большинства случаев первичного гломерулонефрита и многих вторичных гломерулопатий лежит иммуноопосредо
-
Схема 18.5. Механизмы образования депозитов
|
а. Циркулирующие б. Иммунные комплексы in situ иммунные комплексы f Л г : n Q |
|
О о О О |
t |
v л * |
*********** |
* А |
|
—О т К л Y |
Острый
сыворо- Нефрит Хайманна Анти-ГМБ-нефрит
точный нефрит
ванное воспаление. Иммунные механизмы, с которыми связаны иммунные повреждения, подробно описаны в главе 5.
Острое воспаление характеризуется инфильтрацией почечного клубочка лейкоцитами и отеком, иногда сопровождающееся некрозом, геморрагиями и тромбозом. Преобладание нейтрофи- лов типично для острого воспаления, в то время как для хронического более характерно наличие в инфильтрате моноцитов и лимфоцитов.
В почечном клубочке гистологическая картина характеризуется гиперклеточностью, набуханием клеток, некрозом и отложениями фибрина в капиллярных петлях. Гиперклеточность обусловлена как инфильтрацией клубочка лейкоцитами, так и пролиферацией клеток почечного клубочка — мезангиальных клеток, эндотелия и париетальных эпителиальных клеток. Некроз гломерулярных клеток характеризуется кариорексисом и пикно- зом ядер, накоплением фибрина вместо разрушенных клеток и лизисом матрикса (фибриноидный некроз). В основе этих нарушений лежит выделение комплекса медиаторов, включая компоненты комплемента, факторы коагуляции, метаболиты кислорода, протеазы, эйкозаноиды, цитокины и др. Помимо этого, воспаление сопровождается появлением в почечных клубочках отложений иммунных комплексов. Этот процесс в стенке гломерулярных капилляров — первый механизм иммуноопосредован- ного поражения, который был идентифицирован.
Существуют две формы повреждений почечных клубочков, обусловленные действием антител: 1) повреждения, связанные с осаждением растворимых циркулирующих иммунных комплексов;
повреждения, вызываемые антителами, связывающимися in situ либо с нерастворимыми гломерулярными антигенами, либо с антигенами, внедренными в почечный клубочек (схема 18.5).Рис. 18.3. Гранулярное свечение в клубочке при остром сывороточном нефрите.
Отложение циркулирующих иммунных комплексов. Долгое время оно рассматривалось как наиболее важный фактор имму- нокомплексного гломерулонефрита. Гранулярное свечение иммуноглобулинов и комплемента в клубочках, стенках сосудов и базальной мембране канальцев при иммунофлюоресцентной микроскопии свидетельствует об участии иммунных комплексов в патогенезе гломерулонефрита, васкулита и тубулоинтер- стициального нефрита (рис. 18.3).
Экспериментальный нефрит легко воспроизвести с помощью введения больших количеств чужеродного белка (модель острого сывороточного нефрита). В ответ вырабатываются антитела, связывающие вводимый антиген и формирующие комплексы антиген—антитело. Антитела не имеют иммунологической специфичности для составных частей клубочка, а комплексы оказываются в клубочках благодаря их физико-химическим особенностям и гемодинамическим факторам, свойственным почечному клубочку (см. схему 18.5).
Многие исследователи, изменяя число, время и природу вводимого антигена, воспроизводили большинство морфологических форм острого и хронического иммунокомплексного гломерулонефрита. На основании полученных данных была выдвинута теория о том, что все формы иммунокомплексного нефри-
Рис.
18.4. Линейное свечение при анти-ГБМ
(гломерулярная базальная мембрана)
нефрита.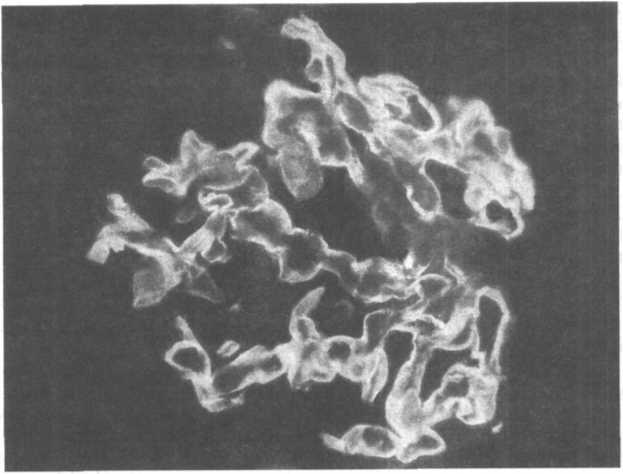
та человека вызываются отложением циркулирующих иммунных комплексов. Однако, как показали дальнейшие исследования, уровень циркулирующих иммунных комплексов не всегда коррелирует с тяжестью повреждения.
Осаждение иммунных комплексов in situ. В основе другого механизма, вызывающего повреждения в почечном клубочке, лежит осаждение иммунных комплексов in situ. При этой форме повреждения антитела реагируют непосредственно с постоянными компонентами клубочка (например, коллагеном IV типа в гломерулярной базальной мембране) или антигенами, внедренными в клубочки (связывание катионных гетерогенных белков с гломерулярной базальной мембраной). Линейное свечение иммуноглобулинов вдоль гломерулярной базальной мембраны при иммуно- флюоресцентной микроскопии указывает на связывание in situ антител к гломерулярной базальной мембране с ее компонентами (рис. 18.4). В настоящее время этот механизм рассматривают как ведущий в патогенезе большинства форм гломерулонефрита.
Существует несколько экспериментальных моделей, отражающих различные механизмы антительного гломерулярного повреждения: анти-ГБМ (гломерулярная базальная мембрана)-нефрит [нефротоксический нефрит, Масуги (MasugO-нефрит], антиэпи- телиально-клеточный нефрит [нефрит Хаймана; Heyman), анти- мезангиально-клеточный нефрит (анти-Thy 1.1-нефрит), нефрит, индуцированный аутоантителами к цитоплазме нейтрофилов [antineutrophil cytoplasmic autoantibodies (AN С А)-нефрит].
Ант и-Г Б М-н е ф р и т. В этой модели антитела направлены непосредственно против антигенов, структурно расположенных в базальной мембране клубочка (см. схему 18.5). Введенные антитела оседают по всей длине базальной мембраны почечного клубочка, вызывая при иммунофлюоресценции гомогенное, диффузное, линейное свечение (см. рис. 18.4). Нередко антитела к гломерулярной базальной мембране перекрестно реагируют с другими базальными мембранами (особенно легочных альвеол), вызывая одновременное повреждение легких и почек (синдром Гудпасчера, см. ниже). Антительный нефрит встречается менее *:ем в 5 % случаев гломерулонефрита человека. Большинство случаев антительного нефрита характеризуется тяжелыми гломерулярными повреждениями и развитием быстро прогрессирующей почечной недостаточности.
Нефрит Хаймана. Модель была получена путем иммунизации крыс суспензией коркового слоя почек животных. Эта модель получила название активного нефрита Хаймана. Позже установили, что антитела, образующиеся у крыс, направлены против антигена, локализованного на щеточной кайме эпителия проксимальных канальцев и подоцитах (FxlA-анти- ген). При введении антител к FxlA-антигену была получена пассивная форма нефрита Хаймана. Антитела формировали in situ депозиты иммунных комплексов, которые при электронной микроскопии локализуются вдоль субэпителиальной поверхности базальной мембраны, напоминая мембранозную гломеру- лопатию у человека (см. схему 18.5).
Ант и-Т hy 1.1-нефри т. Thy 1.1-антиген является фос- фатидилинозитольным гликопротеином, экспрессируемым на тимоцитах, ряде клеток соединительной ткани и на мезангиаль- ных клетках крыс. При введении антител к Thy 1.1-антигену антитела фиксируются на мезангиальных клетках, развивается мезангиолизис с последующей пролиферацией мезангиальных клеток. Все это напоминает иммунокомплексную форму мезан- гиопролиферативного гломерулонефрита человека.
А N С А-н е ф р и т. Мишенью для нейтрофильных аутоантител служат белки цитоплазматических гранул нейтрофилов и лизосом моноцитов. Развивающийся ANCA-нефрит сопровождается инфильтрацией почечного клубочка нейтрофилами и моноцитами, фибриноидным некрозом и распадом лейкоцитов. Наряду с капиллярами почечных клубочков ANCA поражают стенки других сосудов, способствуя развитию васкулита. Доказана ведущая роль ANCA в патогенезе (80—90 %) гранулематоза Вегенера и микроскопического полиангиита, ряда случаев гломерулонефрита с полулуниями.
Помимо этого, антитела могут реагировать in situ с ранее внедренными в структуры почечных клубочков негломерулярными антигенами. Внедренными антигенами могут быть катионные молекулы, связывающиеся с анионными сайтами гломерулярной базальной мембраны; ДНК, обладающая сродством (аффинностью) к компонентам гломерулярной базальной мембраны; бактериальные продукты, такие как эндострептозин — белок стрептококков группы А; крупные агрегированные белки, например агрегированные IgG, которые оседают в мезангии из- за своих размеров и наличия на мезангиальных клетках Fc-pe- цепторов; иммунные комплексы (так как они имеют участки, способные взаимодействовать со свободными антителом, антигеном или комплементом). Нет недостатка и в других возможных внедренных антигенах, включая вирусные, бактериальные и паразитарные продукты и лекарства. Большинство этих антигенов дает гранулярное или гетерогенное свечение депозитов иммуноглобулинов при иммунофлюоресцентной микроскопии.
Клеточно-обусловленный иммунитет при гломерулонефрите. Хотя антителоопосредованные механизмы могут инициировать многие формы гломерулонефрита, существуют неопровержимые доказательства того, что сенсибилизированные нефритогенные Т-лимфоциты повреждают почечные клубочки и участвуют в прогрессировании многих форм гломерулонефрита. «Ключом» к объяснению этого феномена служит наличие моноцитов/макрофагов и Т-лимфоцитов в почечных клубочках при некоторых формах гломерулонефрита (см. главу 5).
Медиаторы повреждения почечного клубочка. Лейкоциты, инфильтрирующие почечный клубочек, как и сами клетки почечного клубочка, выделяют медиаторы, которые вызывают как повреждения, так и реактивные изменения, характерные для острого и хронического воспаления.
Нейтрофилы инфильтрируют почечный клубочек при тех типах гломерулонефрита, которые связаны с активацией комплемента, приводящей к образованию хемотаксических агентов, главным образом С5а и сопровождающейся Fc-обусловленным иммунным прилипанием. Нейтрофилы выделяют протеазы, разрушающие гломерулярную базальную мембрану, свободные радикалы кислорода, вызывающие гибель клеток, метаболиты арахидоновой кислоты, с которыми связано уменьшение почечного кровотока.
Моноциты, макрофаги и лимфоциты инфильтрируют почечный клубочек и при антитело- и клеточно-обусловленных реакциях продуцируют огромное количество различных биологически активных молекул.
При иммунологически обусловленном повреждении происходит агрегация тромбоцитов в почечных клубочках, являющихся источником эйкозаноидов и ростовых факторов.
Резидентные гломерулярные клетки (особенно мезангиальные) после стимуляции способны образовывать воспалительные медиаторы — свободные радикалы кислорода, цитокины, факторы роста, эйкозаноиды, оксид азота и эндотелии. В отсутствие лейкоцитарной инфильтрации они могут инициировать воспалительный ответ в почечных клубочках.
Фактически все воспалительные химические медиаторы (см. главу 4) вовлечены в повреждение почечных клубочков, вызывая гибель одних клеток и стимуляцию других. Хемотаксические компоненты комплемента способствуют прилипанию лейкоцитов и выходу их из капилляров в мезангий. Эйкозаноиды, оксид азота и эндотелии участвуют в развитии гемодинамических нарушений. Цитокины, особенно интерлейкин (ИЛ)-1 и фактор некроза опухоли (ФНО)-а, стимулируют прилипание лейкоцитов и ряд других эффектов. Ростовые факторы, в частности тромбоцитарный фактор роста (ТцФР), участвуют в пролиферации мезангиальных клеток, а трансформирующий фактор роста (ТФР)-р стимулирует накопление внеклеточного матрикса, приводящее к развитию гломерулосклероза при хроническом течении заболевания.
Система свертывания крови также участвует в повреждении почечного клубочка. Фибрин часто обнаруживают в капиллярных петлях почечных клубочков при гломерулонефрите, а фибриноген может проникать в пространство капсулы клубочка, являясь стимулом для пролиферации клеток париетального эпителия. Образование фибрина обусловлено главным образом стимуляцией прокоагулянтной активности макрофагов.
Многие виды гломерулонефрита сопровождаются появлением воспалительных клеток — лимфоцитов и макрофагов — в ин- терстиции. В некоторых случаях, например при антительном гломерулонефрите, появление инфильтрата индуцирует синтез перекрестно реагирующих антител к базальной мембране канальцев. В других случаях развитие инфильтрата связано с гиперчувствительностью замедленного типа.
