
- •Часть II
- •Строение и функции почек
- •- Клубочек
- •Врожденные аномалии
- •Кистозные болезни почек
- •Гломерулярные болезни (общие сведения)
- •Острый гломерулонефрит
- •Нефротический синдром
- •I Ранние I - II стадии | | Поздние III - IV стадии [
- •Хронический гломерулонефрит
- •Повреждения почечных клубочков, связанные с системными заболеваниями
- •Диабетический гломерулосклероз
- •Амилоидоз
- •Другие системные заболевания
- •Наследственный нефрит
- •Заболевания почек, связанные с поражением канальцев и интерстиция
- •Пиелонефрит и инфекции мочевыводящих путей
- •Тубулоинтерстициальный нефрит, вызванный лекарствами и токсинами
- •Уратная нефропатия
- •Гиперкалыщемия и нефрокалыданоз
- •Множественная миелома
- •Доброкачественный нефросклероз
- •Злокачественная фаза гипертензии (злокачественный нефросклероз)
- •Стеноз почечной артерии
- •Тромботические микроангиопатии
- •Другие сосудистые заболевания почек
- •Обструкция мочевыводящих путей (обструктивная уропатия)
- •Уролитиаз (камни почек)
- •Опухоли почек
- •Заболевания мочеточников
- •Заболевания мочевого пузыря
- •Заболевания уретры
- •Болезни мужского полового члена
- •Болезни предстательной железы
- •Заболевания яичек и придатков яичек
- •Воспалительные и некротические заболевания
- •Фиброзно-кистозные заболевания
- •Опухоли
- •Заболевания грудных желез у мужчин
- •Заболевания вульвы и влагалища
- •Болезни матки
- •Секреторная фаза
- •Причины
- •Болезни маточных труб
- •Болезни яичников
- •Опухоли
- •Опухолей
- •Глава 22 патология беременности и послеродового периода- пре- и постнатальные расстройства, заболевания младенчества и детства
- •Патология плаценты
- •Патология беременности
- •Патология маточно - плацентарных (спиральных) артерий
- •Внутриутробный возраст и масса плода
- •Родовая травма и родовые повреждения
- •Болезни легких перинатального периода
- •Врожденные пороки развития
- •Внутриутробные инфекции
- •Гемолитическая болезнь новорожденных
- •Наследственные нарушения метаболизма
- •Гидроксилирование фенилалалина Фенил апанингидроксилаза
- •Нарушение гидроксилирования при фенилкетонурии Фенил апанингидроксилаза
- •II этап галакт030 _ 1 _ фосфат—
- •III этап
- •Синдром внезапной смерти ребенка
- •Опухоли у детей
- •Болезни щитовидной железы
- •Болезни околощитовидных желез
- •Болезни коркового вещества надпочечников
- •- Дегидроэпиандростерон
- •Болезни мозгового вещества надпочечников
- •Болезни тимуса (вилочковой железы)
- •Болезни шишковидной железы
- •Множественная эндокринная неоплазия
- •24.1. Общие сведения
- •24*2» Аномалии развития костей
- •Заболевания, связанные с аномалией матрикса кости
- •Остеогенеза
- •Наследования Сущность поражения коллагена
- •Заболевания, вызванные дисфункцией остеокластов
- •Заболевания, связанные с нарушениями минерального гомеостаза
- •Остеонекроз (аваскулярный остеонекроз, асептический некроз кости)
- •Остеомиелит
- •Опухоли и опухолеподобные заболевания костей
- •Опухоли, сгруппированные по источнику гистогенеза
- •Костеобразующие опухоли
- •Хрящеобразующие опухоли
- •Соединительнотканные (фиброзные) и фиброзно-костные опухоли
- •Опухоли разного происхождения
- •Метастатические опухолевые поражения скелета
- •Болезни суставов
- •Остеоартрит, или дегенеративное заболевание суставов
- •Ревматоидный артрит
- •Серонегативные спондилоартропатии
- •Инфекционный артрит
- •Артропатии с отложением кристаллов
- •Опухоли суставов и структур, связанных с суставами
- •Опухоли и опухолеподобные образования мягких тканей
- •Заболевания скелетных мышц
- •Мышечные дистрофии
- •Врожденные миопатии
- •Миопатии, связанные с врожденными ошибками метаболизма
- •Воспалительные миопатии
- •Поражения нервно-мышечного соединения
- •Опухоли скелетной мускулатуры
- •Глава 25 заболевания кожи
- •Общие сведения
- •Нарушения пигментации.
- •Маркерные признаки
- •Доброкачественные эпителиальные опухоли
- •Предраковые состояния и злокачественные опухоли эпидермиса
- •Опухоли дермы
- •Опухоли кожи, развивающиеся из «пришлых» клеточных элементов
- •Острые воспалительные дерматозы
- •Хронические воспалительные дерматозы
- •Буллезные заболевания кожи
- •25*10* Инфекционные и паразитарные заболевания кожи
- •Глава 26 заболевания центральной нервной системы, периферических нервов, глаз и ушей
- •Общие сведения
- •Основные проявления поражений мозговой ткани
- •181 /4. Зак. М. А. Пальцева, т. 2, ч. 2
- •Объемные (расширяющиеся) внутричерепные заболевания
- •Черепно-мозговая травма
- •Нарушения кровообращения
- •Головного мозга
- •ЬСхема 26.7. Инфаркты головного мозга в бассейне средней мозговой артерии
- •Инфекционные заболевания центральной нервной системы
- •Гнойные инфекции
- •Негнойные инфекции
- •Грибковые инфекции
- •Вирусные инфекции
- •19 /4. Зак. М. А. Пальцрня, т. 2, ч. 2
- •Демиелинизирующие заболевания
- •Метаболические заболевания центральной нервной системы
- •Заболевания центральной нервной системы, связанные с различными видами недостаточности, интоксикации и лучевой терапии
- •Изменения центральной нервной системы при старении, дегенеративных процессах и деменции (слабоумии)
- •Системные заболевания центральной нервной системы
- •Врожденные аномалии (пороки развития) центральной нервной системы. Повреждения головного мозга в перинатальном периоде
- •Заболевание спинного мозга
- •Поражением
- •Опухоли центральной нервной системы
- •Заболевания периферических нервов и параганглиев
- •Заболевания глаз
- •Стекловидное тело
- •Заболевания уха
- •3 Шейки матки II, 193
- •Часть II 1
Причины
Преждевременное половое созревание (гипота- ламического, гипофизарного или овариального происхождения)
Ановуляторный цикл
Осложнения беременности [спонтанный аборт, трофобластическая болезнь (см. главу 22), эктопическая (внематочная) беременность] Различные поражения матки (лейомиома, аденомиоз, полипы, гиперплазия эндометрия, рак) Ановуляторный цикл
Овуляторные дисфункциональные кровотечения (несоответствие лютеиновой фазы и др.)
Ановуляторный цикл Неравномерное отторжение эндометрия Различные поражения матки (рак, гиперплазия эндометрия, полипы)
Различные поражения матки (рак, гиперплазия эндометрия, полипы)
Атрофия эндометри
я
У некоторых больных кровотечение возникает вследствие органного поражения: фибромиомы, полипа эндометрия или аденокарциномы. Самостоятельную большую группу составляют так называемые дисфункциональные маточные кровотечения, которые появляются при ановуляторном цикле, несоответствии лютеиновой фазы (недостаточности желтого тела), изменениях эндометрия под воздействием оральных контрацептивов, а также при изменениях в период менопаузы и после нее.
Ановуляторный цикл. Отсутствие овуляции (выхода зрелой яйцеклетки из фолликула яичника в брюшную полость) служит причиной большинства дисфункциональных маточных кровотечений. Такой цикл сопровождается избыточной и удлиненной эстрогенной стимуляцией без развития прогести- новой (гестагенной) фазы, следующей за овуляцией в норме. Реже отсутствие овуляции связано с эндокринными заболеваниями (болезни щитовидной железы, надпочечников, различ
ные опухоли гипофиза; с первичными поражениями яичников типа функционирующих гранулезо- или текаклеточных опухолей (см. ниже), а также поликистозом яичников; с генерализованными метаболическими расстройствами (ожирение, тяжелая недостаточность питания, хронические системные заболевания). Вместе с тем у большинства пациенток причина развития ановуляторного цикла остается неизвестной. Чаще всего такой цикл встречается у женщин в периоде менархе (при наступлении первой менструации) или перименопаузальном периоде (непосредственно перед возрастным прекращением менструаций и вскоре после этого). Различают три варианта ановуляторного цикла: совпадающий по продолжительности с овулятор- ным, укороченный и удлиненный с длительной персистенцией фолликулов. Отсутствие овуляции приводит к продолжительной и чрезмерной эстрогенной стимуляции эндометрия, под влиянием которой архитектоника слизистой оболочки матки меняется — появляется кистозное расширение желез. Встречается и несвоевременное отторжение стромы без признаков секреторной активности в эндометрии (ановуляторная менструация).
Недостаточность желтого тела. Недостаточная лютеиновая фаза и слабая выработка прогестерона сочетаются с нерегулярным овуляторным (двухфазным) циклом, имеющим неполноценную фазу секреции. Женщины нередко жалуются на бесплодие и либо патологические (обильные) кровотечения, либо, наоборот, аменорею. В соскобах обнаруживают секрети- рующий эндометрий, который, однако, по морфологической картине «запаздывает» по отношению к ожидаемому сроку.
Влияние оральных контрацептивов на эндометрий. Использование оральных противозачаточных средств, содержащих синтетические стероиды или производные естественных яичниковых стероидных гормонов, приводит к разнообразным изменениям в эндометрии, которые зависят от вида и дозы вводимого гормона. Наиболее частый вариант реакции эндометрия — это нарушение нормальных структурных соотношений между стромой и железами. Как правило, железы выглядят неактивными, а в строме встречаются крупные клетки с обильной цитоплазмой, напоминающие клетки децидуальной ткани при беременности. Если прием противозачаточных средств прекращают, то эндометрий возвращается к нормальному состоянию.
Изменения в менопаузе и постменопаузальном периоде. Поскольку менопауза характеризуется ановуляторным циклом, изменения архитектоники желез эндометрия могут быть преходящими, сопровождаться недостаточностью яичников и атрофией эндометрия. Если вслед за этим развивается атрофия яичников, то кистозное расширение желез сохраняется, а строма яичников и эпителий желез эндометрия атрофируются. В этом случае возникает так называемая кистозная атрофия эндометрия.
Рис.
21.8. Простая
(кистозная) гиперплазия эндометрия.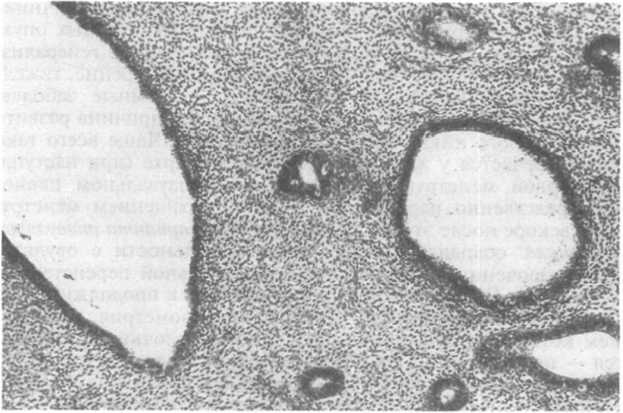
Г иперплазия (железистая или дисгормональная гиперплазия) эндометрия. Это еще одна нередкая причина патологических маточных кровотечений. Гиперплазия эндометрия отличается от типичных ановуляторных проявлений прежде всего степенью и объемом гистологических изменений эндометрия. Железистую гиперплазию эндометрия расценивают в настоящее время как факультативный предрак. Ее развитие связано с повышенной эстрогенной стимуляцией при сниженной активности прогестинов. Таким образом, гиперплазия эндометрия возникает чаще всего в связи с наступлением менопаузы у пожилых женщин или же устойчивой ановуляции у молодых. Кроме того, железистая гиперплазия развивается при таких заболеваниях, как поликистоз яичников, включая синдром Штейна—Левенталя (J.F.Stein, M.L.Leventhal; см. далее), функционирующая гранулезо клеточная опухоль яичника, избыточная кортикальная функция (кортикально-стромальная гиперплазия, стромальный гипертекоз; см. ниже), а также при продолжительном лечении эстрогенами. Морфологически различают гиперплазию эндометрия низкой и высокой степени.
Гиперплазия эндометрия низкой степени (с высокодифференцированными структурами) включает простую и сложную гиперплазию эндометрия. Для простой (кистозной, слабовыражен- ной) гиперплазии эндометрия характерны железы разных размеров и форм, часть из них имеет кистозное расширение (рис. 21.8). Выстилка этих желез соответствует пролиферативной фазе
Рис.
21.9. Железистая гиперплазия эндометрия.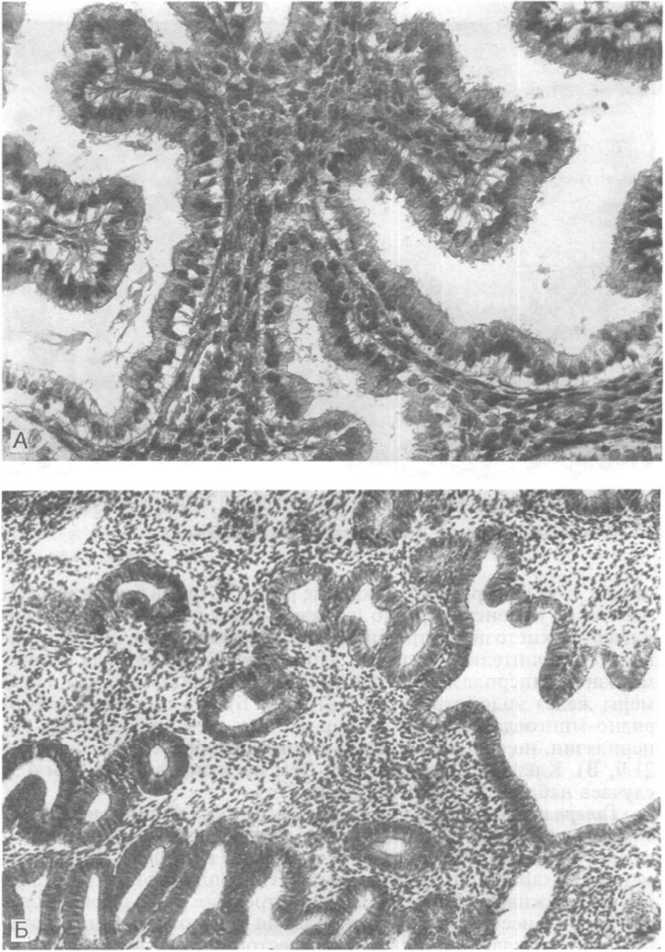
А — в многочисленных железистых структурах, содержащих сосочки, клетки эпителия имеют субнуклеарные вакуоли, характерные для ранней стадии секреторной фазы цикла; Б — «почкование желез эндометрия».
Рис.
21.9. Продолжение.
В
— деталь «почкующихся» желез (негативы
И.Б.Кулябко).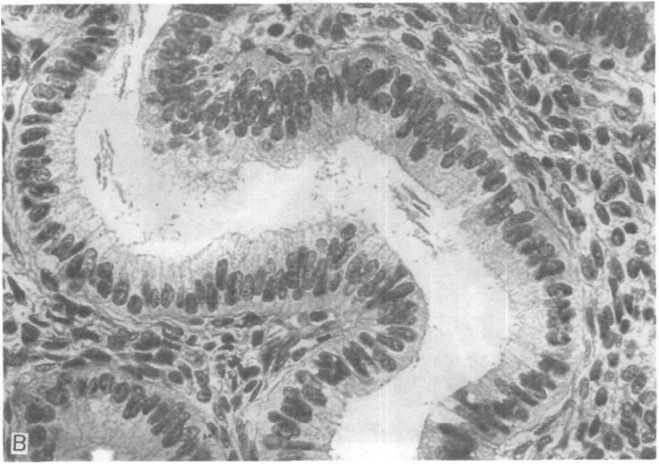
цикла, хотя фигуры митоза крайне редки. Строма богата клетками. Такие изменения редко прогрессируют в рак и чаще заканчиваются кистозной атрофией, при которой атрофичными становятся и эпителий, и строма. При сложной гиперплазии (аденоматозной гиперплазии без атипии) увеличены количество и размеры желез эндометрия (рис. 21.9, А, Б). Их выстилка много- рядно-многослойная, более выраженная, чем при простой гиперплазии, но сохранены ровные контуры просветов желез (рис. 21.9, В). Клеточной атипии нет. Тем не менее в более чем 4 % случаев наблюдается малигнизация.
Гиперплазия высокой степени (с более низкой гистологической дифференцировкой) еще называется атипической гиперплачией >н- !)п\и>трия или аденоматозной гиперплазией с атипией. Кроме изменений, характерных для сложной гиперплазии низкой степени, обнаруживают неправильные внутренние контуры выстилки желез. Сильнее развита стратификация (многослойность), которая сопровождается появлением фестончатого (зубчатого) силуэта выстилки (рис. 21.10, А, Б), а также сосочковыми выростами и клиньями эпителия. Выраженная атипия эпителиоцитов дополняется утратой полярного расположения клеток, гипе- рхроматозом некоторых ядер, более заметными ядрышками, увеличением ядерно-цитоплазматического соотношения. Встре-
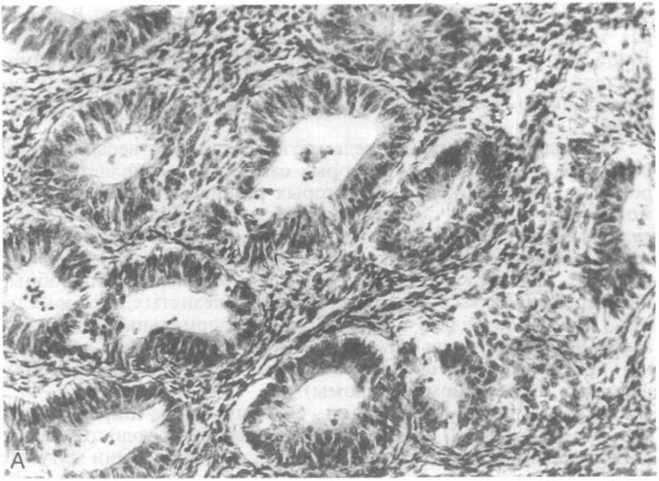
Рис.
21.10. Гиперплазия эндометрия высокой
степени. А
— начальная стадия; Б — финальная
стадия.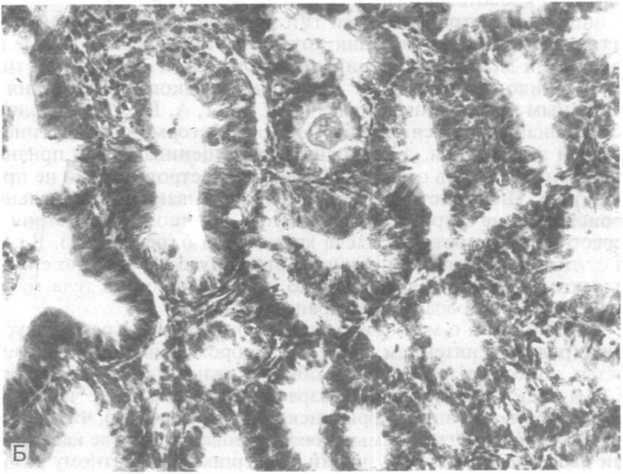
чаются очень крупные эпителиоциты, фигуры митоза. В соско- бах эндометрия нелегко отдифференцировать гиперплазию высокой степени от высокодифференцированной аденокарциномы тела матки. Примерно у 23—25 % больных, страдающих гиперплазией эндометрия высокой степени, развивается рак тела матки.
Опухоли тела матки. В теле матки возникают весьма разнообразные опухоли, среди которых самой частой является фибромиома. Источниками, из которых развиваются эти опухоли, могут быть железы эндометрия (образуются полипы и рак); строма эндометрия (участвует в формировании фибромиом, а также служит источником для стромальных сарком); мезодер- малъные остатки парамезонефральных протоков, способные дифференцироваться в направлении и железистых, и стромальных элементов (дают смешанные мезодермальные опухоли); гладкомышечная ткань миометрия (из нее возникают лейомио- мы, комбинирующиеся со стромальным компонентом в фибромиомы, а также лейомиосаркомы).
Полип эндометрия. Это опухоль на широком диаметром 0,5—3,0 см основании, вдающаяся в полость матки. Полипы бывают одиночными и множественными. Они могут не давать симптоматики, а в случае изъязвления или некроза приводить к кровотечениям. Различают два гистологических типа полипов эндометрия. Первый тип построен из функционирующего эндометрия, изменения которого развиваются параллельно фазам и даже стадиям цикла (см. рис. 21.11, В). Второй тип, как правило, построен из гиперпластического эндометрия с кистозным расширением желез (рис. 21.11, А, Б). Такие полипы могут обнаруживаться одновременно с дисгормональной гиперплазией эндометрия, а их появление расценивают как признак реактивного роста в ответ на воздействие эстрогенов, но не прогестерона. Цитогенетические данные указывают на клональное происхождение стромальных клеток полипов эндометрия с перестройкой короткого плеча хромосомы 6 (регион 21). В связи с этим возможно, что развитие этих опухолей связано с генетическими нарушениями. Однако в ткани полипов тела матки аденокарциномы возникают крайне редко.
Фибромиомы (лейомиомы, фиброиды). Кроме невусов кожи (родимых пятен, см. главу 15), фибромиомы матки — самые частые опухоли у женщин. Их обнаруживают по крайней мере у 25 % женщин половозрелого возраста. Отмечена более частая заболеваемость у женщин африканской расы. Известно, что фибромиомы — эстрогензависимые новообразования. После кастрации или наступления менопаузы они подвергаются обратному развитию и даже обызвествлению. Но возможен их быстрый рост во время беременности. Причина появления фибромиом неизвестна. Как и в полипах эндометрия, в этом случае, вероятно, имеют значение определенные хромосомные аберрации.
Рис.
21.11. Полип
эндометрия.
А
и Б — кистозно расширенные железы и
склерозированная строма опухоли.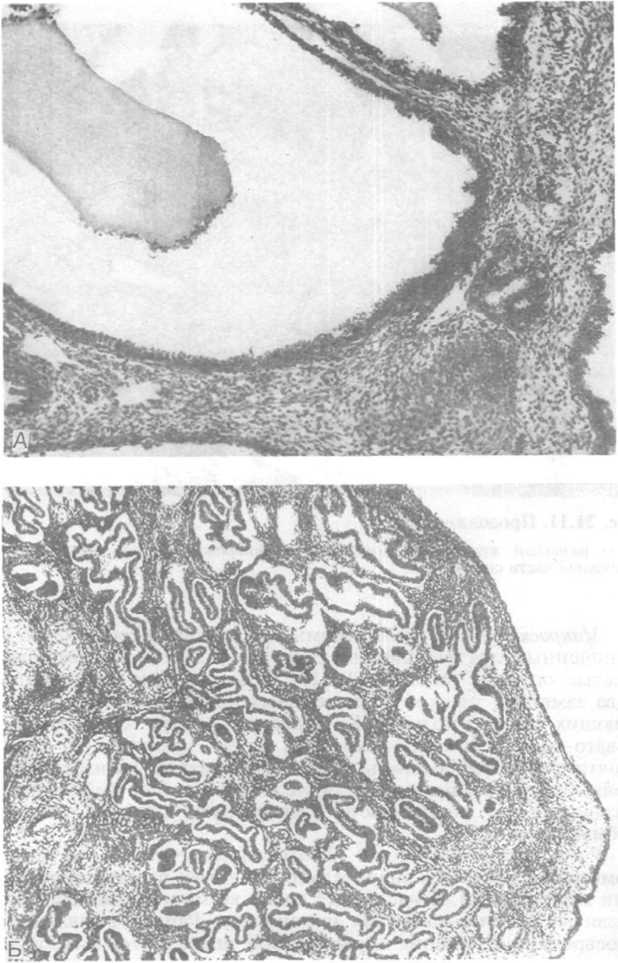
Рис.
21.11. Продолжение.
В
— развитый железистый компонент и
фиброваскулярная ножка полипа (в нижней
части снимка).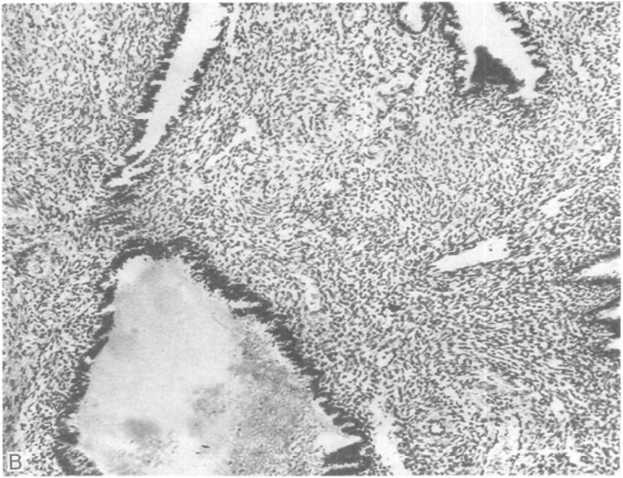
Макроскопически фибромиомы представляют собой четко ограниченные круглые плотные серовато-белые на разрезе волокнистые опухоли (рис. 21.12). По размерам они варьируют от едва заметных узелков до массивных новообразований, заполняющих тазовую полость. Крупные узлы могут содержать желтовато-коричневые или красные зоны размягчения ткани. Почти всегда фибромиомы растут в теле матки, но изредка они появляются в миометрии истмической зоны или шейки матки. Различают три формы роста: субсерозную, интрамуральную и субмукозную.
Рак эндометрия. Долгое время считали, что рак эндометрия встречается значительно реже рака влагалищной порции шейки матки. В настоящее время во многих промышленно развитых странах ситуация изменилась. Раннее выявление и своевременное лечение цервикальной интраэпителиальной не- оплазии (см. выше), с одной стороны, и увеличение заболеваемости раком тела матки, особенно у молодых женщин, — с другой, заметно сказались на статистических показателях. Например, в конце 90-х годов XX в. в США на 13 ООО ежегодно выявляемых инвазивных карцином шейки матки приходилось
Рис.
21.12. Множественная фибромиома матки.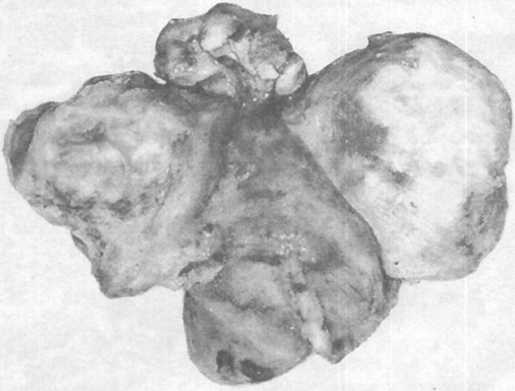
34 ООО наблюдений рака эндометрия (по Cotran R.S., Kumar V., Collins Т., 1998J. Рак эндометрия, как правило, возникает в постменопаузальном периоде и сопровождается патологическим маточным кровотечением. В числе состояний, предрасполагающих к возникновению такой карциномы, следует назвать гиперплазию эндометрия (см. выше), эстрогенсекретирующие опухоли яичника, заболевания, по поводу которых пациентка получает длительное лечение эстрогенами.
Макроскопически рак эндометрия характеризуется либо локализованным полипообразным постом, либо диффузным распространением по всей полости органа и поражением всего эндометрия. За пределы матки опухоль проникает путем прямой инвазии через миометрий и околоматочные ткани. Распространение в широкую связку матки делает опухоль пальпируемой при влагалищном исследовании (см. ниже о системе TNM).
Рак эндометрия метастазирует сначала в региональные лимфатический узлы (тазовой области), затем гематогенным путем в легкие, печень, кости и другие органы. Иногда трубное и(или) лимфогенное распространение сопровождается широким поверхностным поражением брюшины. Более 85 % раковых опухолей эндометрия представляют собой аденокарииномы. В высокодифференцированных аденокарциномах (1-й степени,
Рис.
21.13. Высокодифференцированная
аденокарцинома эндометрия.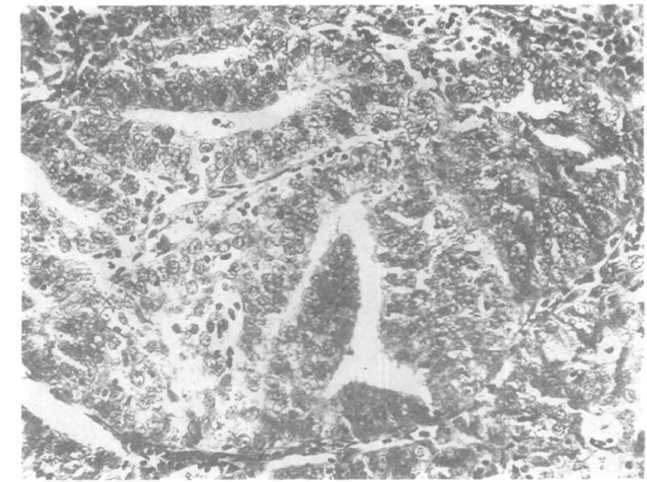
G1) хорошо видна железистая структура паренхимы опухоли (рис. 21.13). При умеренной гистологической дифференцировке (2-й степени, G2) оформленные раковые железы чередуются с солидными пластами паренхимы. Низкодифференцированный рак (3-й степени, G3) характеризуется преобладанием солидных эпителиальных пластов, в которых едва различимы железистые структуры, но максимально выражены ядерная атипия и митотическая активность. У 2—12 % больных в опухолевой паренхиме обнаруживают очажки с плоскоклеточной дифференциров- кой. Такие опухоли относят к железисто-плоскоклеточному раку или аденокарциномам с плоскоклеточной метаплазией. Встречаются также аденокарциномы сосочкового и светлоклеточного типов, которые также относят к 3-й степени (G3).
По системе TNM уровни распространения рака эндометрия обозначают следующим образом:
TIS — карцинома in situ;
Т|—Т2 — процесс не выходит за пределы матки;
Т3 — опухоль выходит за пределы матки, но растет в пре
делах полости малого таза;
Т4 —отмечается распространение раковой ткани в
стенку мочевого пузыря и(или) прямой кишки или за пределы малого таза.
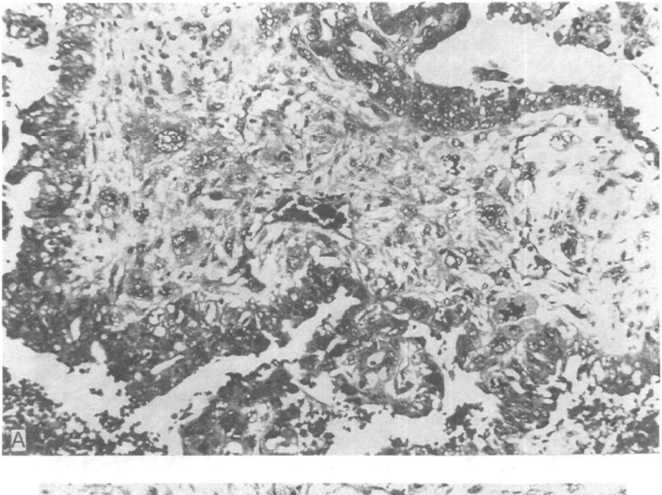
Рис.
21.14. Злокачественная
смешанная мезодермальная опухоль
матки.![]()
А — участок так называемой аденосаркомы (тип Мюллера); Б — участок, аналогичный по строению фибросаркоме (тип Мюллера)
Рис.
21.14. Продолжение.
В
— участки хрящевой ткани в составе
опухоли.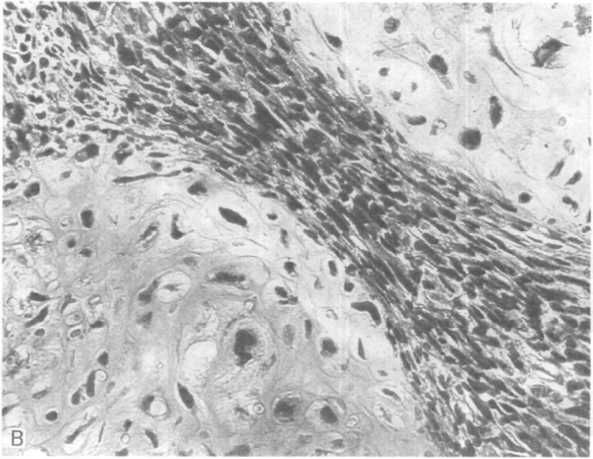
Региональными лимфатическими узлами являются те же коллекторы, что и для шейки матки (см. выше).
Смешанные и мезенхимальные опухоли. Частота саркомы матки в сумме едва ли достигает 5 % всех новообразований этого органа. Частота находок отдельных вариантов саркомы незначительно варьирует в разных регионах планеты. В порядке убывания частоты наблюдений остановимся на описании смешанных (мюллеровых) опухолей, стромальных сарком эндометрия и лейомиосарком.
Злокачественные смешанные мезодер- мальные (мюллеров ы) опухоли (МММТ). Они построены из ткани аденокарциномы эндометрия, в строме которой имеется злокачественная (мезенхимальная) опухолевая дифференцировка. Иными словами, у этих смешанных новообразований в одном и том же узле обнаруживаются структуры рака и саркомы (рис. 21.14, А). Поскольку стромальные опухолевые клетки в МММТ обладают эпителиальными маркерами, высказана гипотеза о едином источнике гистогенеза этих необычных новообразований. Различают два гистологических варианта МММТ: гомологичный (карциносаркома, аденосаркома), включающий в себя структуры аденокарциномы и саркомы, и гетерологичный — смешанная опухоль, в ткани которой,
+■
* * • ** 41% .3 ТГ-
-■***
V ^ '• »*af'■?**& * * V' ^
**-
.■■ *?,' *^v•v11■' *?'.
Рис. 21.15. Лейомиосаркома матки.
А — участок опухоли преимущественно веретеноклеточного строения; Б — выраженный клеточный полиморфизм.
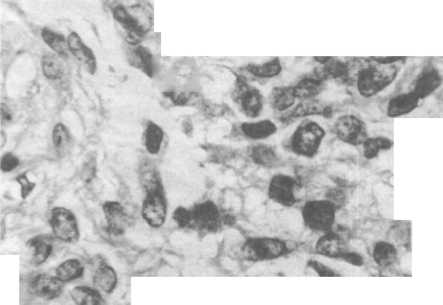
Рис.
21.16.
Стромальная
саркома матки (препарат IAP).
||r
^
p
• J
ж
^
*
Лейомиосаркомы. Эти опухоли возникают de novo (сразу как таковые) либо в миометрии, либо в строме эндометрия, претерпевающей перед этим гладкомышечную дифферен- цировку. Что касается возможности малигнизации предсущест- вующей фибромиомы (лейомиомы), то, по общему мнению, она практически исключена. Пик заболеваемости этой редкой опухолью приходится на 40—60 лет. Лейомиосаркома растет в виде либо экзофитного узла с быстро распространяющейся инфильтрацией, либо массивного полипообразного узла. Выраженная клеточная атипия и повышенная митотическая активность (до 10 фигур митоза в поле зрения при увеличении в 400 раз) позволяют отличить эту опухоль от фибромиомы (рис. 21.15, А, Б) Лейомиосаркома характеризуется поразительной тенденцией к рецидивированию после хирургического удаления. Более чем у 50 % больных появляются гематогенные метастазы в легкие, кости и головной мозг. Показатель 5-летней выживаемости достигает в среднем 40 %.
Эндометриальные стромальные опухоли. Они представлены: доброкачественными стромальными узелками, растущими в эндометрии и не имеющими железистых
структур; стромальными саркомами низкой степени злокачественности (высокодифференцированными), которые часто называют эндолимфатическим, стромальным миозом (из-за внедрения стромальных опухолевых элементов между мышечными волокнами миометрия и их пенетрации в лимфатические сосуды); эндометриальными, стромальными саркомами (злокачественными опухолями с выраженным клеточным полиморфизмом и активным метастазированием) (рис. 21.16).
