
- •Очистные агенты
- •В. И. Зварыгин
- •Часть 1 очистные агенты
- •Глава 1
- •Коллоидные растворы
- •.Структура воды
- •1.2 Структура коллоидных растворов
- •1.2 Прочность структуры.
- •1.2 Вязкость воды
- •1.3 Стабильность бурового раствора
- •1.4 Водоотдача
- •1.5 Показатель фильтрации. Приборы для определения показателя фильтрации
- •1.9. Плотность промывочной жидкости. Приборы для определения плотности
- •1.7 Содержание абразивных частиц в буровых растворах. Прибор.
- •Глава 2 глинистые растворы. Растворы Общие сведения
- •2.1. Структурообразователи.
- •2.2. Структурирование глинистых растворов
- •Структурирование промывочной жидкости за счет диспергирования тердой фазы.
- •2.3. Ингибирующие глинистые растворы.
- •2.4 Неингибирующие глинистые растворы.
- •2.5. Активация и дезактивация глинистых частиц.
- •2.6. Технические средства для приготовления глинистых растворов
- •Глава 3 полимеры и полимерные промывочные жидкости
- •3.1. Полимеры – структурообразователи
- •Состав древесины
- •3.2Свойства и функции полимеров
- •3.3 Модифицирующие полимерполисолевые растворы
- •3.3.2. Экспериментальные исследования.
- •3.4. Зарубежные реагенты для приготовления промывочных жидкостей Основная классификация реагентов компании “бдс”:
- •3.5 Дезактивация дисперсной фазы гидрофобными веществами (пав, полимерами, маслами)
- •3.6 Полимерные растворы
- •3.7 Технические средства для приготовления полимерных растворов
- •Общая схема выбора промывочной жидкости
- •Глава4 растворы электролитов
- •4.1Истинные растворы
- •Теплота растворения электролитов
- •4.2Растворимость и скорость растворения электролитов.
- •Растворимость электролитов
- •Скорость растворения электролитов.
- •4.3 Насыщенные и перенасыщенные растворы.
- •4.4 Кристаллизация растворов электролитов
- •Использование процесса кристализация электролитов при бурении скважин
- •4.5 Растворы с конденсированной твердой фазой
- •Глава 5 эмульсионные промывочные жидкости
- •5.1.1 Гидрофильные эмульсионные растворы
- •5.1.2 Эмульсионные жидкости-виброгасители
- •5.2. Гидрофобные эмульсии
- •Параметры, характеризующие качество эибр:
- •Параметры, характеризующие качество виэр:
- •Параметры, характеризующие устойчивость эмульсии, для тиэр:
- •5.3. Технические средства для приготовления эмульсионных промывочных жидкостей
- •Техническая характеристика установки уэм-5
- •Техническая характеристика установки уэм-5
- •Глава 6 газообразные агенты
- •6.1. Общие понятия. Область применения. Достоинства
- •6.2. Бурение скважин с продувкой сжатым воздухом
- •Оптимальные концентрации пенообразующих пав в зависимости от минерализации пластовой воды
- •6.3. Технические средства для охлаждения и осушения воздуха
- •Техническая характеристика блока осушки завода Курганхиммаш
- •Результаты производственных испытаний осушающе-охлаждающего агрегата
- •6.4 Технические средства для очистки воздуха от шлама.
- •Глава 7 газожидкостные смеси.
- •7.1 Общие сведения.
- •7.2. Параметры, характеризующие свойства гжс
- •7.3 Пенообразователи. Регулирование свойств гжс
- •7.4. Технические средства получения и нагнетания газожидкостных смесей
- •Заключение
- •Часть II. Стабилизация в неустойчивых стенок скважин. Задачами второй части исследований являются:
- •Глава8.Общие сведения о структуре горных пород.
- •8.1 Химические связи в минералах
- •8.2. Межмолекулярные связи в горных породах.
- •8.3 Поверхностная энергия горных пород.
- •8.4 Устойчивость стенок скважин.
- •Глава9. Промывочные жидкости для бурения уплотненных глинистых пород.
- •9.1. Класификация глинистых пород
- •Значения коэффициента для различной плотности глины
- •9.2. Осложнения при бурении уплотненных глинистых пород.
- •9.2.1. Механизм увлажнения и набухания глин.
- •9.2.2. Фильтрация воды в горные породы.
- •9.2.3. Разупрочнение уплотненных глин.
- •9.2.4. Диспергирование и размывание глин.
- •9.2.5. Влияние гидравлического давления на увлажнение глины.
- •9.2.6. Влияние горного давления на увлажнение глины.
- •9.3. Промывочные жидкости, применяемые для профилактики осложнений в уплотненных глинах
- •9.4. Основные направления выбора промывочной жидкости для бурения глинистых пород
- •9.5. Анализ эффективности применяющихся глинистых растворов для бурения уплотненных глин.
- •9.6. Анализ эффективности полимерных и полимерглинистых растворов.
- •9.7. Анализ эффективности ингибирующих растворов
- •Глава10. Промывочные жидкости для бурения неуплотненных глинистых пород.
- •10.1. Глинистые неуплотненные породы. Осложнения при их бурении.
- •10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
- •Зависимость пластической прочности образца глины от влажности к2
- •10.3. Влияние полимеров и полимерсолевых растворов на увлажнение и прочность неуплотненных глин.
- •10.4. Полимерполисолевые промывочные жидкости, для бурения неуплотненных глин .
- •11.2. Влияние технологических параметров бурения на раскрытие трещин и осложнение. Общие понятия.
- •11.3. Факторы, влияющие на осложнения горных пород.
- •11.4. Промывочные жидкости. Механизм их действия. Анализ эффективности.
- •Глава12. Промывочные жидкости для бурения трещиноватых горных пород.
- •12.1. Трещиноватые горные породы
- •12.2. Поглощение промывочной жидкости в трещиноватых породах
- •12.3. Мероприятия по предупреждению поглощения промывочных жидкостей
- •12.4. Анализ эффективности различных наполнителей для закупорки способность трещин
- •Закупоривающая способность глинистых паст
- •Определение закупоривающей способности вол
- •Закупоривающая способность вус
- •Зависимость объема тампонажной смеси от состава ее компонентов
- •Глава 13 промывочные жидкости для бурения соленосных отложений
- •13.1. Соленосные отложения. Осложнения.
- •13.2 Растворение и размывание соленосных отложений.
- •Скорость растворения галита в перемешиваемом малоглинистов растворе, м/с10-7 (емкость 10л)
- •Размывание хемогенных пород
- •Зависимость скорости и константы растворения соли от скорости потока
- •13.3 Пластические деформации хемогенных пород.
- •Промывочные жидкости, применяемые в России при бурении соленосных отложений
- •13.5 Лигниноглинистые растворы
- •Заключение
- •Библиографический список к первой части
- •Часть I.Очистные агенты
- •Глава 1 Коллоидные растворы……… ………. …………………………………..3
- •Глава3Полимеры и полимерные промывочные жидкости …………………50
- •Глава 4 Растворы электролитов.…………………………………………………77
13.2 Растворение и размывание соленосных отложений.
Растворение солей обусловлено гидрофильностью ионов, слагающих кристаллическую решетку.
Суммарную энергию гидрофильных ионов соли способных активно взаимодействовать с молекулами воды называют объемной электрической энергией. Объемная энергия, естественно, зависит от гидрофильности и количества ионов ( концетрации). Плотность объемной электрической энергии можно определи ть по осмотическому давлению раствора.
В контакте соли с водой происходит «выравнивание» объемной энергии соли и раствора. Происходит двойной массоперенос. Из горной породы в воду диффундируют ионы, а из воды в горную породу – молекулы воды. Происходит с одной стороны увлажнение и разупрочнение соли, с другой- насыщение раствора солью. Растворение соли будет происходить до полного насыщения раствора солью. В насыщенных растворах соль не растворяется. При взаимодействии ионов с молекулами воды образуются гидраты . Вода хороший диэлектрик (диэлектрическая проницаемость при температуре 200 С равна 81 %). Благодаря этому разноименные ионы друг с другом в насыщенном ростворе не взаимодействуют, поэтому в объеме образованного раствора ионы распределяются равномерно количество связанных молекул воды в гидрате зависит от активности (гидрофильности) ионов. При полном насыщении раствора солью или увеличении ее концетрации расстояние между гидратами снижается до расстояния межмолекулярного взаимодействия, образуются кристаллогидраты. Соль выпадает в осадок или адсорбируется на стенках скважин. Например, из насыщенного раствора MgCl2 образуются кристаллогидраты MgCl2*6H2O, из раствора CaCl2 – кристаллогидраты CaCl2*6H2O, CuSO4*5H2O и т.д.
При растворении соли тепловая энергия расходуется на отрыв ионов от кристалла. Эта энергия постоянно пополняется за счет тепловой энергии, выделяющейся в результате гидратирования ионов.
Если при гидратировании выделяется тепловой энергии больше, чем расходуется на отрыв инов наблюдается нагревание раствора. Таким образом теплота гидратации может характеризовать интенсивность взаимодействия молекул воды с ионами соли.
Критерии растворения служат два параметра скорость растворения и растворимость. Скорость растворения – это количество соли, перешедшей в раствор в единицу времени. Растворимость соли характеризуется максимальным количеством соли, способным растворяться в единице емкости воды, т.е. концетрацией насыщенного раствора соли в процентах.
Скорость растворения (растворяющую способность) соли определяют по формуле Фика (см.раздел 4.3

Таким образом в соответствие с формулой (1), скорость растворения соли зависит от вида соли имеющих различную скорость насыщения CH и концетрации соли в растворах. Откуда следует, что с увеличением концетрации соли в растворе скорость растворения понижается, а при СХ=СН снижается до нуля; при полном насыщении раствора солью ее растворение происходить не будет.
Для подтверждения этой зависимости были приведены экспериментальные исследования. Для этого использовались образцы различных солей (одновалентных NaCl т двухвалентных MgCl2), которые опускались в растворы различной концетрации соли. Скорость растворения определялась по формуле:

где mc – масса образца соли; ρ – плотность соли; S – поверхность образца.
Результаты замеров скорости растворения солей с одновалентными и двухвалентными катионами показали в табл. 1.
Таблица 13.3
Скорость растворения галита в растворах электролитов
NaCl и MgCl2, м/c10-7
Электролит |
Концентрация соли, % |
|||||
0 |
5 |
10 |
15 |
27 |
35 |
|
NaCl MgCl2 |
4,7 4,7 |
3,9 3,9 |
3,1 3,3 |
2,2 2,7 |
0,14 1,4 |
- 0,19 |
По
полученным данным построены графики
зависимости скорости растворения от
концетрации.(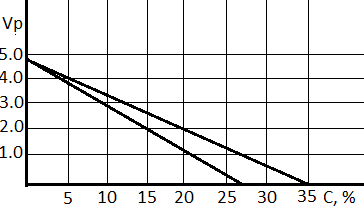 рис.
13.1) зависимость
скорости
растворения
в чистой
воде
от концетрации
соли
1-NaCl;
2-MgCl2
Результаты
исследований показывают, что действительно
скорость расстворения соли зависит от
концетрации соли и при полном насыщении
раствора солью растворение соли
прекращается.
рис.
13.1) зависимость
скорости
растворения
в чистой
воде
от концетрации
соли
1-NaCl;
2-MgCl2
Результаты
исследований показывают, что действительно
скорость расстворения соли зависит от
концетрации соли и при полном насыщении
раствора солью растворение соли
прекращается.
Ранее при бурения горных пород с промывкой глинистыми растворами отмечалось , что при бурении на стенках скважин образуется плотная глинистая корочка, предотвращающая насыщение горной породы водой, а полимеры способны на стенках скважин образовывать гидрофобную пленку, также предупреждающую насыщение горной породы водой.Для определения влияния твердой фазы и полимеров на влажность и скорость растворения соли были проведены экспериментальные исследования по расстворению галлита в глинистых растворах различной концетрации. Для опытов были использованы малоглинистые растворы из гидрофильной глины (черногорского глинопорошка, активированного кальцинированной содой) способных активно взаимодействовать с гидрофильной горной породой. (Промывка скважин в солевых отложениях глинистыми растворами большой концентрации не возможна вследствие их коагуляции) Скорость растворения соли определялась в неподвижном растворе и постоянном его перемешивании. Для определения скорости растворения соли в полимерных растворах использовались 1,5 % растворы КМЦ и 0,5 % растворы ПАА
Таблица 13.2
Скорость растворений галита в глинистом неподвижном растворе, м/с10-7
(емкость сосуда 0,5л)
-
Время растворения, с
Концентрация глины, %
3%
5%
7%
612
1188
1800
3600
540
7200
64800
72000
2,5
2,5
2,4
1,6
1,5
1,4
0,3
0,3
2,5
2,4
2,4
1,6
1,5
1,3
0,2
0,2
2,1
2,1
2,1
1,3
1,2
1,1
0,2
0,2
Таблица 13.3
