
- •Лекции по физхимии – Твёрдое состояние вещества; стр. 18 из 18
- •Твёрдое состояние вещества
- •Арагонит кальцит
- •Реальные кристаллы. 3, стр. 306÷311.
- •Цинвальдит kLiFeAl[AlSi3o10](oh, f)2
- •11 Кальцит (СаСо3) – известковый шпат. Химический состав, %: СаО 56.04, со2 43,96. Примеси в кальците – Mg, Fe, Mn (до 8%), Sr образуют с ним двойные соли.
Лекции по физхимии – Твёрдое состояние вещества; стр. 18 из 18
Твёрдое состояние вещества
Введение.
Из различных видов твёрдых веществ наиболее изученными являются вещества, находящиеся в кристаллическом состоянии1. Твёрдые вещества, не обладающие кристаллической структурой, являются аморфными2. Большей частью аморфные и кристаллические формы являются лишь различными состояниями одного и того же вещества. Таковы, например, кристаллический кварц и различные аморфные формы кремнезёма. Длительным выдерживанием при высокой температуре или другими путями часто возможно осуществить переход аморфной формы в кристаллическую (которая всегда является более устойчивой).
Наряду с этим, одно и то же вещество часто оказывается способным существовать в нескольких различных кристаллических формах, называемых также модификациями. Само явление это называется полиморфизмом3. Примером его могут служить алмаз и графит, являющиеся различными кристаллическими формами углерода, или кварц, тридимит и кристобалит – различные кристаллические формы кремнезёма.
От полиморфизма следует отличать аллотропию4 – явление, когда данный элемент способен существовать в виде различных простых веществ. Границы этих понятий не совпадают. Аллотропия относится и к различным кристаллическим модификациям элемента, совпадая в этом случае с полиморфизмом, и к различным по строению молекулам, различающимся по числу атомов в них (например, озон О3 и обычный кислород О2). С другой стороны, полиморфизм охватывает явления различия кристаллических форм не только простых веществ, но и химических соединений.
Полезно подчеркнуть, что свойства веществ в кристаллическом состоянии зависят не только от состава и условий существования, как в случае газов и жидкостей, но и от внутреннего строения. Так, хорошо известно, что хотя алмаз и графит совершенно одинаковы по составу, однако по своим свойствам они резко различны. Алмаз, например, обладает наибольшей твёрдостью по сравнению со всеми другими природными материалами (вспомним алмазное бурение); графит же, наоборот, очень мягок и применяется для смазки трущихся металлических поверхностей, изготовления карандашей и т.д.
Номенклатура различных модификаций ещё не унифицирована в должной степени. Многие из них, известные давно, носят различные названия, присвоенные им ранее, например, алмаз и графит, кварц, кристобалит и тридимит; в других случаях названия образуются от соответствующего названия кристаллической структуры – сера ромбическая и сера моноклинная. Модификациям же, которые были открыты позднее, уже не присваивали отдельных названий, а большей частью обозначали их первыми буквами греческого алфавита (α, β, γ, δ …) или римскими цифрами (, , …), причём применяются различные системы таких обозначений. По одной из них цифрой обозначают ту форму, которая устойчива при наиболее высокой температуре, т.е. которая образуется при кристаллизации из жидкого состояния. Обозначения же , , V … применяются последовательно к тем модификациям, в которые переходит форма при понижении температуры. Или же аналогично этому самая высокотемпературная модификация называется α-формой, а более низкотемпературные последовательно β-, γ-, δ-формами. По другой системе обозначений, применяемой главным образом в металлографии и минералогии, α-модификацией называется форма, устойчивая при комнатной температуре; β-, γ-, δ- … модификациями называются те, в которые переходит α-модификация при постепенном повышении температуры. В этой системе модификации, устойчивы при температурах ниже комнатной, обозначаются , , , V и т. д., начиная с той модификации, в которую переходит α-модификация при понижении температуры.
Характерными внешними признаками кристаллических веществ служат определённая и резко выраженная температура перехода их в жидкое состояние (температура плавления) и определённая геометрическая форма кристаллов того или иного вида. Температура плавления при постоянном давлении является характерной константой каждой кристаллической модификации чистого вещества. Однако не все модификации могут переходить непосредственно в жидкое состояние, и, кроме того, известно довольно много веществ, которые практически не удаётся нагреть до температуры плавления, например вследствие разложения их при более низких температурах.
Каждому данному веществу в кристаллическом состоянии, точнее – каждой данной его модификации, свойственна определённая форма кристаллов. Так, поваренная соль кристаллизуется нормально в форме кубов, слюда5 образует кристаллы с резко выраженным пластинчатым строением и т.д. Однако, как будет показано дальше, внешняя форма кристаллов может подвергаться иногда искажениям в процессе кристаллизации.
Основные сведения о кристаллическом состоянии веществ.
Указанные два внешних признака кристаллического состояния – резко выраженная температурная точка перехода в жидкое состояние и определённая внешняя геометрическая форма – не всегда применимы для характеристики кристаллической структуры. Более общим признаком может служить присущее кристаллам явление анизотропии, заключающееся в том, что некоторые свойства (например, теплопроводность) данного кристалла неодинаковы для разных направлений в нём; это явление называют иначе векториальностью свойств. Векториальность свойств кристаллов является их общим признаком. Она не свойственна ни газам, ни большинству жидкостей в обычных условиях.
В самом деле, когда мы рассматриваем какое-нибудь свойство газа или жидкости, у нас обычно не возникает необходимости определить, в каком направлении было или должно быть измерено это свойство. Теплопроводность или показатель преломления воды одинаковы во всех направлениях. Но в кристаллах многие свойства оказываются различными при измерении их в разных направлениях. К таким свойствам относятся, в частности, показатель преломления, теплопроводность, электропроводность, механическая прочность, скорость роста кристаллов, скорость растворения их и др. Известно, что слюда, например, легко разделяется на пластинки по плоскостям, параллельным её основной поверхности, но разделение её на части в направлениях, перпендикулярных или наклонных к этой поверхности, требует затраты значительно бóльших усилий.
Легко установить, что векториальность свойств кристаллов не обусловливается той или иной геометрической формой кристалла. Так, шар, выточенный из слюды, несмотря на полную симметричность его формы, сохраняет анизотропию, и наоборот, какой бы формы многогранник ни был отлит из обычного стекла, оно не приобретает от этого векториальности свойств. Как геометрическая форма, так и анизотропия кристаллов являются следствием особенности внутреннего строения кристаллов. Частицы, из которых состоит кристалл (молекулы, атомы или ионы), не беспорядочно, а закономерным образом расположены в пространстве. Упорядоченность расположения частиц была подтверждена экспериментально, когда после 1911 г. в результате разработки метода рентгеновского анализа, открылась возможность определять расстояния между частицами в кристаллах на основе опытных данных.
Длины волн рентгеновских лучей того же порядка, что и расстояние между атомами или ионами в кристаллах или молекулах (108 см). Благодаря этому при дифракции рентгеновских лучей от граней кристалла можно обнаружить особенности в расположении этих частиц в кристалле. Исследование этого явления даёт возможность, в частности, определить расстояние между частицами в кристаллах.
Близко к этому методу (рентгенографии) стоит метод дифракции электронов (электронография). Волновая механика показывает, что при действии пучка электронов на поверхность кристалла возникают те же дифракционные эффекты, что и при действии рентгеновских лучей. Определение структуры кристаллов и молекул методом дифракции электронов привело к результатам, полностью совпадающим с результатами, получаемыми с помощью рентгенографии. Впоследствии с этой же целью стали применяться и нейтроны (нейтронография), что дало возможность определять положение и водородного атома, чего не удавалось достигнуть методами рентгенографии и электронографии.
Использование описанных методов позволило исследовать внутреннюю структуру большого числа различных кристаллов и определить закономерности присущего им расположения частиц.
Идеальные кристаллы. Кристаллические решётки. 3, стр. 298÷303.
Кристаллы представляют собой симметричные фигуры. Форму кристаллов изучает геометрическая кристаллография. Симметричные фигуры обладают элементами симметрии. В кристаллах различают следующие элементы симметрии (рис. 1):
Центр симметрии – точка внутри кристалла, делящая пополам любую проходящую через неё прямую, проведенную до пересечения с границами кристалла (рис. 1а, точка С);
Плоскость симметрии – плоскость, делящая кристалл на две части, каждая из которых является зеркальным изображением другой (рис. 1б, плоскость АВ);
Ось симметрии – линия, при вращении вокруг которой на 360 кристалл совмещается сам с собой n раз (рис 1в, линия АВ, n = 4). Число совмещений кристалла n называют порядком оси симметрии. Различают оси второго, третьего и более высоких порядков. Оси первого порядка имеет любой кристалл вследствие того, что вращение на 360 вокруг любой линии приводит к совмещению.

Рис. 1. Фигуры, обладающие элементами симметрии:
а – фигура, имеющая центр симметрии С;
б – фигура, имеющая плоскость симметрии АВ;
в – фигура, имеющая ось симметрии АВ (n =4); [3, стр. 299].
В соответствии с геометрической формой кристаллов существуют следующие кристаллические системы, или сингонии: кубическая, гексагональная, тетрагональная, ромбическая, моноклинная и триклинная (рис. 2). Всего шесть систем, которые различаются характером расположения координатных осей и их длиной.
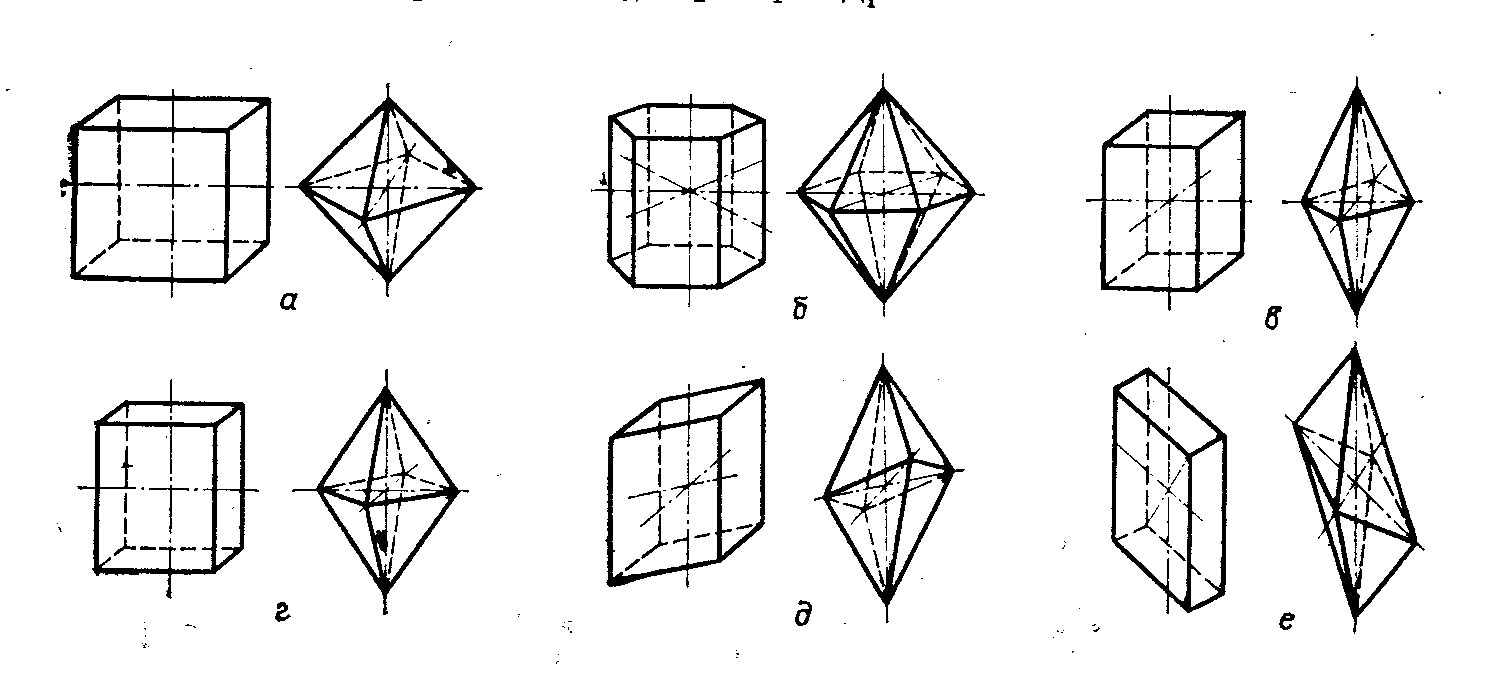
Рис. 2. Кристаллические системы: а – кубическая; б – гексагональная;
в – тетрагональная; г – ромбическая;
д – моноклинная; е – триклинная; [3, стр. 300].
В кубической системе все три оси имеют равную длину и пересекаются под углом 90. Основные формы кубической системы – куб и октаэдр (рис. 2а). В этой системе кристаллизуется ~ 8% всех изученных кристаллов, например, многие металлы, алмаз, NaCl, KCl, один из основных минералов портландцемента 3CaO·Al2O3 [5, стр. 187] и др.
В гексагональной системе две оси имеют равную длину и находятся в одной плоскости под углом 60, а третья располагается под углом в 90 и не равна им. Основные формы гексагональной системы – гексагональные призмы и бипирамида (рис. 2б). В этой системе кристаллизуется ~ 7% всех изученных кристаллов, например, многие химические элементы, H2O, SiO2, NaNO3, и др.
В тетрагональной системе все три оси пересекаются под углом 90. Две из них имеют равную длину, а третья не равна им. Основные формы тетрагональной системы – квадратная призма и бипирамида с квадратным основанием (рис. 2в). В этой системе кристаллизуется ~ 5% всех изученных кристаллов, например Sn, SnO2 и др.
В ромбической системе все три оси пересекаются под углом 90, но имеют различную длину. Основные формы ромбической системы – прямоугольная призма и бипирамида с прямоугольным основанием (рис. 2г). В этой системе кристаллизуется ~ 28% всех изученных кристаллов, например S, KNO3, K2SO4, один из основных минералов портландцемента 4CaO·Al2O3·Fe2O3 [5, стр. 23] и др.
В моноклинной системе две оси пересекаются под углом, отличающимся от 90, а третья ось располагается под углом в 90 к этим двум осям. Все три оси имеют различную длину. Основные формы моноклинной системы – призма (четырехугольная) и бипирамида (рис. 2д). В этой системе кристаллизуется ~ 42% всех изученных кристаллов, например, S, KClO3, Na2SO4 ∙ 10H2O и др.
В триклинной системе все три оси имеют различную длину и располагаются под разными углами, отличающимися от 90. Основные формы триклинной системы – призма и бипирамида (рис. 2е). В этой системе кристаллизуется ~ 10% всех изученных кристаллов, например K2Cr2O7, CuSO4 ∙ 5H2O, один из основных минералов портландцемента 3CaO·SiO2 [5, стр. 187] и др.
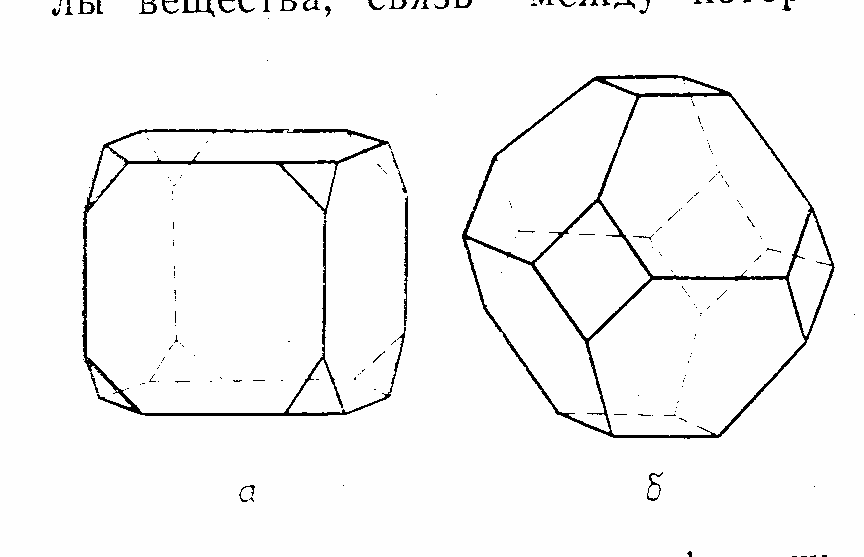 Из рис.
2 видно, в
различных системах кристаллов повторяются
основные геометрические формы – призмы
и бипирамиды. Однако для естественных
кристаллов характерны нее только
основные формы, но и комбинации этих
форм. Так, кристалл, изображённый на
рис. 3а,
является комбинацией куба и октаэдра,
а кристалл, изображённый на рис.
3б, –
комбинацией октаэдра и куба.
Из рис.
2 видно, в
различных системах кристаллов повторяются
основные геометрические формы – призмы
и бипирамиды. Однако для естественных
кристаллов характерны нее только
основные формы, но и комбинации этих
форм. Так, кристалл, изображённый на
рис. 3а,
является комбинацией куба и октаэдра,
а кристалл, изображённый на рис.
3б, –
комбинацией октаэдра и куба.
Кристаллические решётки образуются простыми веществами
Рис. 3. Комбинации основных форм кубической и химическими соединениями. В
системы: а – комбинация куба и октаэдра; зависимости от вида частиц,
б – комбинация октаэдра и куба [3, стр. 301]. образующих кристалл, существуют
решётки молекулярные (рис. 4), ионные (рис. 5,6), атомные (ковалентные) (рис. 7) и металлические (рис. 8).
Молекулярная решётка. В узлах решётки находятся молекулы вещества, связь между которыми осуществляется силами Ван-дер-Ваальса. Поэтому вещества, имеющие молекулярные решётки, обычно имеют низкие температуры плавления и кипения и большую летучесть (сера, йод, СО2)6.
Ионная
решётка.
В узлах решётки находятся ионы
п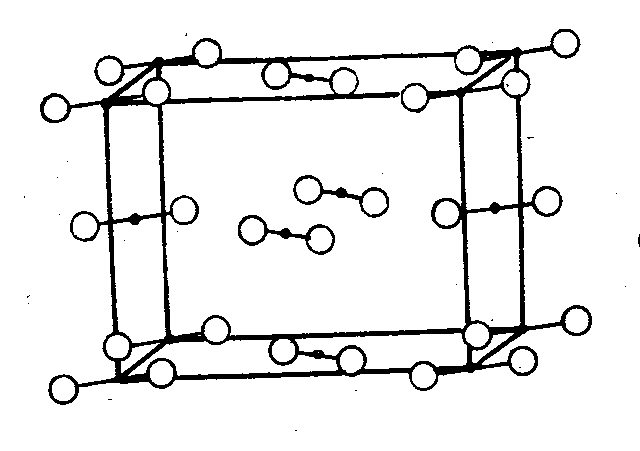 ротивоположных
зарядов. Связь электростатическая.
Кристаллы имеют относительно высокие
температуры плавления и кипения (CsCl,
NaCl)7.
ротивоположных
зарядов. Связь электростатическая.
Кристаллы имеют относительно высокие
температуры плавления и кипения (CsCl,
NaCl)7.
Атомная решётка. В узлах решётки расположены атомы элемента, образующего решётку, между которыми осуществляется ковалентная связь. Вещества имеют высокие температуры плавления, большую твёрдость и малолетучи (алмаз)8.
Рис. 4. Кристаллическая решётка йода [3, стр. 301].
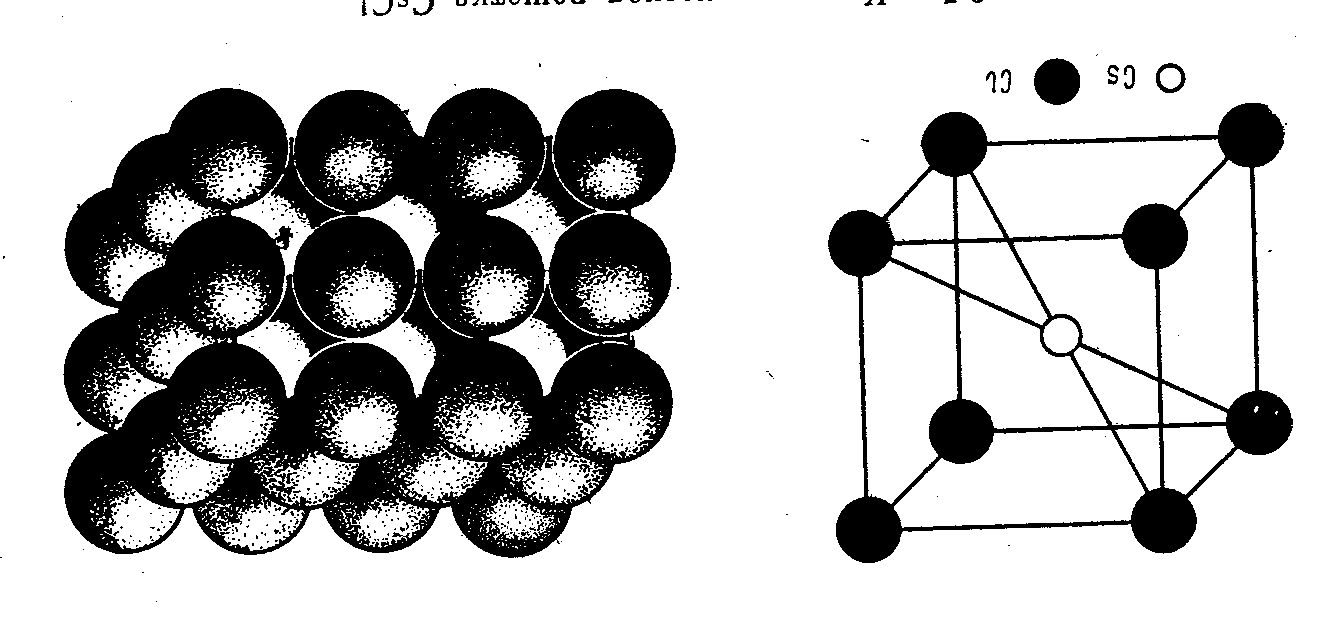
Рис. 5. Кристаллическая решётка CsCl [3, стр. 301].
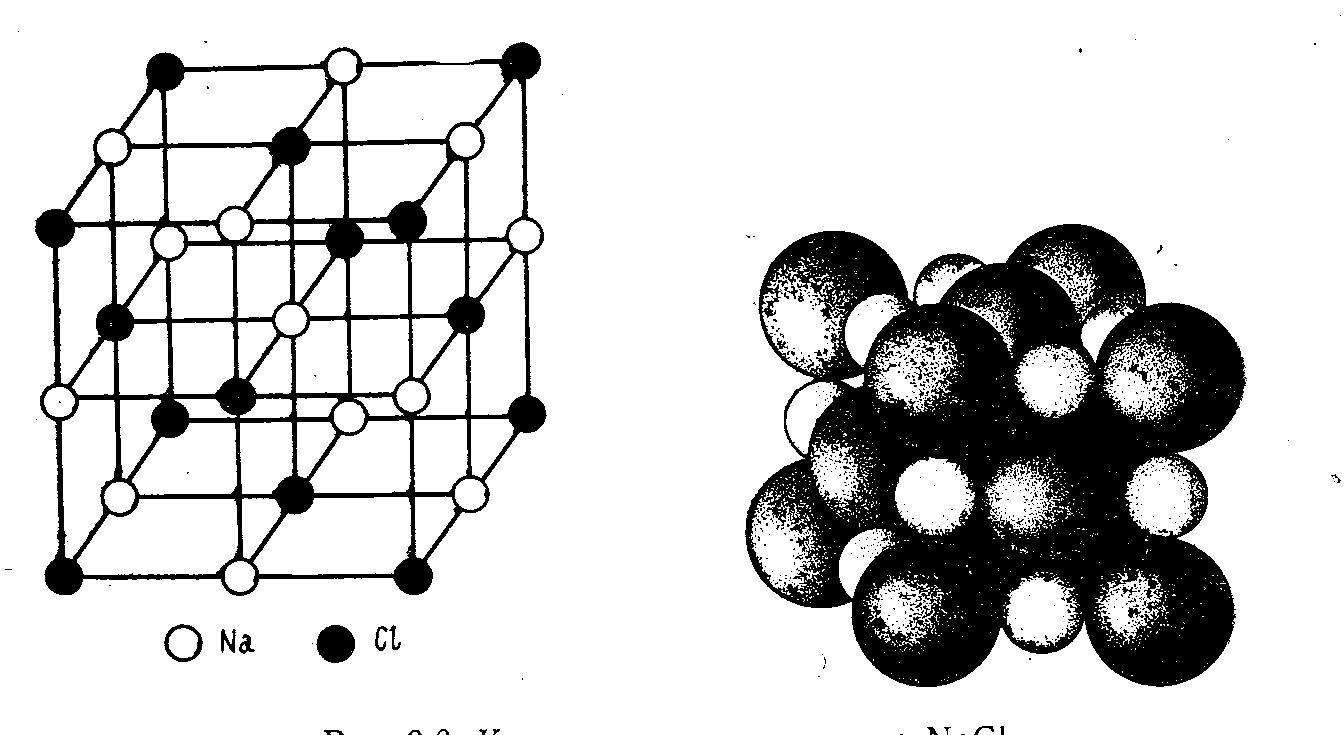
Рис. 6. Кристаллическая решётка NaCl [3, стр. 302].
Металлическая решётка. В узлах металлической решётки
находятся атомы и ионы металла, а в междоузлиях – свободные электроны, которые перемещаются по всему объёму кристалла и обусловливают характерные свойства металлов: пластичность, электропроводность, теплопроводность (Na, Cu, Mg).

Рис. 7. Кристаллическая решётка Рис. 8. Кристаллические решётки металлов:
алмаза [3, стр. 302]. а – Na; б – Cu; в – Mg; [3, стр. 302].
Изоморфизм и полиморфизм. [3, стр. 305÷306].
Твёрдые вещества, образующие кристаллические решётки одинакового типа, называют изоморфными, а явление существования различных веществ в виде кристаллов одинаковой формы – изоморфизмом. Изоморфные вещества обладают способностью совместно кристаллизоваться из растворов в виде кристаллов переменного состава, которые называют смешанными кристаллами или твёрдыми растворами замещения. В узлах решётки смешанного кристалла находятся частицы изоморфных веществ, например: KAl(SO4)2·12H2O и KCr(SO4)2·12H2O (квасцы9), MnCO3 и MgCO3 (карбонаты), NiC2O4 и ZnC2O4 (оксалаты). Совместная кристаллизация наступает в том случае, когда ионы, входящие в смешанный кристалл путём замещения друг друга, имеют близкие размеры и различие составляет ~ 15%.
Если вещество в зависимости от условий температуры и давления образует кристаллы различной формы, то такое явление называют полиморфизмом, а различные кристаллические структуры – полиморфными модификациями данного вещества. Например, сера образует две полиморфные модификации: ромбическую и моноклинную серу. Форма кристаллов зависит от различного расположения молекул в кристаллах серы. Переход одной полиморфной модификации в другую связан с изменением объёмов и энергий этих модификаций. Так, превращение низкотемпературной модификации в высокотемпературную происходит с увеличением энтальпии системы (поглощением теплоты). Между двумя полиморфными модификациями возможно обратимое превращение, которое получило название энантиотропного превращения и представляет собой обратимое превращение вещества при определённых температуре и давлении (95,6º и Р = 1 атм. для серы).
Если полиморфное превращение необратимо и при охлаждении модификации, полученной при нагревании, не образуется исходная модификация, то такое превращение называют монотропным. Например, СаСО3 образует две модификации: арагонит10 (ромбическая система) и кальцит11 (тригональная система):
![]()
