
- •IV. Основні питання лекції:
- •V. Рекомендована література:
- •VI. Основні питання, що розглядаються під час лекції:
- •I. Вступна частина.
- •1. Характеристика інтегральних мембранних білків: способи зв’язування з мембранами, характеристика секретаз, вплив ліпідного оточення.
- •Характеристика інтегральних білків мембрани.
- •Секретази.
- •Вплив ліпідного оточення.
- •2. Приклади бітопічних та політопічних білків мембран.
- •3. Характеристика периферичних мембранних білків.
- •4. Мембранні білки, ковалентно зв’язані з ліпідами.
- •5. Виділення,очищення та дослідження мембранних білків.
2. Приклади бітопічних та політопічних білків мембран.
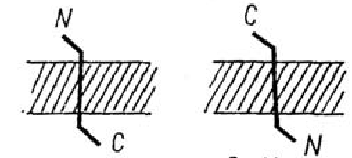
Деякі з трансмембранних білків пронизують мембрану один раз (глікофорін) - бітопічні, інші мають кілька ділянок (доменів), послідовно перетинають бішар - політопічні (рис. 3). Монотопічні білки відносяться до периферичних білків.
А
Б.
В.
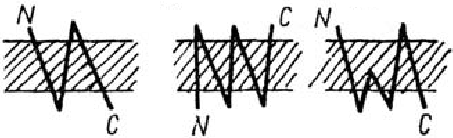
Рис. 3. Монотопічна (А), бітопічна (Б) і політопічна (В) локалізація білків в мембрані
Розглянемо бітопічний білок - глікофорин з мембрани еритроцитів. У його амінокислотній послідовності була виявлена коротка ділянка, що складається з 23 неполярних амінокислот, розташованих приблизно в середині ланцюга. Дослідження показали, що молекула глікофорину повністю пронизує мембану, причому занурена у мембрану гідрофобна ділянка має α-спіральну структуру.
При дослідженні внутрішньо молекулярної організації глікофорину було виявлено, що кінці молекули виступають по обох боках ліпідного бішару. Вуглеводи приєднуються на N-кінці гідрофобної частини молекули. Звідси зробили висновок, що N-кінець локалізований на зовнішній поверхні мембрани.
Найчастіше у мембранних білках зустрічаються N-зв’язані через аспарагін вуглеводні ланцюги. Глікофорин у цьому відношенні є виключенням: до його складу входять 15 О-зв’язаних через залишки серину і треоніну вуглеводні ланцюги і лише 1 N-зв’язаний. Вміст вуглеводної компоненти складає 6% від загальної маси білка.
Прикладом політопічних білків є транспортні АТФази, бактеріородопсин. Бактеріородопсин відкритий у 1978 році Остерхельтом і Стокеніусом. Первинна структура розшифрована у 1978 році Ю. Овчінніковим, а через рік – Кораною. Він виявлений у морській бактерії Halobakterium halobium. Бактеріородопсин присутній у спеціалізованих бляшках бактеріальної цитоплазматичної мембрани, яку називають пурпуровою мембраною. Мм 27000 Да. Білок складається з 248 амінокислотних залишків та містить ковалентно зв’язану простетичну групу ретиналь, яка за допомогою шифової основи приєднана до лізину -216.
Білок виконує функцію фотохімічного протонного насосу, який створює різницю електрохімічного потенціалу протонів, а він використовується клітиною для транспорту розчинних речовин і синтезу АТФ. Бактеріородопсин складається з тримерів, при чому кожний поліпептид являє собою утвір з 7 циліндрів, які пронизують мембрану і які майже перпендикулярні її площині. Вважають, що циліндри являють собою α-спіральні ділянки білкової молекули.
3. Характеристика периферичних мембранних білків.
Периферичними називають білки, які легко вимиваються з мембран розчинами солей або навіть дистильованою водою. Такі білки здатні зворотно зв'язуватися з бішаром і часто роблять човникові переміщення між мембраною і її оточенням. Периферичні білки відрізняються від інтегральних меншою глибиною проникнення в бішар і ступенем впливу на стан і рухливість вуглеводневих ланцюгів ліпідів.
Периферичні білки можуть зворотно змінювати свій статус, прикріплюючись до мембрані на певний час (такі білки називають амфіпатичними). Прикріплюючись до мембрани, вони взаємодіють або з інтегральними білками, або з поверхневими ділянками ліпідного бішару, набуваючи нових властивостей. Для амфіпатичних білків є спеціальні сигнали, які стимулюють їхню асоціацію з мембраною (часто таким сигналом є їх фосфорилювання специфічними кіназами, що змінює їх третинну структуру і гідрофобність, точніше - ліотропність). До таких білків, наприклад, відносять протеїн С, фактори згортання крові.
Білки, що утворюють комплекси з інтегральними білками (до них відноситься ряд травних ферментів, що беруть участь в гідролізі крохмалю та білків), прикріплюються до інтегральних білків мембран мікроворсинок кишечника. Прикладами таких комплексів можуть бути сахараза-ізомальтаза і мальтаза-глікоамілаза. Полярні або заряджені домени білкової молекули можуть взаємодіяти з полярними «головами» ліпідів, утворюючи іонні та водневі зв'язки.
Деякі з цих білків зв'язуються безпосередньо (або через посередника, зокрема, Са2+) із зарядженими групами ліпідів мембран за рахунок електростатичних взаємодій (мал. 4 a).
а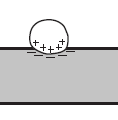 б
б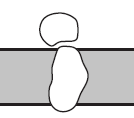
Рис. 4. Способи зв’язування периферичних мембранних білків: (а) електростатичні зв'язування з бішаром, (б) зв'язування з іншими «якірними» білками.
В якості прикладів можна привести мієліновий основний білок, спектрин, протеїнкіназу С, фосфоліпази. Слід зазначити перевагу зв'язування таких білків з мембранами певного ліпідного складу, так, наприклад, для фосфоліпази А2 критичним є присутність у мембрані фосфатидилхолінових ліпідів, а для протеїнкінази С - фосфатидилсеринових. В той же час ці білки можуть взаємодіяти з ближньою гідрофобною ділянкою бішару.
Існує також ряд білків, які адсорбуються на мембранних гліколіпідах і глікопротеїнах за допомогою вуглевод-білкових та / або білок-білкових взаємодії (рис. 4 б). Цей тип взаємодій реалізується, наприклад, при зв'язуванні F1-частини Н+-АТФази із зануреною в мембрану F0-частиною.
Слід відзначити, що важливість зв'язування з біомембранами виявлена не тільки для інтегральних білків, але і продемонстрована в ряді випадків для периферичних білків, наприклад, піруватоксидази - периферичного ферменту, що каталізує окиснення пірувату до оцтової кислоти і відновлення убіхінону. Зазначений фермент циркулює в організмі і зв'язується з плазматичною мембраной лише в присутності субстрату і кофактора; при цьому в молекулі білка формується С-кінцевий ліпідзв’язуючий домен.
Показано, що мутантна форма піруватоксидази, позбавлена кінцевих 24 амінокислотних залишків, повністю неактивна in vivo через нездатність зв'язуватися з мембраною.
Що стосується впиву ліпідного оточення на активність периферичних білків порівняно з інтегральними білками деякі модифікації ліпідного бішару, навпаки, призводять до їх активації. Наприклад, при додаванні до мембранної фракції іонів Са2+ або продуктів перекисного окиснення ліпідів спостерігається активація мітохондріальних фосфоліпаз. Вважають, що викликані цими добавками дефекти упаковки і структурні флуктуації ліпідів полегшують зв'язування периферичних білків з мембраною.
Найбільш вивченими периферичними білками є цитохром с, спектрин, анкірин. Показано, що цитохром с – розчинний білок з Мм 12 кДа, локалізований на зовнішній поверхні внутрішньої мітохондріальної мембрани, має глобулярну форму і взаємодіє головно з поверхнею ліпідного бішару. Для зв’язування цього білка з мембраною достатньо, щоб в них містилося всього 10% негативно заряджених ліпідів. Цитохром с досить легко вивільняється при обробці мітохондрій зростаючими концентраціями солей.
Типовим представником периферичних мембранних білків є також спектри, розташований на цитоплазматичному боці мембрани еритроцитів. Разом з іншими периферичними білками спектри утворює цитоскелет, який забезпечує збереження форми еритроцитів ссавців, а також надає плазматичній мембрані значну гнучкість, яка дозволяє цим клітинам легко проходити через капіляри з діаметром меншим ніж їх власний.
До периферичних білків мембрани еритроцитів, що входять до складу цитоскелету, відносять також анкірин. Цей білок зв’язується не лише із спектрином, але й з одним з основних інтегральних білків мембрани еритроцитів – смугою 3. Отже, анкірин бере участь у зєднанні мембрани з розташованим під нею цитоскелетом.
