
- •IV. Основні питання лекції:
- •V. Рекомендована література:
- •VI. Основні питання, що розглядаються під час лекції:
- •I. Вступна частина.
- •1. Характеристика інтегральних мембранних білків: способи зв’язування з мембранами, характеристика секретаз, вплив ліпідного оточення.
- •Характеристика інтегральних білків мембрани.
- •Секретази.
- •Вплив ліпідного оточення.
- •2. Приклади бітопічних та політопічних білків мембран.
- •3. Характеристика периферичних мембранних білків.
- •4. Мембранні білки, ковалентно зв’язані з ліпідами.
- •5. Виділення,очищення та дослідження мембранних білків.
Секретази.
Ферменти, відповідальні за відщеплення пептидного якоря цих білків, називають секретазами, конвертазами або шедазами. Більшість з них є мембранними металопротеїназами і характеризуються широкою протеолітичною специфічністю (табл. 3).
Таблиця 3.
Властивості секретаз мембранних білків
Субстрат |
Клас протеїнази |
Місце розщеплення |
Відстань від мембани, число а.о. |
Попередник амілоїдного білка α-секретаза β-секретаза λ-секретаза |
Метоло- Серинова Цистеїн-серинова |
VHHOK↓LVFF SEVKM↓DAEF VGGVV↓IATVI |
12 28 В межах мембрани |
АПФ людини |
Метоло- |
NSAR↓SEGP |
24 |
Фактор некрозу пухлин (TNG-α) |
Метоло-
|
PLAQA↓VRSSS |
20 |
L-селектин |
Метоло- |
QKLDK↓SFSM |
11 |
Fas-ліганд |
Метоло- |
- |
|
Рецептор фактора некрозу пухлин |
Метоло-
|
PQIEN↓VKGTE |
10 |
Білок CD30 |
Метоло- |
- |
|
Фолат-рецептор |
Метоло- |
EEVA↓R↓F↓YA |
11 |
Рецептор IL-6R |
Метоло- |
LPVQ↓DSSS |
9 |
Перетворюючий фактор росту (TGF- α) |
Серинова
|
ADLLA↓VVAA |
9 |
Kit-ліганд |
Серинова |
PPVAA↓A↓SSL |
24-25 |
Так, наприклад, у випадку АПФ, що належить до мембранних білків I-типу і має якір з С-кінця поліпептидного ланцюга, злущування відбувається під дією специфічної металозалежної секретази.
У той же час існують і серинові секретази (еластазоподібні), які відщеплюють якір мембранних білків в межах певної послідовності, що складається з невеликих неполярних амінокислотних залишків. Білки, що володіють GPI-якорем, секретуються з клітинної поверхні при дії фосфоліпаз C або D.
Таким чином, багато білків можуть бути присутнім в організмі тварин, як в мембранозв'язаній, так і в розчинній циркулюючій формах. Вважають, що властивий для цих білків баланс форм необхідний для їх нормального функціонування. Підвищення секретазної активності призводить до порушення цього балансу і спостерігається при патологічних станах: набряку легенів, кахексії, артриті, сепсисі, аутоімунних захворюваннях, нейродегенерації, онкогенезі та ін. Важливість функцій різних секретаз наочно ілюструє приклад утворення βА4-пептиду, що є основною причиною хвороби Альцгеймера. Цей пептид утворюється в процесі розщеплення мембранозв'язаного попередника амілоїдного білка двома β- і γ-секретазами (рис. 2), при цьому дія інших секретаз (в особливості α-секретази) попереджає розвиток цього захворювання.
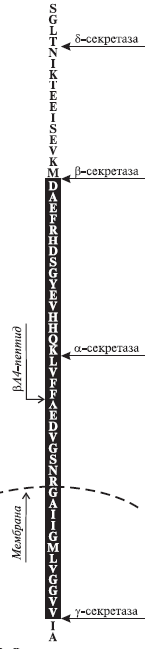
Рис. 2. Утворення βА4-пептиду
Біологічна значущість процесу злущування мембранних білків в значній мірі може бути обумовлена різними властивостями їх розчинних і мембранозв’язаних форм in vivo. Перш за все ці відмінності можуть бути викликані особливостями функціонування мембранозв'язаних білків
Біологічне значення мембранної організації ферментів. Експерементальні докази.
Вивчення ролі мембранної організації білків безпосередньо в живому організмі утруднено через складну організацію живої матерії і одночасного протікання безліч взаємозалежних процесів. Однак, можливість проведення мутації генів, яка забезпечує вибіркові зміни в структурі експресованих білків, наприклад, експресію тільки розчинних форм білків, що дозволяють в деяких випадках показати важливість функціонування саме мембранозв'язаних білків. Розглянемо це на прикладі Kit-ліганда - одного з мембранозв'язаних факторів росту ссавців. Для мутантної форми цього інтегрального глікопротеїну I типу, що не містить трансмембранного і цитоплазматичного доменів, була продемонстрована нормальна експресія in vivo та біологічна активність при дослідженні злиття клітин, аналогічна активності секретованої форми нативного білка. Однак у миші, що має ген такого білка, виявлялися всі симптоми тварини, які взагалі позбавленого гена Kit-ліганда - макроцитарна анемія, безпліддя, білий окрас.
Як інший приклад можна привести мембранний фактор Boss, який є незвичайним інтегральним білком I типу. Якір цього білка семикратно перетинає мембрану. Мутації, які забезпечували повне або навіть часткове (із збереженням трьох трансмембранних ділянок) видалення якоря, призводили до повної втрати біологічної активності цього білка в організмі. Такі дослідження проводилися для мембранної форми АПФ. Тварини з дефектним білком мали низький тиск, неконтрольоване сечовипускання, безпліддя, різні судинні дисфункції, порушення структури і функції нирок.
Таким чином, біологічна роль різних мембранних ферментів може в значній мірі визначатися їх здатністю до зв'язування з мембраною. По-перше, зв'язування з біомембраною забезпечує локалізацію (концентрування) ферментів в певній частині клітини і / або в тій області мембрани, де концентрується субстрат. Наприклад, ацетилхолінестераза фіксується в постсинаптичній мембрані, де велика концентрація ацетилхоліну. По-друге, адсорбція ферментів на мембрані створює можливість для сполучення процесів каталізу і трансмембранного переносу. Так, при функціонуванні мембранозв'язаних ферментів, які беруть участь в гідролізі крохмалю і білків, поблизу клітинної мембрани створюється локально висока концентрація розчинних молекул продукту, що сприяє їх ефективному поглинанню клітиною. По-третє, для багатьох ферментів при зв'язуванні з мембраною забезпечується доступність водонерозчинних субстратів. Це можуть бути інтегральні ферменти, що забезпечують процесинг мембранних білків (наприклад, секретази мембранних білків, див. вище), а також периферичні ферменти: фосфоліпази, протеїнкіназа С, піруватоксидаза та ін. Нарешті, при зв'язуванні формується оптимальне мікрооточення, яке забезпечує нативну конформацію і каталітичну активність мембранних ферментів.
