
- •IV. Основні питання лекції:
- •V. Рекомендована література:
- •VI. Основні питання, що розглядаються під час лекції:
- •I. Вступна частина.
- •1. Характеристика інтегральних мембранних білків: способи зв’язування з мембранами, характеристика секретаз, вплив ліпідного оточення.
- •Характеристика інтегральних білків мембрани.
- •Секретази.
- •Вплив ліпідного оточення.
- •2. Приклади бітопічних та політопічних білків мембран.
- •3. Характеристика периферичних мембранних білків.
- •4. Мембранні білки, ковалентно зв’язані з ліпідами.
- •5. Виділення,очищення та дослідження мембранних білків.
Характеристика інтегральних білків мембрани.
Перша група мембранних білків - інтегральні, які зв’язані з мембраною за рахунок більш міцних гідрофобних взаємодій.
Інтегральні білки можна витягти з мембрани тільки при руйнуванні ліпідного бішару детергентами або органічними розчинниками. Такі білки можна поділити на внутрішні трансмембранні і зовнішні, мають гідрофобний якір.
Інтегральні мембранні білки є глобулярними, амфіфільними макромолекулами. Вони взаємодіють як з гідрофобними, так і гідрофільними ділянками біомембрани. Білки утворюють міцні зв’язки з мембранними ліпідами за рахунок наявності фрагментів з гідрофобними бічними групами.
Перші успіхи у вивченні мембранних білків були досягнуті, коли навчилися користуватися детергентами для виділення мембранних білків у функціонально активній формі. Значним кроком було осмислення того факту, що мембранні білки мають не виключно β-складчасту структуру, як це передбачалося у модель Девсона-Даніелі. Виявилося, що мембрани містять багато α-спіралей.
В основі сучасних уявлень про структуру мембранних білків лежить ідея про те, що їх поліпептидний ланцюг укладений так, щоб утворилася неполярна, гідрофобна поверхня, яка контактує з неполярною частиною біліпідного шару.
Для інтегральних мембранних білків характерний високий вміст α-спіральних ділянок, а також ділянок з конфігурацією статичного клубка. Тому глобулярні білки переважно представлені глобулярними, а не плоскими витягнутими структурами. Наскільки білок занурюється у бішар визначається амінокислотною послідовністю та третинною структурою.
Основна функціонально важлива частина молекули внутрішнього трансмембранного білка при вбудовуванні практично повністю занурюється в мембрану. Трансмембранні білки відрізняються числом поліпептидних ділянок, що перетинають бішар, і можуть містити один (бітопічні), як, наприклад, у випадку глікофорину, або кілька (політопічні) таких ділянок, що характерно для ATФаз, бактеріородопсину, родопсину та ін. Ці ділянки, як правило, повністю побудовані з гідрофобних амінокислот (Які є гідрофобні амінокислоти?) і часто мають α-спіральну конфігурацію.
Способи зв’язування з мембранами.
Багато інтегральних білків тваринного походження зв'язуються з плазматичними мембранами клітин за рахунок гідрофобного якоря, при цьому велика частина молекули глікозильована і локалізується із зовнішнього боку мембрани.
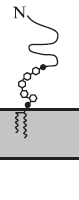
Деякі з цих білків кріпляться до мембрани за допомогою ковалентно зв'язаного глікозилфосфатидилінозитольного (GPI) якоря (рис. 1 а).
а б в
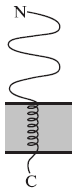
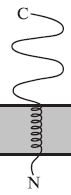
Рис. 1. Класифікація інтегральних мембранних білків за типом зв'язування з мембраною: (а) в ролі гідрофобного якоря виступає фосфатидилінозитольний гліколіпід (GPI); (б) I тип - білок володіє С-кінцевим пептидним якорем; (в) II тип - білок містить N-кінцевий якір.
Подібний спосіб зв'язування реалізується в разі лужної фосфатази, 5 '-нуклеотидази, ацетилхолінестерази та ін. Інші білки взаємодіють з мембраною за рахунок трансмембраного пептидного якоря - послідовності гідрофобних амінокислот, розташованої поблизу N- або С-кінця молекули білка. Мембранні білки I типу (рис. 1 б) синтезуються з N-термінальним сигнальним пептидом, який відщеплюється в процесі біосинтезу, і С-кінцевим якорем.
У разі білків II типу N-сигнал в процесі біосинтезу не відділяється і виконує роль трансмембранного якоря (рис. 1 в).
Відзначимо, що для багатьох білків, вбудованих в мембрану за допомогою якоря, характерно «відлущування» (shedding) з клітинної поверхні, при якому вони виділяються в розчиному вигляді у позаклітинне оточення, а якір залишається в мембрані.
Утворення розчинних форм відбувається в результаті ферментативного гідролізу доступної примембранної ділянки білка-субстрату і описано для різноманітних по структурі і функціях інтегральних білків I і II типів (табл. 2).
Таблиця 2.
Інтегральні мембранні білки з пептидним якорем здатні переходити при протеолізі в секреторну форму
Група |
Назва |
Типологія |
Ферменти |
АПФ Сиацилтрансфераза |
І тип ІІ тип |
Ліганди рецепторів |
Перетворюючий фактор росту (TGF-α) Фактор некрозу пухлин (TNG-α) Kit-ліганд Фактор росту CSF-1 |
І тип ІІ тип І тип І тип |
Молекули клітинної адгезії |
L-селектин Протеоглікан NG-2 |
І тип І тип |
Рецептори |
Трансфериновий рецептор Фолат-рецептор Рецептор фактора росту нервів Рецептор перетворюючого фактора росту |
ІІ тип І тип І тип І тип |
Вірусні білки |
Глікопротеїн віруса везикулярного стоматиту |
І тип |
Інші білки |
Попередник амілоїдного білка (АРР) Глікопротеїн Ib |
І тип І тип |
