
- •Теория химических процессов основного органического и нефтехимическогосинтеза
- •Глава I 28
- •Глава II 64
- •Предисловие
- •Безразмерные характеристики материального баланса реакции. Парциальные молярные балансы
- •Глава I равновесие органических реакций
- •Расчет констант равновесия газофазных реакций по термодинамическим данным
- •Приближенные методы расчета констант равновесия
- •Константы равновесия жидкофазных реакций
Приближенные методы расчета констант равновесия
Для расчета термодинамических характеристик химических реакций по способам, изложенным в предыдущем разделе, нужно знать ряд величин, определяемых экспериментально. В некоторых случаях одно (или несколько) из необходимых исходных данных в литературе отсутствует; в этом случае приходится прибегать к менее точным методам расчета ∆G0 и Кр. Наибольшее распространение при практических расчетах находит так называемый метод структурных групп, который позволяет приближенно рассчитывать термодинамические данные.
Для органических веществ многих типов стандартные теплота образования ∆H0ƒ,298 и энтропия S0298, а также коэффициенты а, b и с в уравнении теплоемкости можно подсчитать по правилу аддитивности, учитывая число атомов углерода в молекуле, характер связей и тип функциональных групп. Исходными данными для таких расчетов служат термодинамические функции девяти «основных» веществ, представленные в табл. 3.
Таблица 3. Термодинамические функции «основных» веществ для расчета по методу структурных групп
«Основное» вещество |
∆H0ƒ,298 кДж/моль |
S0298 Дж/(мольК) |
a |
b∙103 |
c∙103 |
Метан |
-74,90 |
186,3 |
15,9 |
69,6 |
-13,56 |
Циклогексан |
-123,22 |
298,4 |
-48,3 |
584,7 |
-103,5 |
Бензол |
82,98 |
269,4 |
-17,6 |
382,3 |
-217,8 |
Нафталин |
148,21 |
337,9 |
13,2 |
458,0 |
-145,7 |
Метиламин |
-29,73 |
241,6 |
16,8 |
128,6 |
-36,4 |
Диметиламин |
-32,66 |
273,0 |
16,4 |
202,2 |
-59,0 |
Триметиламин |
-45,64 |
288,9 |
16,5 |
275,7 |
-81,6 |
Диметиловый эфир |
-192,59 |
265,4 |
26,9 |
166,0 |
-47,9 |
Формамид |
-207,25 |
249,1 |
27,3 |
105,4 |
-31,3 |
Молекула соединения, для которого проводится расчет, должна быть построена исходя из соответствующего «основного» вещества, причем в первую очередь путем постепенного замещения атомов водорода метильными группами строится углеродный скелет. Введение в молекулу функциональных групп (если оно необходимо) проводится путем замены не водорода, а заранее введенной метильной группы. При этом функциональная группа замещает столько метильных, какова кратность ее связи с атомом углерода; например, для введения одной карбонильной группы нужно заместить сразу две метильные группы. Это обстоятельство следует учитывать при построении углеродного скелета молекулы.
В ходе построения углеродного скелета молекулы вещества, для которого проводится расчет, каждое замещение водорода метильной группой, как и введение функциональной группы, приводит к изменению величин ∆Н°ƒ,298, S°298, а, в и с на некоторые поправки. Величина поправки зависит от типа замещения и природы функциональной группы. Первое замещение водорода в молекуле «основного» вещества называется первичным; таким же считается и расширение кольца в молекуле циклогексана. Для бензола и нафталина все последовательные замещения в ядре — первичные, однако поправки зависят от относительного расположения заместителей (табл. 4). Все остальные замещения водорода называются вторичными; для них величина поправки зависит от структуры молекулы, в которой проводится замещение (табл. 5). Структурные особенности молекулы определяются ее строением, причем учитывают тип атома, у которого происходит замещение (тип А), и тип соседнего, наиболее замещенного атома углерода (тип В). Типы А и В обозначают цифрами от 1 до 4, соответствующими степени замещенности данного атома — первичного, вторичного, третичного или четвертичного. Тип атома, находящегося в ароматическом кольце, обозначают цифрой 5. В соответствии с этим, например, поправки к теплотам образования при переходе от пропана к изобутану (А = 2, В = 1) и от этилбензола к изопропилбензолу (А = 2, В = 5) неодинаковы и составляют соответственно -26,42 и -25,87 кДж/моль.
Таблица 4. Поправки на первичное замещение H на СH3
«Основная» группа |
∆H0ƒ,298 кДж/моль |
S0298 Дж/(мольК) |
a |
b∙103 |
c∙103 |
Метан |
-10,47 |
43,33 |
-8,37 |
97,1 |
-38,2 |
Циклогексан |
|||||
поправка на расширение кольца на 1 атом С |
-45,93 |
5,36 |
-10,51 |
127,2 |
-49,4 |
первое замещение |
-31,65 |
45,13 |
8,92 |
78,1 |
-23,9 |
Бензол |
|||||
первое замещение |
-32,95 |
50,58 |
3,27 |
69,8 |
-22,7 |
второе замещение |
|||||
1,2- |
-31,02 |
33,03 |
17,88 |
40,7 |
-7,8 |
1,3- |
-32,78 |
37,97 |
3,22 |
73,1 |
-25,7 |
1,4- |
-32,07 |
32,70 |
7,37 |
56,3 |
-14,3 |
Нафталин (первое замещение) |
-18,84 |
50,24 |
1,51 |
72,1 |
-24,6 |
Метиламин |
-23,86 |
̶ |
-0,42 |
73,4 |
-22,4 |
Диметиламин |
-26,38 |
̶ |
-0,42 |
73,4 |
-22,4 |
Триметиламин |
-17,17 |
̶ |
-0,42 |
73,4 |
-22,4 |
Формамид (замещение у атома С ) |
-37,68 |
̶ |
25,58 |
-7,3 |
19,9 |
Наличие в молекуле искомого вещества кратных связей тоже учитывают при расчете путем введения соответствующих поправок; в этом случае поправки определяются типами А и В двух атомов, между которыми возникает кратная связь (табл. 6). На этом этапе расчета учитывают и появление сопряженных связей, вносящее свой вклад в изменение термодинамических характеристик. Например, при превращении изобутана в изобутен (А=1, В=3) поправка к теплоте образования равна 118 кДж/моль, а при переходе (того же типа) от изопропилбензола к α-метилстиролу кроме этой появляется еще по- правка на сопряжение с ароматическим кольцом, равная —8,37 кДж/моль.
Таблица 5. Поправки на вторичное замещение H на СH3
А |
В |
∆(∆H0ƒ,298) кДж/моль |
∆ S0298 Дж/(мольК) |
∆a |
∆b∙103 |
∆c∙103 |
|||||
1 |
1 |
-19,89 |
42,29 |
2,05 |
92,3 |
-37,5 |
|||||
1 |
2 |
-20,60 |
38,43 |
4,56 |
74,5 |
-27,1 |
|||||
1 |
3 |
18,51 |
40,70 |
4,19 |
83,2 |
-33,5 |
|||||
1 |
4 |
20,93 |
46,05 |
5,82 |
71,7 |
-24,6 |
|||||
1 |
5 |
-19,59 |
45,05 |
4,56 |
78,3 |
-30,0 |
|||||
2 |
1 |
-26,42 |
23,32 |
-1,26 |
91,0 |
-36,7 |
|||||
2 |
2 |
-26,50 |
29,93 |
-2,68 |
97,9 |
-41,7 |
|||||
2 |
3 |
-21,98 |
27,34 |
3,35 |
80,7 |
-32,2 |
|||||
2 |
4 |
-16,04 |
31,23 |
10,55 |
67,4 |
-24,6 |
|||||
2 |
5 |
-25,87 |
28,14 |
1,55 |
80,6 |
-32,3 |
|||||
3 |
1 |
-34,42 |
11,76 |
-1,17 |
101,4 |
-43,9 |
|||||
3 |
2 |
-29,31 |
16,20 |
-3,89 |
103,5 |
-37,5 |
|||||
3 |
3 |
-21,73 |
16,71 |
-13,7 |
129,6 |
-58,9 |
|||||
3 |
4 |
-20,68 |
7,87 |
-0,59 |
115,4 |
-43,0 |
|||||
3 |
5 |
-38,52 |
5,44 |
1,76 |
67,8 |
-19,6 |
|||||
В сложных и простых эфирах (I-0) |
-29,3 |
58,6 |
0,04 |
73,6 |
-22,3 |
||||||
В кислоте с образованием сложного эфира |
39,8 |
69,9 |
1,84 |
69,6 |
-20,7 |
||||||
Таблица 6. Поправки на замещение ординарных кратными сложыми связями
Тип кратной связи |
∆(∆H0ƒ,298) кДж/моль |
∆ S0298 Дж/(мольК) |
∆a |
∆b∙103 |
∆c∙103 |
1=1 |
137,66 |
-10,05 |
0,88 |
-34,7 |
5,7 |
1=2 |
125,60 |
-0,88 |
4,69 |
-47,7 |
13,9 |
1=3 |
118,19 |
-0,46 |
9,13 |
-65,4 |
26,9 |
2=2 (цис-) |
118,86 |
-4,98 |
-14,95 |
0,6 |
4,5 |
2=2 (транс-) |
114,72 |
-9,04 |
5,32 |
-53,5 |
16,2 |
2=3 |
111,87 |
-1,17 |
-8,46 |
-43,5 |
16,0 |
3=3 |
107,60 |
-2,76 |
-1,72 |
-63,4 |
26,8 |
1=1 |
312,25 |
-41,24 |
19,76 |
-102,0 |
26,3 |
2=2 |
274,24 |
-16,62 |
4,19 |
-107,6 |
-39,8 |
1=2 |
291,07 |
-17,54 |
13,23 |
-110,4 |
36,9 |
Дополнительные поправки для вводимых двойных связей |
|||||
сопряженных |
55,10 |
-15,66 |
9,38 |
4,9 |
-1,0 |
чередующихся |
-17,92 |
-21,44 |
-3,94 |
16,2 |
-14,6 |
смежных с ароматическим кольцом |
-8,37 |
-11,10 |
4,23 |
-13,6 |
5,5 |
Таблица 7. Поправки на группы, замещающие группу СН3
Замещающая группа |
∆(∆H0ƒ,298) кДж/моль |
∆ S0298 Дж/(мольК) |
∆a |
∆b∙103 |
∆c∙103 |
̶ OH |
-136,91 |
10,89 |
13,27 |
-62,2 |
23,4 |
̶ OH (Ar-орто ) |
-199,71 |
̶ |
̶ |
̶ |
̶ |
̶ NO2 |
5,02 |
8,37 |
26,38 |
-81,8 |
44,5 |
̶ CN |
163,28 |
16,74 |
15,24 |
-58,3 |
19,0 |
̶ Cl |
|||||
для первого атома Cl у атома С |
0 |
0* |
9,17 |
-78,9 |
26,2 |
для каждого последующего атома Cl |
18,84 |
̶ |
̶ |
̶ |
̶ |
̶ F |
-146,54 |
-4,19* |
9,38 |
-98,9 |
49,4 |
=O (альдегид) |
-54,01 |
-51,50 |
15,11 |
-233,3 |
95,1 |
=O (кетон) |
-55,27 |
-10,05 |
21,02 |
276,7 |
126,5 |
̶ COOH |
-364,25 |
64,48 |
35,59 |
-63,1 |
33,2 |
̶ SH |
66,15 |
21,77 |
17,04 |
104,5 |
5108 |
̶ C6H5 |
135,23 |
90,85 |
-3,31 |
224,5 |
-80,4 |
̶ NH2 |
51,50 |
-20,10 |
5,28 |
-30,6 |
9,3 |
* К вычисленным поправкам при расчете энтропии метилгалогенидов надо прибавлять единицу.
Последним этапом расчета является учет поправок при замещении групп СН3 на соответствующие функциональные группы (табл. 7).
Окончательный результат расчета — термодинамические характеристики вещества — находят, суммируя соответствующие свойства исходного «основного» вещества и все поправки, по- явившиеся при построении углеродного скелета молекулы, введении функциональных групп и кратных связей.
Пример. Найти термодинамические характеристики ацетона исходя из структуры его молекулы.
Структурная формула ацетона I требует первоначального построения молекулы вида II, исходным веществом для которой является метан (СН4):
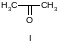
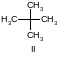
По табл. 3-7 находим:
Этапы расчета |
∆H0ƒ,298 кДж/моль |
S0298 Дж/(мольК) |
a |
b∙103 |
c∙103 |
1. Метан СН4 |
-74,90 |
186,3 |
15,9 |
69,6 |
-13,56 |
2. Первичное замещение Н на СН3 |
-10,47 |
43,33 |
-8,37 |
97,1 |
-38,2 |
3. Вторичное замещение Н на СН3 (тип А=1, В=1) |
-19,89 |
42,29 |
2,05 |
92,3 |
-37,5 |
4. Вторичное замещение Н на СН3 (тип А=2, В=1) |
-26,42 |
23,22 |
-1,26 |
91,0 |
-36,7 |
5. Вторичное замещение Н на СН3 (тип А=3, В=1) |
-34,42 |
11,76 |
-1,17 |
101,4 |
-43,9 |
6. Замена двух групп СН3 на =О (кетон) |
-55,27 |
-10,05 |
21,02 |
-267,7 |
126,5 |
Итого |
-221,37 |
296,85 |
28,17 |
183,7 |
-43,36 |
Справочные данные |
-216,83 |
296,09 |
22,49 |
201,9 |
-63,56 |
По методу структурных групп не обязательно начинать расчет с «основных» веществ, так как более надежные результаты получаются исходя из веществ более близкого строения, если для них имеются термодинамические данные.
Метод структурных групп предполагает, собственно, что для однотипных реакций ∆H0, S0и коэффициенты а, b и с в уравнениях теплоемкости равны друг другу. Более обоснованно предположение, что для двух однотипных реакций (I и II) равны только ∆S0. Это позволяет находить константу равновесия, если известны константа равновесия какой-либо однотипной реакции и их тепловые эффекты. Действительно, из ∆SI°=∆SII° следует;
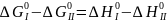
Откуда

и, следовательно:
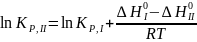
Этот способ (метод В. А. Киреева) более точен, чем метод структурных групп. Другие видоизменения последнего основаны на различных корреляционных зависимостях в рядах органических соединений при их участии в однотипных реакциях. Все они требуют определенного минимума экспериментальных данных и подробно излагаются в специальной литературе.
