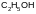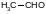- •Теория химических процессов основного органического и нефтехимическогосинтеза
- •Глава I 28
- •Глава II 64
- •Предисловие
- •Безразмерные характеристики материального баланса реакции. Парциальные молярные балансы
- •Глава I равновесие органических реакций
- •Расчет констант равновесия газофазных реакций по термодинамическим данным
- •Приближенные методы расчета констант равновесия
- •Константы равновесия жидкофазных реакций
Глава I равновесие органических реакций
Равновесные соотношения при химических реакциях имеют важное значение для предсказания возможности их протекания и для выявления условий процесса, термодинамически благоприятных для его практической реализации. Они необходимы также при кинетическом описании процесса, его моделировании и оптимизации.
Равновесные соотношения определяют двумя путями: термодинамическим расчетом или экспериментально. В первом случае вначале находят константу равновесия и по ней рассчитывают состав равновесных смесей, а во втором, наоборот, по составу равновесных смесей находят константу равновесия. Последняя часто является действительно постоянной величиной только при выражении ее через равновесные активности
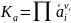 (I-1)
(I-1)
где
νi—стехиометрические
коэффициенты участников реакции с
соответствующим знаком,
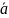 и
Ка
-
безразмерные равновесная активность
и константа равновесия.
и
Ка
-
безразмерные равновесная активность
и константа равновесия.
Подавляющее число процессов химической технологии протекает при постоянном или мало меняющемся давлении, когда равновесие характеризуется энергией Гиббса (другие, менее верные ее названия - свободная энергия, изобарно-изотермический потенциал). Изменение энергии Гиббса при химической реакции описывается уравнением:
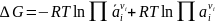 (I-2)
(I-2)
Если исходные реагенты находятся в так называемом стандартном состоянии (т. е. при ai = 1), второй член уравнения превращается в нуль и получается известная изотерма Вант-Гоффа
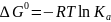 (I-3)
(I-3)
где ∆G0 - стандартное изменение энергии Гиббса при химической реакции. В свою очередь, последняя связана со стандартным изменением энтальпии и энтропии реакции соотношением:
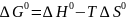 (I-4)
(I-4)
Эти уравнения являются основой расчета равновесий и в то же время основой экспериментального определения термодинамических свойств. Напомним, что при равновесии ∆G (а не ∆G0) равна нулю, и знак именно этой величины определяет направление реакции.
Расчет констант равновесия газофазных реакций по термодинамическим данным
Для газов и паров за стандартное принято состояние вещества в виде идеального газа при давлении 1 ат (0,1013 МПа ≈ 0,1 МПа). Именно для такого состояния и температуры 298 К в термодинамических таблицах, имеющихся в монографиях и справочниках, приводятся данные о стандартной энергии Гиббса и энтальпии образования соединений из простых веществ, а также об их абсолютной энтропии. Первые две величины обозначают ∆G0f,,298 и ∆H0ƒ,298 (где индекс ƒ происходит от англ. formation), а последнюю S0ƒ,298. Если соединение при указанных условиях (1 ат, или 0,1013 МПа, и 298 К) является жидким или твердым, эти данные соответствуют его фиктивному состоянию в виде идеального газа. В свою очередь, ∆G0ƒ,298 и ∆H0ƒ,298 относятся к образованию соединения из простых веществ (02, Н2, С и др.) в их обычном для 0,1 МПа и 298 К газообразном, жидком или твердом состоянии в виде наиболее стабильной модификации (значения ∆H0ƒ,298 и S0ƒ,298 для некоторых органических веществ приведены в качестве примера ниже, в табл. 3).
Изменение соответствующих характеристик при химической реакции нетрудно вычислить как их сумму для продуктов и исходных реагентов с учетом величины и знака стехиометрических коэффициентов:
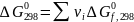
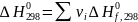
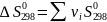 (I-5)
(I-5)
Если в реакции участвуют простые вещества, то для них ∆H0 и ∆G0 при всех температурах приняты равными нулю, но надо учитывать их абсолютную энтропию.
После
расчета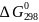 ,
если необходимо, определяют величину
,
если необходимо, определяют величину
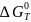 при
интересующей температуре реакции, для
чего существует ряд способов. Перед
рассмотрением их отметим, что входящая
в уравнение (I-1)
активность для идеального газа равна
соотношению его парциальных давлений
в данном и стандартном состояниях
Pi/Pi°.
В
технической системе единиц Pi°
равнялось
1 ат, поэтому безразмерная активность
идеального газа равнялась его давлению
в атмосферах. Этому соответствовала
и величина
при
интересующей температуре реакции, для
чего существует ряд способов. Перед
рассмотрением их отметим, что входящая
в уравнение (I-1)
активность для идеального газа равна
соотношению его парциальных давлений
в данном и стандартном состояниях
Pi/Pi°.
В
технической системе единиц Pi°
равнялось
1 ат, поэтому безразмерная активность
идеального газа равнялась его давлению
в атмосферах. Этому соответствовала
и величина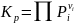 ,
имеющая размерность
,
имеющая размерность
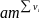 и
находимая по уравнению
и
находимая по уравнению
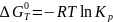 .
При переходе к СИ это соответствие
нарушилось, вследствие чего можно
рекомендовать такую процедуру: по
последнему уравнению находят вначале
.
При переходе к СИ это соответствие
нарушилось, вследствие чего можно
рекомендовать такую процедуру: по
последнему уравнению находят вначале
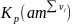 ,
а затем пересчитывают ее в единицы СИ,
т.е.
,
а затем пересчитывают ее в единицы СИ,
т.е.
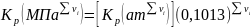 .
.
Наиболее
простой способ расчета констант
равновесия для идеальных газов, пригодный
для приближенной их оценки или выявления
термодинамической возможности данного
превращения, состоит в использовании
уравнения (I-4)
в предположении, что энтальпия и
энтропия реакции не зависят от
температуры. Так, для реакции
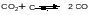 находим по таблицам:
находим по таблицам:
для
CO2
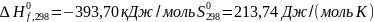
для
CO
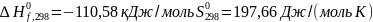
для
C
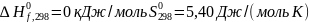
(графит)
Из этих данных вычисляем:
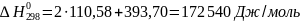
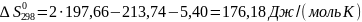
Отсюда при 1000 К энергия Гиббса равна:
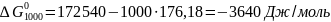
Теперь по уравнению (I-3) рассчитываем:
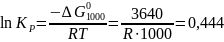
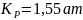
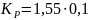
В действительности при точном расчете Кр = 0,190 МПа.
При подобном расчете иногда выражают константу равновесия как функцию температуры в соответствии с уравнением:
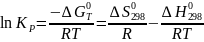 (I-6)
(I-6)
По нему легко предсказать область температур, при которой константа равновесия становится достаточно большой.
В действительности термодинамические функции определенным образом зависят от температуры, что нужно учитывать при точном расчете равновесий. Для энергии Гиббса эта зависимость такова:
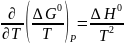 (I-7)
(I-7)
Практическое применение этого уравнения осложняется тем, что стандартное изменение энтальпии реакции также зависит от температуры в соответствии с законом Кирхгоффа:
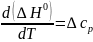 (I-8)
(I-8)
В уравнении (I-8) ∆cp представляет собой разность изобарных теплоемкостей продуктов и исходных веществ, которую рассчитывают с учетом стехиометрии процесса:
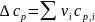 (I-9)
(I-9)
В соответствии с уравнением (I-8) и дифференциальным выражением TdS = cpdT получаем такие интегральные зависимости стандартной энтальпии и энтропии реакции:
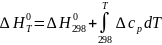
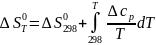
Таким образом, точное уравнение для энергии Гиббса таково:
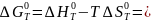
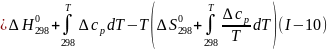
Одно из приближенных его решений, предложенное Темкиным и Шварцманом, основано на применении регрессионного уравнения зависимости теплоемкости веществ от температуры:
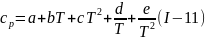
Коэффициенты уравнения определяют экспериментально, причем обычно бывает достаточно трех первых членов уравнения (I-11). Значения коэффициентов для разных веществ имеются в термодинамических таблицах (для примера см. табл. 3).
Используя уравнения (I-9), (I-10) и (I-l1),получаем
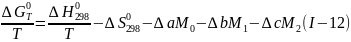
Где

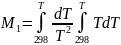
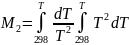
а ∆a, ∆b, ∆c - суммы коэффициентов уравнений теплоемкости для реагентов и продуктов, полученные в соответствии с уравнениями (I-11) и (I-9). Интегралы Темкина - Шварцмана М0, М1, М2, М-1 и М-2,
включающие под знаком второго интеграла температуру в соответствующей степени, зависят только от температуры. Они заранее рассчитаны с интервалом в 50 и 100 градусов, а внутри расчетных интервалов значения каждого интеграла следует находить интерполяцией (табл. 1).
Таблица 1. М-интегралы Темкина — Шварцмана
М-интеграл
|
М-интегралы при разной температуре |
|
|||||||
300К |
400К |
500К |
600К |
700 К |
800 К |
900 К |
|||
М0 |
0,000 |
0,0392 |
0,1133 |
0,1962 |
0,2794 |
0,3597 |
0,4361 |
||
М1∙10-3
|
0,000 |
0,0130 |
0,0407 |
0,0759 |
0,1153 |
0,1574 |
0,2012 |
||
М2∙10-3
|
0,000 |
0,0043 |
0,0149 |
0,0303 |
0,0498 |
0,0733 |
0,1004 |
||
М-2∙105
|
0,000 |
0,0364 |
0,0916 |
0,1423 |
0,1853 |
0,2213 |
0,2521 |
||
Пример. Дегидрирование этанола в ацетальдегид
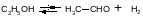
проводят в газовой фазе. Требуется рассчитать константу равновесия этой реакции при 473 К. Из табличных данных имеем:
Вещество |
∆H0ƒ,298, кДж/моль |
S0ƒ,298, Дж/моль |
a |
b∙103 |
c∙106 |
|
-235466 |
282,2 |
14,98 |
208,7 |
71,14 |
|
166467 |
265,9 |
31,07 |
121,5 |
-3,60 |
|
0 |
130,7 |
29,09 |
-0,837 |
2,013 |
Отсюда имеем:
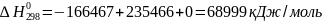
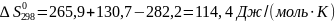
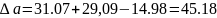
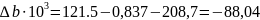
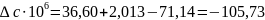
Из табл. 1 интегралы Темкина-Шварцмана при 473 К равны:
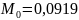
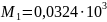
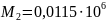
Тогда энергия Гиббса получится такой:
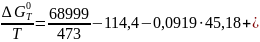
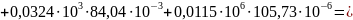
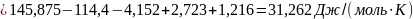
Поскольку
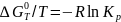 , то
, то
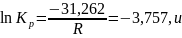
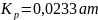 или
0,00236МПа (по экспериментальным данным
0,0121 ат, или 0,00122 МПа).
или
0,00236МПа (по экспериментальным данным
0,0121 ат, или 0,00122 МПа).
При отсутствии полных термодинамических данных оказывается полезным расчет, использующий прямое интегрирование температурной зависимости ∆G0 - уравнение (I-7). В этом варианте приходится учитывать влияние температуры на стандартный тепловой эффект реакции, которое дается интегральной формой закона Кирхгоффа
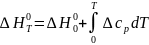
с
подстановкой
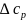 в
виде зависимости (I-11)
в
виде зависимости (I-11)
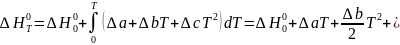
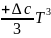
причем
через
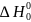 обозначена
постоянная интегрирования. Это выражение
можно использовать для интегрирования
уравнения (I-7):
обозначена
постоянная интегрирования. Это выражение
можно использовать для интегрирования
уравнения (I-7):
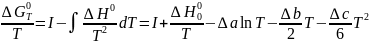
Или
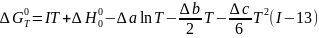
В уравнении (I-13) I , как и ∆Н00, является константой интегри-рования, следовательно, расчетная форма уравнения должна включать две численные величины I и ∆H°0, которые могут быть, найдены из соответствующих экспериментов. Так, если известны ∆G0 или константы равновесия реакции при двух разных температурах, то их подстановка в левую часть уравнения (I-I3) позволяет найти I и ∆H°0. Если имеются данные о тепловом эффекте, то можно найти ∆Н°0, и тогда достаточно знать ∆G0 при той же или при иной температуре, чтобы, зная H°0, вычислить I. Возможны и некоторые другие варианты, но очевидно, что для расчета двух постоянных интегрирования всегда требуется не менее двух экспериментально найденных величин ∆G0 или их сочетания с ∆H°, ∆S° и т. д.
По своей точности такой расчет ∆G°T не может превосходить метод Темкина — Шварцмана.
Пример. Для рассмотренной выще реакции дегидрирования этанола в ацетальдегид известны экспериментальные значения lgKp для 150 и 250 оС соответственно равные -2,796 и -0,635 (давление в атмосферах). С помощью их, а также известных коэффициентов уравнения теплоемкости, определяем постоянные интегрирования:
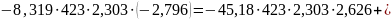
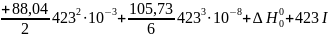
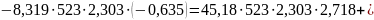
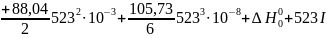
Вычитанием уравнений находим I≈106,82 и после подстановки ∆H°0=83842,14. Таким образом, уравнение для расчета lgКр приобретает вид:
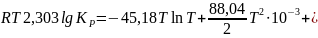
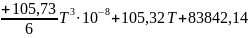
Для 200 °С оно дает lgКр = 1,596, Кр=0,02536 ат (0,002569 МПа), что близко к результату предыдущего расчета.
Равновесие для реальных газов. При повышенном давлении или в состоянии, близком к насыщенному пару, газы перестают быть идеальными, и для них используют выражения констант
Таблица 2. Коэффициенты летучести реальных газов γ при различных приведенных температурах ϴ и давлениях π
π |
γ при разной приведенной температуре ϴ |
||||||||
0,7 |
0,85 |
1,0 |
1,2 |
1,5 |
2,0 |
5,0 |
10 |
15 |
|
0,1 |
0,870 |
0,914 |
0,964 |
̶ |
̶ |
̶ |
̶ |
̶ |
̶ |
0,3 |
̶ |
0,806 |
0,888 |
0,960 |
̶ |
̶ |
̶ |
̶ |
̶ |
0,6 |
̶ |
̶ |
0,774 |
0,880 |
0,970 |
̶ |
̶ |
̶ |
̶ |
1,0 |
̶ |
̶ |
0,611 |
0,814 |
0,926 |
0,976 |
|
|
̶ |
2 |
̶ |
̶ |
0,385 |
0,668 |
0,822 |
0,956 |
1,040 |
1,025 |
|
5 |
̶ |
̶ |
0,226 |
0,464 |
0,736 |
0,922 |
1,076 |
1,048 |
1,038 |
10 |
̶ |
̶ |
0,202 |
0,434 |
0,730 |
0,964 |
1,167 |
1,102 |
1,072 |
15 |
̶ |
̶ |
̶ |
0,532 |
0,826 |
1,100 |
1,274 |
1,160 |
1,110 |
равновесия
и изотермы Вант-Гоффа через активности
[(I-1)
и (I-3)].
Чтобы сохранить общий вид термодинамических
зависимостей для реальных газов,
введено понятие летучести,
или фугитивности
ƒ, удовлетворяющее условию
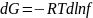 .
При
этом стандартная летучесть f0
принята
равной летучести газа в идеальном
состоянии при давлении 0,1013 МПа. Активностью
называют
соотношение летучестей реального газа
в данном и стандартном состояниях (ai
= fi/fi0),
а коэффициентом
летучести
- соотношение
его летучести и парциального давления
(γi
=
fi/Pi).
При
давлении 1 ат реальный газ можно принять
за идеальный, и поэтому ƒ0=
1 ат. Тогда
.
При
этом стандартная летучесть f0
принята
равной летучести газа в идеальном
состоянии при давлении 0,1013 МПа. Активностью
называют
соотношение летучестей реального газа
в данном и стандартном состояниях (ai
= fi/fi0),
а коэффициентом
летучести
- соотношение
его летучести и парциального давления
(γi
=
fi/Pi).
При
давлении 1 ат реальный газ можно принять
за идеальный, и поэтому ƒ0=
1 ат. Тогда
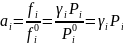 (I-14)
(I-14)
где Рi выражено в ат. Для идеального газа γi =1, ai =Pi ат и
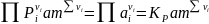 .
В
случае реального газа коэффициент
летучести находят по принципу
соответственных состояний, согласно
которому значения γ
для
реальных газов являются одинаковыми,
если газы находятся при тех же приведенных
температурах
ϴ
= Т/Ткр
и давлениях π
= Робщ/Ркр
(при определении π
берут не парциальное давление, а общее,
так как газ испытывает влияние всех
компонентов смеси, а для водорода вместо
критических параметров используют
Ркр+8
ат и Tкр+8
К).
Все это позволяет использовать для
нахождения γ
любых реальных газов одни и те же
графики или таблицы (табл. 2). Изотерму
Вант-Гоффа для реальных газов можно
преобразовать в следующую форму:
.
В
случае реального газа коэффициент
летучести находят по принципу
соответственных состояний, согласно
которому значения γ
для
реальных газов являются одинаковыми,
если газы находятся при тех же приведенных
температурах
ϴ
= Т/Ткр
и давлениях π
= Робщ/Ркр
(при определении π
берут не парциальное давление, а общее,
так как газ испытывает влияние всех
компонентов смеси, а для водорода вместо
критических параметров используют
Ркр+8
ат и Tкр+8
К).
Все это позволяет использовать для
нахождения γ
любых реальных газов одни и те же
графики или таблицы (табл. 2). Изотерму
Вант-Гоффа для реальных газов можно
преобразовать в следующую форму:
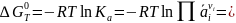
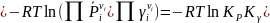 (I-15)
(I-15)
Здесь
Кр
выражено в ат, а
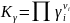 является произведением коэффициентов
летучести участников реакции в степени,
равной их стехиометрическим коэффициентам
с соответствующим знаком. Следовательно,
для расчета искомой величины Кр
для реальных
газовых смесей необходимо: 1) найти, как
для идеальных газов, ∆GТ0
и
по ней величину
является произведением коэффициентов
летучести участников реакции в степени,
равной их стехиометрическим коэффициентам
с соответствующим знаком. Следовательно,
для расчета искомой величины Кр
для реальных
газовых смесей необходимо: 1) найти, как
для идеальных газов, ∆GТ0
и
по ней величину
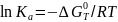 ;
2)
по приведенным параметрам определить
γi
и
Кi
после
чего вычислить
;
2)
по приведенным параметрам определить
γi
и
Кi
после
чего вычислить
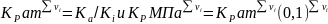 .
.
Пример. Найти КР реакции синтеза метанола в газовой фазе при 300oС и 30 МПа
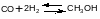
если известно, что ∆G0573= 39769 Дж/моль, а критические параметры таковы:
Вещество |
Tкр , К |
Ркр , МПа |
СО |
134,1 |
3,50 |
Н2 |
32,0 |
1,28 |
СН3ОН |
513,0 |
7,87 |
Рассчитываем приведенные параметры и находим:
Вещество |
ϴ |
π |
γ |
СО |
4,27 |
8,57 |
2,14 |
Н2 |
14,25 |
14,40 |
1,11 |
СН3ОН |
1,12 |
3,81 |
0,38 |
Отсюда
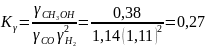
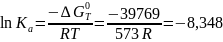
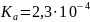
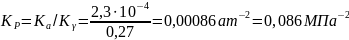
Очевидно, что по сравнению с идеальным состоянием смеси Кр увеличивается в 1 : 0,27 = 3,7 раза.