
- •Глава 1. Структурная организация и принципы функционирования белков Основные проявления жизни - результат функционирования белков
- •Аминокислоты - главные составные части белков
- •Свойства аминокислот - основа свойств белков
- •Спектроскопические свойства аминокислот
- •Химические реакции
- •Методы разделения аминокислот
- •Аминокислота, полипептид, белок
- •Свойства белков определяются свойствами аминокислот
- •Знание иэт важно для разделения белков методом электрофореза
- •Гель-электрофорез
- •Белки выполняют роль буферных систем
- •Белки в воде образуют растворы с особыми свойствами
- •В пространственой структуре белков выделяют четыре уровня организации
- •Исследование первичной структуры белков и пептидов
- •Искусственный синтез белков и пептидов
- •Пространственная структура белковой молекулы
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •Белки чувствительны к внешним воздействиям
- •Для определения количества белков используют разные подходы
- •Белки классифицируются разными способами
- •Простые белки построены только из аминокислот
- •Сложные белки содержат небелковые компоненты
- •Глава 2. Ферменты Клинико-лабораторное значение
- •Немного истории
- •В основе классификации ферментов - тип катализируемой реакции
- •Элементы химической логики
- •В основе химических реакций лежит образование и разрыв химических связей
- •У химической реакции есть скорость и порядок
- •На пути к пониманию механизма действия фермента
- •Ферменты – биологические катализаторы белковой природы
- •Методы выделения и очистки ферментов - это методы выделения и очистки белков.
- •Пример вычисления активности фермента:
- •Для работы некоторых ферментов необходимы дополнительные небелковые соединения
- •Белковая природа определяет многие свойства ферментов
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Активность фермента зависит от концентрации субстратов.
- •Важной качественной характеристикой фермента является константа Михаэлиса
- •Уравнение Михаэлиса и Ментен графически – прямоугольная гипербола
- •Примеры использования данных кинетических исследований ферментов в медицине
- •Кинетика мультисубстратных реакций
- •Скорость реакции зависит от концентрации фермента
- •Химические реакции протекают медленно
- •Ферменты превосходят другие катализаторы своей молекулярной активностью. Почему?
- •Группы активного центра фермента используют обычные химические принципы катализа
- •Реакции, катализируемые ферментами – основной объект, на который направлено действие регуляторов процессов жизнедеятельности
- •Активность ферментов можно тормозить (ингибировать)
- •Ингибиторы бывают разные: обратимые и необратимые
- •Обратимые ингибиторы могут быть конкурентными и неконкурентными
- •Конкурентные ингибиторы не всегда структурно подобны субстрату.
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •С мешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентные ингибиторы не могут связаться со свободным ферментом.
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Какая гипотеза является правильной?
- •Ферменты неравномерно распределены внутри клеток
- •Доступность субстрата или кофактора - важный элемент регуляции активности ферментов
- •Нарушение функции фермента вызывает болезнь.
- •Энзимопатии следствие ошибок в синтезе белков.
- •Исследование активности ферментов помогает врачу в диагностике болезней.
- •Некоторые примеры использования измерения активности ферментов в диагностике
- •Определение концентрации субстратов возможно при помощи ферментов.
- •Ферменты можно использовать как лекарственные препараты.
- •Рибозимы –исключение , подтверждающее правило.
- •Методы молекулярной инженерии позволяют конструировать новые ферменты
- •Глава 3. Витамины
- •Классификация витаминов
- •Нарушение баланса витаминов в организме
- •Гиповитаминозы.
- •Потребность организма человека в витаминах.
- •Причины дисбаланса витаминов в организме.
- •Межвитаминные взаимоотношения
- •Витамин в1 (Tиамин. Антиневритный витамин)
- •Витамин в2 (Рибофлавин).
- •Пантотеновая кислота (витамин в3).
- •Витамин рр (Витамин в5 , никотиновая кислота, никотинамид, ниацин). Антипеллагрический витамин.
- •Гомоцис- Серин Цистатионин α-кетобутират Цистеин
- •Фолиевая кислота (Фолацин. Витамин в9. Витамин вс).
- •Фолиевая кислота
- •Метилен-тгфк- Метилен-тгфк-
- •Биотин (витамин н).
- •Пропионил-КоА метилмалонил-КоА
- •Метилмалонил-КоА пируват пропионил-КоА оксалацетат
- •Витамин с (аскорбиновая кислота), антицинготный
- •Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
- •Рибосомы на мембране эндо-
- •Сигнальный пептид
- •Витаминоподобные соединения Витамин f (эссенциальные жирные кислоты)
- •Инозит (Витамин в8)
- •Карнитин
- •Липоевая кислота (витамин n)
- •Пара-Аминобензойная кислота.
- •Витамин u
- •Холин (витамин в4).
- •Ацетилхолинэстераза н2о
- •Глава 4. Введение в термодинамику Биомедицинское значение.
- •Биоэнергетика- составная часть термодинамики
- •Функции состояния системы.
- •Первый закон термодинамики утверждает энергия вселенной не исчезает
- •Второй закон термодинамики указывает на вероятность и направление процесса
- •Свободная энергия и концентрация. Стандартное состояние в биологических реакциях.
- •Изменение свободной энергии и константа равновесия.
- •Примеры вычисления констант равновесия и изменений свободной энергии
- •Сопряженные реакции лежат в основе многих химических процессов в клетке.
- •«Энергетической валютой» клетки является атф
Пример вычисления активности фермента:
Исходные данные: |
Через 10 мин: |
||
25.0 x 10-3 моль л--1 пептида-субстрата, объем реакционной смеси 2.5 мл, 0.50 µг химотрипсина4 |
18.6 x 10-3 моль л--1 пептида -субстрата, Объем реакционной смеси 2.5 мл, 0.50 µг химотрипсина. |
||
Использованный субстрат |
= 6.4 x 10-3 моль л-1 за 10 мин |
|
|
Скорость реакции |
= 6.4 x 10-4 моль л-1 мин-1 |
|
|
Активность Фермента (скорость x объем) |
= 6.4 x 10-4 моль л-1 мин-1 x 2.5 x 10-3 л = = 1.6 x 10-6 моль мин-1 |
|
|
Удельная активность (активность / масса) |
= 1.6 x 10-6 моль мин-1 / 0.50 µг = = 3.2 x 10-6 моль µг-1 мин-1 |
|
|
Число оборотов (уд. акт. x молярная масса) |
= 3.2 x 10-6 моль µг-1 мин-1 x 25,000 x 106 µг моль-1 = 8.0 x 104 мин-1 =1330 сек-1 |
|
|
Если удельная активность, рассчитанная выше, относится к чистому химотрипсину, образец, давший, например, удельную активность 2.0 x 10-7 моль µг-1 мин-1 - 100 % x 2.0 x 10-7 / 3.2 x 10-6 или 6.3 % чистоты. 1.0 µг такого образца на самом деле содержит лишь 0.063 µг химотрипсина и 0.937 µг примесей.
Методы исследования активности определяются механизмом реакции и природой опре

Рис2-4. Молярное поглощение НАД+,НАДН+Н+, ФАД, ФАДН2 при разных длинах волн поглощаемого света
деляемого вещества. Наиболее широко используются:
Измерение изменения спектральных свойств (измерение поглощения света в видимой или ультрафиолетовой области, измерение флюоресценции) при помощи спектрофотометров, ФЭКов, спектрофлуориметров. Эти методы применяют и для определения количества продуктов или субстратов реакции, и для изменений количества коферментов, участвующих в реакции. Последнее нашло широкое применение в практике клинических биохимических лабораторий. В основе этих методов лежит закон Beer-Lambert: A = x c x l = log (I0/I) (, поглощение 1 M раствора вещества при специфической длине волны или молярный коэффициент экстинкции; c, концентрация ; A, поглощение ; l, длина в см кюветы спектрофотометра ; I0, интенсивность падающего света; I, интенсивность прошедшего света). В случае, если молярный коэффициент экстинкции ( исследуемого вещества неизвестен, исследователь определяет экспериментально зависимость между поглощением света исследуемого раствора и концентрацией этого вещества и использует полученную закономерность в форме стандартного (калибровочного) графика.
На рисунке 2-4 показаны спектральные характеристики коферментов НАД и ФАД в окисленной и восстановленной форме. Измерение поглощения при 340 нм используется для количественной оценки активности ферментов, катализирующих окислительно-восстановительные реакции c участием НАД. Вот пример такого расчета для реакции, катализируемой лактатдегидрогеназой В этой реакции молочная кислота окисляется, передавая водороды на НАД+. При этом НАД+ восстанавливается до НАДН +Н+., который в отличие от НАД+ поглощает свет с длиной волны 340 нм. Допустим, за время проведения реакции поглощение при длине волны 340 нм изменялось на 0.31 единицы в минуту. Измерения проводили в кювете шириной 1 см. Коэффициент молярной экстинкции для НАДН при 340 нм = 6200 л моль-1 см-1 .

Увеличение [НАДH] = |
Увеличение поглощения e . l |
0.31 6200 |
=5.0 х10-5 моль/л |
Эту величину можно использовать для оценки скорости реакции.
Измерение изменений концентрации высвобождаемых или поглощаемых во время реакции H+ или ОН- при помощи pH-стата (устройство, которое автоматически добавляет кислоту или основание, сохраняя постоянство pH в реагирующей смеси)
Химический анализ с использованием высокоразрешающей жидкостной или газовой хроматографии, или ЯМР или тонкослойной хроматографии. (АТФазы)
Изотопный анализ (например, с использованием радиоактивного 32P)
С
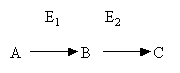 опряженные
реакции – используются в случаях, если
нет возможности прямо определить
количество продукта исследуемой
реакции. В таких случаях в реагирующую
смесь добавляется фермент (Е2)
катализирующий превращение образующегося
продукта в реакции, которую можно
оценить количественно, одним из
вышеперечисленных методов.
опряженные
реакции – используются в случаях, если
нет возможности прямо определить
количество продукта исследуемой
реакции. В таких случаях в реагирующую
смесь добавляется фермент (Е2)
катализирующий превращение образующегося
продукта в реакции, которую можно
оценить количественно, одним из
вышеперечисленных методов.
Если фермент Е2 присутствует в избытке, скорость образования C отражает скорость образования В.
Например, сопряженное исследование активности глюкокиназы (используется избыток глюкозо-6-фосфат дегидрогеназы и НАДФ+)
Глюкоза + AТФ → глюкоза 6-Ф + AДФ : (катализируется глюкокиназой –Е1) Глюкоза-6-Ф + НАДФ+ → 6-фосфоглюконолактон + НАДФН + H+ : ( катализируется глюкоза-6Ф –дегидрогеназой – Е2):
Скорость образования НАДФH (измеряется по поглощению при 340 нм) пропорциональна активности глюкокиназы (см выше)
Классические методы очистки. Широко используются следующие методы очистки: осаждение различными концентрациями солей щелочно - земельных металлов (чаще всего сульфата аммония или сульфата натрия) или сочетанием их с органическими растворителями (ацетоном, этанолом), дифференциальная денатурация путем нагревания или изменения рН, дифференциалъное центрифугирование, гель-фильтрация и электрофорез.
Для быстрой очистки ферментов успешно применяется избирательная адсорбция и элюция белков с ионобменников (ДЭАЭ или КМ производные целлюлозы или других полимеров). Широко используется также: разделение белков по размерам при помощи гель-фильтрации. Все эти методы являются, однако, относительно мало избирательными (если они не используются в сочетании) для выделения индивидуального белка из сложной смеси клеточных ферментов. Значительно упрощается такая задача при помощи метода аффинной хроматографии.
Табл 2-1. Типичная процедура очистки одного из ферментов печени |
||||
Этапы очистки |
Суммарная активность ед |
Суммарный белок мг |
Удельная активность ед/мг |
Выход % |
1. Водно-солевой экстракт плаценты |
47138 |
115440 |
0.408 |
(100) |
2. Осадок ,образующийся после осаждения 65% -ным (NH4)2SO4 |
42741 |
63400 |
0.674 |
90.7 |
3. Осадок ,образующийся после осаждения 35-65% -ным (NH4)2SO4 |
40152 |
10618 |
3.781 |
85.2 |
4. Активная фракция после хроматографии на ДЭАЭ-целлюлозе осадка фракции 3 |
31510 |
3818 |
8.252 |
78.5 |
5. Активная фракция после хроматографии фракции 4 на фосфоцеллюлозе |
27544 |
466 |
59.1 |
58.4 |
6. Активная фракция после гель фильтрации фракции 5 |
25174 |
110.8 |
227.2 |
53.4 |
7. Повторение этапа 6. |
17940 |
88.8 |
216.7 |
40.1 |
Типичная процедура очистки одного из ферментов печени с хорошим выходом и 227-кратной степенью очистки препарата описана в табл 2-1. Обратите внимание на изменение при очистке удельной активности и выхода фермента. Процедура направлена на достижение максимальной удельной активности (число единиц активности фермента на 1 мг белка) при возможно большем выходе исходной суммарной активности. Из данных таблицы видно, что уже в процессе очистки решаются проблемы исследования свойств фермента. Повторение этапа 6 привело к снижению удельной активности, что возможно связано с особенностями физико-химических свойств выделяемого фермента.
