
- •Лабораторний практикум
- •051301 "Хімічна технологія"
- •Затверджено на засіданні
- •Загальні методичні вказівки
- •Вивчення кінетики полімеризації
- •1.1 Порядок виконання роботи і розрахунків
- •1.2 Методика роботи
- •2 Визначення констант співполімеризації і будови співполімерів
- •2.1 Порядок виконання роботи та обчислень
- •2.2 Методика роботи
- •2.3 Визначення вмісту карбоксильних груп у співполімері
- •2.4 Визначення складу вихідної суміші мономерів і співполімерів
- •2.5 Визначення констант співполімеризації
- •2.6 Графік залежності складу співполімеру від складу вихідної суміші мономерів
- •2.7 Внутрішньомолекулярний розподіл складових ланок у співполімерах
- •3 Вивчення кінетики поліконденсації
- •3.1 Методика роботи
- •3.2 Визначення кінетичних і активаційних параметрів
- •4 Полімераналогічні реакції целюлози
- •4.1 Методика роботи
- •5 Питання для контролю знань до розділів курсу
- •5.1 Полімеризація олефінових мономерів
- •5.2 Співполімеризація олефінових мономерів
- •5.3 Поліконденсація
- •5.4 Реакції полімерів
- •Список літератури
3 Вивчення кінетики поліконденсації
Мета роботи – провести синтез лінійного поліефіру і визначити: ступінь завершеності реакції, середньочислову молекулярну масу і константу швидкості реакції.
Реактиви: адипінова (себацинова) кислота, етиленгліколь (діетиленгліколь), 0,1 N спиртовий розчин КОН, спиртобензольна суміш.
Посуд і обладнання: тригорла колба місткістю 250 см3, зворотній холодильник з насадкою Діна-Старка, мішалка, піщана або силіконова баня, термометр до 250С, колби для титрування.
3.1 Методика роботи
У реакційну колбу вносять мономери в еквімолекулярних кількостях (за вказівкою викладача) і поступово підвищують температуру протягом 35 – 40 хвилин при переміщуванні до 180 – 190С.
Процес поліконденсації протікає за такою схемою:
n HOOC – (CH2)m – COOH + n HO-CH2CH2 – OH →
→ HO – [-OC - (CH2)m - COO CH2CH2O-]n – H + (2n -1) H2O
Унаслідок того, що процес протікає як рівноважний, воду, що утворюється, треба відганяти із зони реакції, користуючись насадкою Діна-Старка.
При постійній температурі поліконденсацію ведуть протягом 4 – 4,5 годин.
Для визначення кінетичних параметрів реакції через певні проміжки часу (30 – 40 хв.) після утворення однорідної маси відбирають проби (0,2 – 0,3 г), в яких визначають кислотне число (КЧ).
Визначення КЧ зводиться до титрування відібраних і зважених з точністю до 0,0002г проб на аналітичних вагах. Зважені проби розчинюють у спирті або у спиртобензольній суміші (в залежності від ступеня перетворення) і титрують 0,1N спиртовим розчином КОН у присутності фенолфталеїну.
Кислотне число знаходять за результатами титрування за формулою:
![]()
де V і V0 об’єм 0,1 н розчину лугу, який пішов на титрування проби з наважкою холостої проби відповідно, мл;
К – поправочний коефіцієнт нормальності розчину лугу;
0,00561 – кількість грамів КОН, що відповідає одному мл точно 0,1 N розчину КОН;
m – маса наважки проби, г.
Для визначення кінетичних та активаційних параметрів процесу поліконденсації необхідно провести два досліди при температурах 180 і 190C і побудувати графік залежності КЧ від часу при різних температурах.
Ступінь завершеності реакцій (ступінь перетворення) у будь якій момент часу Pt находять із співвідношення:
![]()
де С0 – початкова концентрація карбоксильних груп, гекв/г, яка визначається за рівнянням:

де m1 і m2 – наважки дикарбонової кислоти та етиленгліколю, г;
М1 – молекулярна маса дикарбованої кислоти, г/моль;
2 – кількість еквівалентів.
Плинна концентрація карбоксильних груп – Сt (моль/г), визначається за кислотним числом, визначеним у момент часу t з використанням рівняння:
![]()
Знаючи ступінь перетворення, можна визначити ступінь поліконденсації:
![]()
і середньочислову молекулярну масу:
![]()
де m – молекулярна маса складової повторної ланки поліестеру.
3.2 Визначення кінетичних і активаційних параметрів
З деякими допущеннями константу швидкості реакції поліестерифікації можна визначити, користуючись рівнянням швидкості реакції третього порядку в інтегральній формі у вигляді:
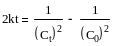
де С0 і Сt – відповідно початкова і плинна концентрація карбоксильних груп, моль/г;
t – час від початку реакції, с.
Константу швидкості можна визначити також за формулою:
![]()
користуючись вихідною концентрацією карбоксильних груп і ступенем перетворення.
Енергію активації поліконденсації визначають за рівнянням, приведеним у першій роботі, використовуючи знайдені константи швидкості реакції при двох температурах.
Крім того Еакт визначають графічним методом, користуючись залежністю КЧ від часу при різних температурах. Для цього на одержаних кривих находять точки, що мають однакові значення кислотних чисел і опускають перпендикуляри на вісь абсцис. Одержані значення відрізків часу підставляють у формулу для визначення енергії активації:
![]()
де t1 і t2 – час досягнення однакового КЧ при різних температурах T1 і T2 (T2 >T1), с;
R – універсальна газова стала, 8,3143 кДж/(мольград);
E – енергія активації, кДж/моль.
Одержані результати розрахунків заносять у таблицю 3.1.
Таблиця 3.1 Результати розрахунків
Вихідні мономери |
T, C |
P |
|
k |
E |
|
|
|
|
|
|
