
- •Глава х. Нитросоединения
- •X.1. Алифатические нитросоединения
- •Свойства
- •I. Таутомерия нитросоединений.
- •II.Реакции с участием нитрогруппы.
- •III. Реакции положения к нитрогруппе.
- •X.2. Ароматические нитросоединения (нитроарены)
- •I. Реакции нитрогруппы.
- •Глава XI..Диазосоединения
- •XI.1. Соли арилдиазония
- •Химические свойства солей диазония
- •XI.1.1.Реакции, сопровождающиеся выделением азота ( реакции замещения диазониевой группы)
- •X I.1.2. Реакции, не сопровождающиеся выделением азота
- •XI.2. Диазоалканы
X I.1.2. Реакции, не сопровождающиеся выделением азота
Известно значительное число превращений солей диазония, в которых сохраняются оба атома азота. Это реакции восстановления диазониевой группы и реакции, в которых диазониевая группа выступает как электрофил.
Восстановление диазосоединений до гидразинов. При действии на соли диазония хлорида олова (II) или сульфита натрия происходит гидрирование кратной связи азот-азот, и образуются арилгидразины ( в виде солей, из которых арилгидразины выделяют действием оснований):
Э![]() то
– лучший способ получения арилгидразинов;
они используются для получения
арилгидразонов карбонильных соединений
(стр. 239); арилгидразоны применяются для
характеристики карбонильных соединений,
но особенно важным является их
использование для синтеза производных
индола по Фишеру (будет рассмотрено в
разделе «Гетероциклические соединения»).
то
– лучший способ получения арилгидразинов;
они используются для получения
арилгидразонов карбонильных соединений
(стр. 239); арилгидразоны применяются для
характеристики карбонильных соединений,
но особенно важным является их
использование для синтеза производных
индола по Фишеру (будет рассмотрено в
разделе «Гетероциклические соединения»).
Далее будут рассмотрены разнообразные превращения, в которых диазониевая группа выступает как электрофил. В ходе этих реакций к ней присоединяются различные нуклеофильные реагенты.
Диазониевый катион можно представить в виде двух резонансных структур:
Е стественно,
структура D1
с зарядом на «внутреннем» атоме азота
намного устойчивее (аммонийная структура),
и резонансный гибрид весьма близок к
ней. Вместе с тем, нуклеофильные реагенты
не могут присоединяться к «внутреннему»
атому азота, который уже содержит 8
электронов во внешнем слое (структура
D1);
они могут присоединяться только к
секстетному «внешнему» атому азота
(структура D2).
Вследствие малой величины положительного
заряда на этом атоме диазоний-катион
является лишь
умеренно активным
электрофилом; тем не менее, известно
достаточное количество реакций
взаимодействия солей диазония с O-,
N-,
C-
нуклеофилами; целый ряд таких реакций
приводит к практически полезным
результатам.
стественно,
структура D1
с зарядом на «внутреннем» атоме азота
намного устойчивее (аммонийная структура),
и резонансный гибрид весьма близок к
ней. Вместе с тем, нуклеофильные реагенты
не могут присоединяться к «внутреннему»
атому азота, который уже содержит 8
электронов во внешнем слое (структура
D1);
они могут присоединяться только к
секстетному «внешнему» атому азота
(структура D2).
Вследствие малой величины положительного
заряда на этом атоме диазоний-катион
является лишь
умеренно активным
электрофилом; тем не менее, известно
достаточное количество реакций
взаимодействия солей диазония с O-,
N-,
C-
нуклеофилами; целый ряд таких реакций
приводит к практически полезным
результатам.
Взаимодействие солей диазония со щелочами. Диазогидраты и диазотаты. При обработке солей диазония щелочами происходит нуклеофильное присоединение гидроксид-аниона к катиону диазония с образованием диазогидратов (755); эти соединения обладают кислотными свойствами и реагируют с избытком щелочи, образуя соли - диазотаты (756):
Т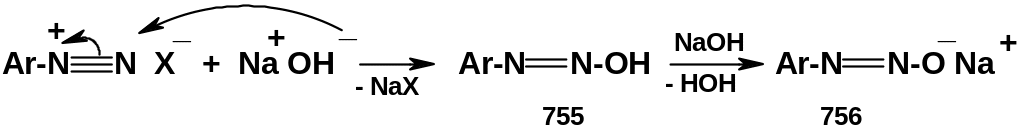 аким
образом, соли диазония, сами не обладающие
кислотными свойствами, способны
нейтрализовать щелочь, т.е. они являются
псевдокислотами,
образующими настоящие кислоты.
аким
образом, соли диазония, сами не обладающие
кислотными свойствами, способны
нейтрализовать щелочь, т.е. они являются
псевдокислотами,
образующими настоящие кислоты.
Диазогидраты и диазотаты относятся к диазопроизводным.
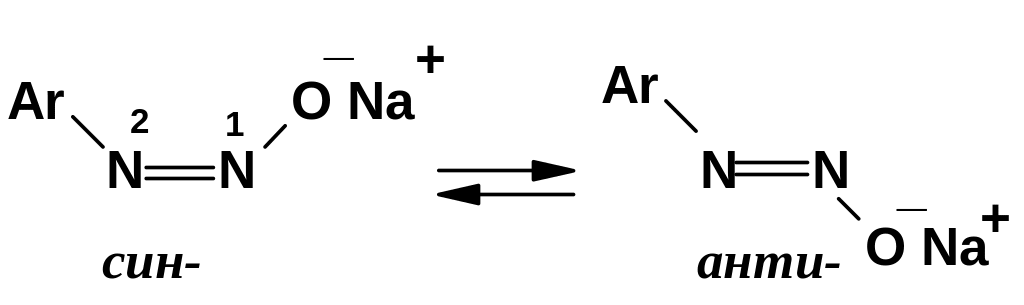 Для
диазогидратов и диазотатов характерна
геометрическая
изомерия;
в частности, в момент образования
диазотаты возникают в виде син-изомеров,
которые затем постепенно изомеризуются
в более устойчивые анти-изомеры:
Для
диазогидратов и диазотатов характерна
геометрическая
изомерия;
в частности, в момент образования
диазотаты возникают в виде син-изомеров,
которые затем постепенно изомеризуются
в более устойчивые анти-изомеры:
Отрицательный заряд в диазотат-анионе делокализован между атомами кислорода и азота N2; это облегчает син-анти изомеризацию, т.к. связь между атомами азота в истинной структуре (резонансном гибриде) «не вполне двойная» (см. ниже), и энергетический барьер изомеризации снижен. Вследствие делокализации диазотат-анион является амбидентным нуклеофилом; его использование в качестве реагента в реакциях нуклеофильного замещения может привести как к N-алкилированию [соединения (757)], так и к О-алкилированию [(соединения (758)]. В частности, при взаимодействии с алкилгалогенидами в случае M=Na преимущественно образуются нитрозамины (757), а в случае M=Ag – диазоэфиры (758):
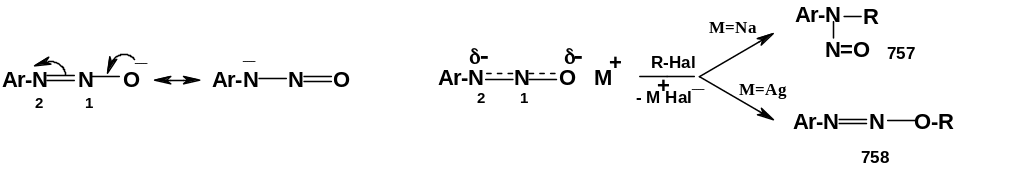
 При
подкислении растворов диазотатов одним
эквивалентом
кислоты образуются диазогидраты, которые
таутомерны нитрозаминам; образуется
смесь нитрозамина и двух стереоизомерных
форм диазогидрата:
При
подкислении растворов диазотатов одним
эквивалентом
кислоты образуются диазогидраты, которые
таутомерны нитрозаминам; образуется
смесь нитрозамина и двух стереоизомерных
форм диазогидрата:
При подкислении растворов диазотатов избытком минеральной кислоты снова образуются соли арилдиазония – после О-протонирования возникающего вначале диазогидрата и последующего отщепления воды:
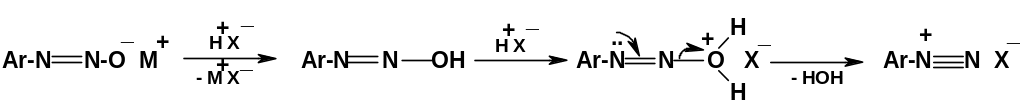 Взаимодействие
солей диазония с N-нуклеофилами.
Триазены.
Первичные амины присоединяются к катиону
арилдиазония с образованием диазопроизводных
(759); их называют диазоаминосоединениями
или триазенами:
Взаимодействие
солей диазония с N-нуклеофилами.
Триазены.
Первичные амины присоединяются к катиону
арилдиазония с образованием диазопроизводных
(759); их называют диазоаминосоединениями
или триазенами:
Д
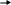
 ля
триазенов характерна таутомерия (759)
(760): равновесие смещено в сторону
таутомера, у которого водород находится
при
атоме
азота с большей основностью.
Кроме первичных аминов, в реакцию с
солями диазония можно вводить вторичные
амины и производные гидроксиламина.
ля
триазенов характерна таутомерия (759)
(760): равновесие смещено в сторону
таутомера, у которого водород находится
при
атоме
азота с большей основностью.
Кроме первичных аминов, в реакцию с
солями диазония можно вводить вторичные
амины и производные гидроксиламина.
Триазены, содержащие три связанные друг с другом атома азота, не очень устойчивы; при действии сильных кислот они подвергаются обратному расщеплению на соли диазония и первичные амины.
Взаимодействие солей диазония с С-нуклеофилами. Азосочетание и азокрасители. В результате присоединения С-нуклеофилов к диазониевым катионам образуются ковалентные азосоединения. В качестве простого примера можно привести взаимодействие солей диазония с цианидами металлов с образованием N-цианоазосоединений:
В![]()
 качестве С-нуклеофилов можно использовать
карбанионы, генерируемые из метиленактивных
соединений под действием оснований.
Соединения типа X-CH2-Y
в слабоосновных средах (обычно
водно-спиртовый раствор ацетата натрия)
взаимодействуют с солями диазония по
схеме:
качестве С-нуклеофилов можно использовать
карбанионы, генерируемые из метиленактивных
соединений под действием оснований.
Соединения типа X-CH2-Y
в слабоосновных средах (обычно
водно-спиртовый раствор ацетата натрия)
взаимодействуют с солями диазония по
схеме:
Нуклеофильное присоединение карбанионов к диазоний-катионам приводит к азосоединениям (761), которые таутомерно превращаются в более устойчивые арилгидразоны (762).
 Если
в реакции с солями диазония вводить
замещенное
(например, моноалкилированное) СН-активное
соединение, где Х или Y
– ацильная или карбоксильная группа,
то эта группа отщепляется и образуется
всё-таки арилгидразон:
Если
в реакции с солями диазония вводить
замещенное
(например, моноалкилированное) СН-активное
соединение, где Х или Y
– ацильная или карбоксильная группа,
то эта группа отщепляется и образуется
всё-таки арилгидразон:
Этот вариант, называемый реакцией Яппа-Клингеманна, позволяет получать довольно широкий круг арилгидразонов, содержащих электроноакцепторные группы Х; эти арилгидразоны используют для синтеза индолов по Фишеру.
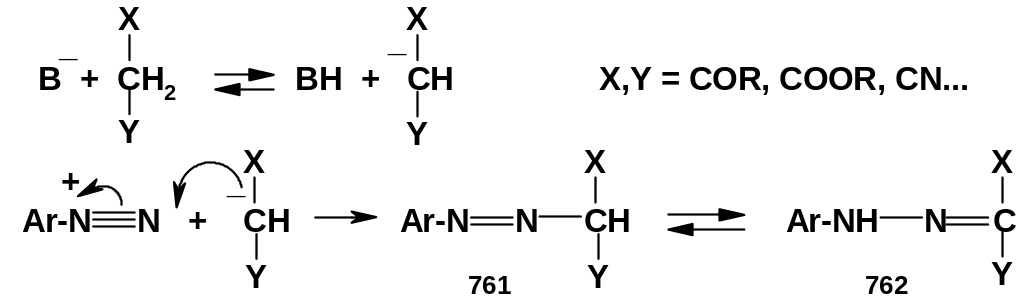
Наиболее практически важной и наиболее распространенной реакцией солей диазония с С-нуклеофилами является реакция азосочетания. Это-взаимодействие солей диазония с ароматическими соединениями, содержащими сильные электронодонорные заместители, – фенолами и ароматическими аминами:
В этих реакциях соль диазония называют
диазокомпонентой
(диазосоставляющей),
а ароматический субстрат – азокомпонентой
(азосоставляющей); их сочетание дает в
итоге ароматическое
азосоединение.
этих реакциях соль диазония называют
диазокомпонентой
(диазосоставляющей),
а ароматический субстрат – азокомпонентой
(азосоставляющей); их сочетание дает в
итоге ароматическое
азосоединение.
Реакции протекают как электрофильное замещение в ароматическом ядре азокомпоненты. Катион диазония, как упоминалось выше, – не особо сильный электрофил, поэтому субстраты с неактивированными ароматическими ядрами (например, арены) не реагируют с солями диазония, и лишь сильные донорные заместители в ядре, такие, как гидрокси- и аминогруппы, активируют ядро в такой степени, что реакции становятся возможными. Механизм реакций, как и для других реакций электрофильного замещения в ядре, включает образование аренониевого σ-аддукта (763) в качестве интермедиата:
О бычно
сочетание идет в пара-положение
к
активирующей группе Z;
если же это положение занято, оно идет
в орто-положение
(см. ниже, продукт 764).
бычно
сочетание идет в пара-положение
к
активирующей группе Z;
если же это положение занято, оно идет
в орто-положение
(см. ниже, продукт 764).
Наиболее часто в качестве азокомпонент используют фенолы и третичные ароматические амины; при использовании первичных и вторичных аминов конкурентно протекает присоединение аминогруппы к диазониевому катиону с образованием триазенов (см. выше), которые, правда, можно затем изомеризовать в азосоединения. Азосочетание с аминами проводят в нейтральном или чаще в слабокислом растворе; при этом амины реагируют в непротонированной форме (в протонированной форме аминогруппа не активирует, а пассивирует ароматическое ядро; поэтому нельзя проводить реакцию в сильнокислой среде). Сочетание с фенолами проводят в слабощелочной среде; в этих условиях фенолы частично переходят в феноляты, содержащие самую сильную активирующую группу - О¯; эта форма и вступает в сочетание. Сильнощелочная среда неприемлема, т.к. в этих условиях соли диазония переходят в диазотаты (см. выше), которые неспособны вступать в реакцию азосочетания (диазотаты – нуклеофилы, а не электрофилы).
В реакцию азосочетания с солями диазония могут вступать некоторые ароматические гетероциклы (пиррол, см. ниже).
Практическое использование азосочетания связано с синтезом азокрасителей. Выше упоминалось что ароматические азосоединения окрашены. Если ароматические ядра азокрасителей содержат группы, обладающие +М-эффектом, окраска становится более глубокой и интенсивной. Именно такие группы содержатся в продуктах азосочетания, поэтому многие из них нашли применение как устойчивые и доступные красители – азокрасители.
 В
качестве примера можно привести синтез
красителя паракрасного
(764) – продукта сочетания соли
п-нитрофенилдиазония
с 2-нафтолом:
В
качестве примера можно привести синтез
красителя паракрасного
(764) – продукта сочетания соли
п-нитрофенилдиазония
с 2-нафтолом:
Некоторые азокрасители обладают свойствами кислотно-основных индикаторов, т.к. меняют окраску при изменении рН; простейший пример – метиловый оранжевый, получаемый сочетанием соли п-сульфофенилдиазония с диметиланилином:
В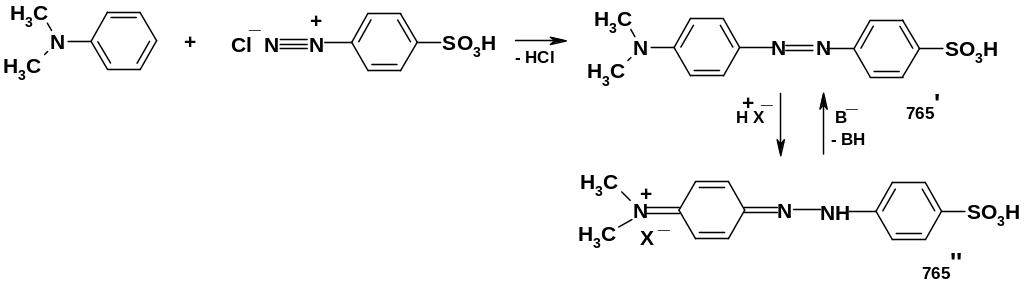 нейтральной и основной средах этот
краситель имеет структуру азосоединения
(765’) и окрашен в желтый цвет; в кислой
среде происходит протонирование по
атому азота азогруппы и переход в катион
(765’’), имеющий хиноидную
структуру;
окраска при этом меняется на ярко-оранжевую.
При добавлении основания происходит
обратный переход.
нейтральной и основной средах этот
краситель имеет структуру азосоединения
(765’) и окрашен в желтый цвет; в кислой
среде происходит протонирование по
атому азота азогруппы и переход в катион
(765’’), имеющий хиноидную
структуру;
окраска при этом меняется на ярко-оранжевую.
При добавлении основания происходит
обратный переход.
Известно огромное количество азокрасителей, окрашенных практически во все цвета видимого спектра. К сожалению, ряд азокрасителей обладает канцерогенными свойствами.
