
- •Глава х. Нитросоединения
- •X.1. Алифатические нитросоединения
- •Свойства
- •I. Таутомерия нитросоединений.
- •II.Реакции с участием нитрогруппы.
- •III. Реакции положения к нитрогруппе.
- •X.2. Ароматические нитросоединения (нитроарены)
- •I. Реакции нитрогруппы.
- •Глава XI..Диазосоединения
- •XI.1. Соли арилдиазония
- •Химические свойства солей диазония
- •XI.1.1.Реакции, сопровождающиеся выделением азота ( реакции замещения диазониевой группы)
- •X I.1.2. Реакции, не сопровождающиеся выделением азота
- •XI.2. Диазоалканы
III. Реакции положения к нитрогруппе.
 1.
Взаимодействие с азотистой кислотой.
Первичные
нитросоединения при взаимодействии с
азотистой кислотой (смесь NaNO2
c
минеральной кислотой) образуют нитроловые
кислоты
(738):
1.
Взаимодействие с азотистой кислотой.
Первичные
нитросоединения при взаимодействии с
азотистой кислотой (смесь NaNO2
c
минеральной кислотой) образуют нитроловые
кислоты
(738):
Вначале образуется нитрозопроизводное, которое таутомерно переходит в соединение (738). Вторичные нитросоединения образуют просто нитрозопроизводные, называемые псевдонитролами; здесь таутомерия невозможна:
О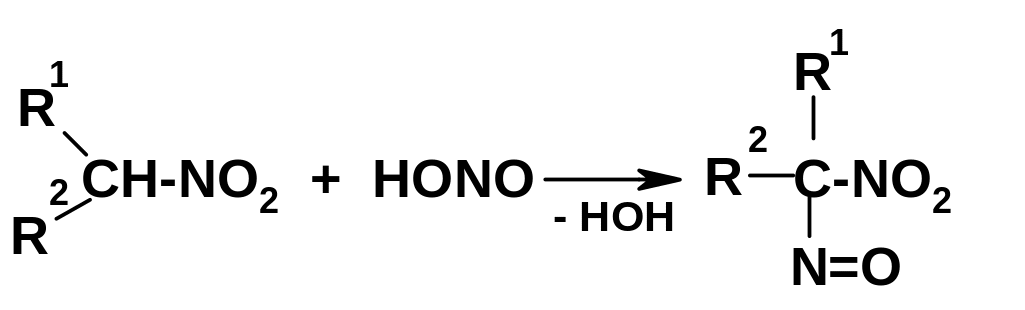 бе
эти реакция аналогичны нитрозированию
положения
карбонильных соединений (стр. 255).
бе
эти реакция аналогичны нитрозированию
положения
карбонильных соединений (стр. 255).
2. Реакции нитронат-анионов. Продукты депротонирования нитроалканов – нитронат-анионы (736) – являются амбидентными нуклеофилами: они могут проявлять свойства как О-, так и С-нуклеофилов.
 A.
Нитронат-анионы
в реакциях нуклеофильного замещения
(алкилирования).
Нитронат-анионы могут выступать в
качестве нуклеофильных реагентов в
SN-реакциях;
в качестве субстратов используют
галогенпроизводные или тозилаты. При
этом возможно как О-, так и С-алкилирование:
A.
Нитронат-анионы
в реакциях нуклеофильного замещения
(алкилирования).
Нитронат-анионы могут выступать в
качестве нуклеофильных реагентов в
SN-реакциях;
в качестве субстратов используют
галогенпроизводные или тозилаты. При
этом возможно как О-, так и С-алкилирование:
В первом случае образуются эфиры аци-форм (нитроновые эфиры) (739); во втором - алкилированные нитросоединения (740). Препаративно легче получать продукты О-алкилирования; для этого, например, удобно использовать взаимодействие серебряных солей нитроновых кислот с алкилиодидами:
R1-CH=NOOAg + R2-J R1-CH=NOOR2 + AgJ
Продукты О-алкилирования – нитроновые эфиры – используются в органическом синтезе в ряде оригинальных превращений, приводящих, в частности, к синтезу гетероциклических соединений.
Напротив, С-алкилирование нитроалканов сталкивается с рядом трудностей, что ограничивает его синтетическое использование.
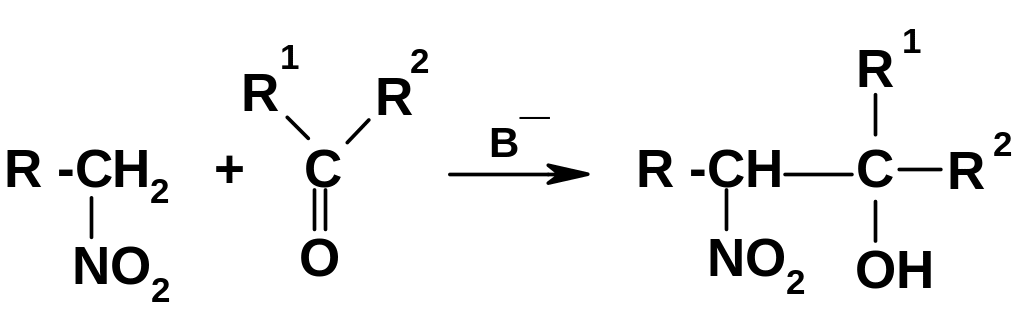
Б. Нитронат-анионы в реакциях нуклеофильного присоединения. В присутствии оснований первичные и вторичные нитросоединения могут выступать как метиленовые компоненты в реакциях конденсации с карбонильными соединениями и в реакции Михаэля. Истинными реагентами здесь являются нитронат-анионы, образующиеся из нитросоединений под действием оснований; в этих реакциях нитронат-ионы являются С-нуклеофилами, т.е. реагируют мягким центром, потому что их реакционные партнеры являются мягкими кислотами.
 а.
Взаимодействие
с карбонильными соединениями:
а.
Взаимодействие
с карбонильными соединениями:
Реакция и по схеме и по механизму аналогична реакции альдольной конденсации; нитросоединение является метиленовой компонентой, которая под действием основания генерирует нитронат-анион, присоединяющийся по группе С=О карбонильной компоненты. В качестве оснований используют щелочи, алкоголяты и карбонаты щелочных металлов, третичные амины и другие. Продуктами реакции являются нитроспирты. Данную реакцию иногда называют реакцией Генри [точнее – реакцией Анри, т.к. Л. Анри (L. Henry) ,был французским химиком].
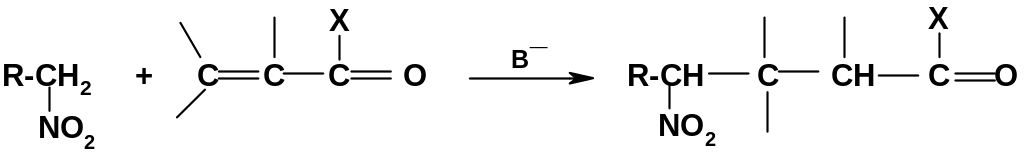 б.
Присоединение
по Михаэлю:
б.
Присоединение
по Михаэлю:
Нитросоединения могут в присутствии оснований присоединяться к ненасыщенным карбонильным соединениям (Х = Н, Alk, Ar), сложным эфирам (Х = OR1), нитрилам (СN вместо СО-Х). Реакция протекает по механизму обычной реакции Михаэля: нитронат-анион, образующийся из нитросоединения под действием основания, присоединяется по связи С=С, сопряженной с электроноакцепторной группой.
IV. Реакции связи С=С в ненасыщенных нитросоединениях. Как уже упоминалось, связь С=С, сопряженная с нитрогруппой [см. соединения (737)], способна присоединять нуклеофилы; реакции идут по схеме 1,4-присоединения. Здесь наблюдается прямая аналогия со свойствами ненасыщенных карбонильных соединений. В качестве нуклеофильных реагентов могут использоваться, например, амины и металлорганические соединения:
З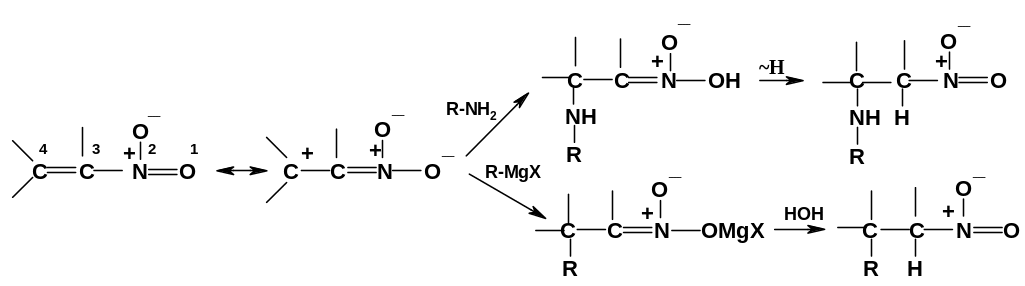 аметное
синтетическое значение имеют реакции
присоединения к ненасыщенным
нитросоединениям СН-кислот (реакции
Михаэля). В качестве СН-кислот используют
метиленактивные соединения, такие, как
1,3-дикетоны, ацетоуксусный и малоновый
эфиры (А); могут использоваться также
первичные и вторичные нитросоединения
(Б):
аметное
синтетическое значение имеют реакции
присоединения к ненасыщенным
нитросоединениям СН-кислот (реакции
Михаэля). В качестве СН-кислот используют
метиленактивные соединения, такие, как
1,3-дикетоны, ацетоуксусный и малоновый
эфиры (А); могут использоваться также
первичные и вторичные нитросоединения
(Б):
Р еакции
протекают в присутствии оснований; они
приводят к получению нитросоединений
с более сложным углеродным скелетом.
Вариант Б, в котором нитросоединения
являются и донорами и акцепторами в
реакции Михаэля, является одним из
наиболее удобных способов получения
ди- и полинитросоединений.
еакции
протекают в присутствии оснований; они
приводят к получению нитросоединений
с более сложным углеродным скелетом.
Вариант Б, в котором нитросоединения
являются и донорами и акцепторами в
реакции Михаэля, является одним из
наиболее удобных способов получения
ди- и полинитросоединений.
