
- •Глава х. Нитросоединения
- •X.1. Алифатические нитросоединения
- •Свойства
- •I. Таутомерия нитросоединений.
- •II.Реакции с участием нитрогруппы.
- •III. Реакции положения к нитрогруппе.
- •X.2. Ароматические нитросоединения (нитроарены)
- •I. Реакции нитрогруппы.
- •Глава XI..Диазосоединения
- •XI.1. Соли арилдиазония
- •Химические свойства солей диазония
- •XI.1.1.Реакции, сопровождающиеся выделением азота ( реакции замещения диазониевой группы)
- •X I.1.2. Реакции, не сопровождающиеся выделением азота
- •XI.2. Диазоалканы
В предыдущих разделах рассматривались соединения с кратными связями углерод-гетероатом. Далее будут рассмотрены соединения с кратными связями между гетероатомами (связями азот-азот и азот-кислород)
.
Глава х. Нитросоединения
Нитросоединения содержат функциональную группу NO2 – нитрогруппу.
Нитрогруппа представляет собой биполярную структуру, в которой атом азота заряжен положительно, а отрицательный заряд делокализован между двумя атомами кислорода:
Н итросоединения
могут содержать одну, две и более
нитрогрупп. Известны нитропроизводные
всех типов углеводородов – алканов,
алкенов, аренов, а также гетероциклические
нитропроизводные. В отличие от многих
ранее рассмотренных типов соединений,
нитросоединения редко встречаются в
природе; тем не менее, нитрогруппа в
некоторых случаях придает соединениям
заметную биологическую, в том числе
фармакологическую активность
(нитросодержащие препараты нитроксалин,
нифедипин и др.).
итросоединения
могут содержать одну, две и более
нитрогрупп. Известны нитропроизводные
всех типов углеводородов – алканов,
алкенов, аренов, а также гетероциклические
нитропроизводные. В отличие от многих
ранее рассмотренных типов соединений,
нитросоединения редко встречаются в
природе; тем не менее, нитрогруппа в
некоторых случаях придает соединениям
заметную биологическую, в том числе
фармакологическую активность
(нитросодержащие препараты нитроксалин,
нифедипин и др.).
При рассмотрении нитросоединений целесообразно разделить их на два типа: 1. Алифатические (и алициклические) нитросоединения; 2. Ароматические нитросоединения.
X.1. Алифатические нитросоединения
Получение.
Алифатические нитросоединения получают, в основном, двумя путями: нитрованием углеводородов и замещением атомов галогена в галогенпроизводных на нитрогруппу.
Оба пути рассматривались ранее: нитрование алканов рассмотрено на стр. 62; нитрование циклоалканов идет аналогично. Взаимодействие галогенпроизводных с нитритами металлов (нитрит-анионом) рассмотрено на стр. 160; можно еще раз напомнить, что нитрит-анион является амбидентным анионом, и для того, чтобы получить именно нитросоединение (а не эфир азотистой кислоты), необходимо проводить реакцию по механизму SN2, лучше всего в диполярных апротонных растворителях (ДМФА, ДМСО).
Кроме того, иногда для получения нитросоединений используют окисление первичных аминов и оксимов карбонильных соединений.
Свойства
Физические свойства. Низшие нитроалканы – бесцветные жидкости; нитроалкены – желтоватые жидкости с острым запахом. Увеличение количества нитрогрупп придает соединениям взрывчатые свойства ( например, динитрометану). Нитрогруппа легко обнаруживается в ИК спектрах, давая две характеристических полосы поглощения.
Химические свойства
Химическое поведение нитросоединений определяется прежде всего характером нитрогруппы. Исходя из представленного выше электронного строения нитрогруппы, можно сделать вывод о специфических особенностях нитросоединений:
 1.
Нетрудно заметить определенную аналогию
между нитрогруппой и карбоксилат-анионом:
1.
Нетрудно заметить определенную аналогию
между нитрогруппой и карбоксилат-анионом:
В обеих группах отрицательный заряд делокализован; поэтому нитрогруппа, так же, как и карбоксилат-анион, пассивна в реакциях с нуклеофилами; действительно, в гипотетическом соединении (735) – продукте присоединения к нитрогруппе реагента типа НY – делокализация теряется.
2. Благодаря положительному заряду на атоме азота, нитрогруппа проявляет сильные электроноакцепторные свойства – более значительные, чем карбонильная группа; она обладает значительным –I-, а в случае сопряжения – значительным –М- эффектом. Отсюда:
 А.
Группы
СН2
или СН в положении
к нитрогруппе проявляют свойства
СН-кислот,
причем в заметно большей степени, чем
аналогичные группы в положении
к группе С=О карбонильных соединений.
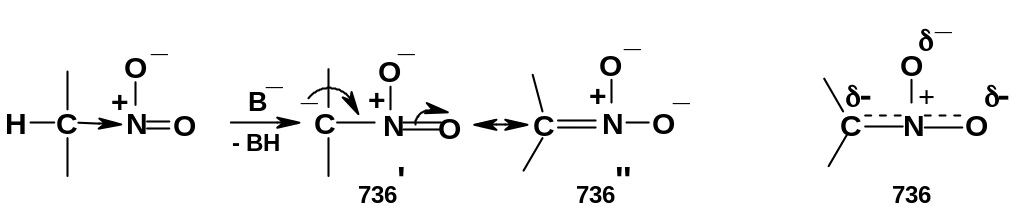
Это становится ясным при рассмотрении
структуры сопряженного основания (736),
в котором наблюдается делокализация
электронной плотности, причем структура
(736’’) является устойчивой:
А.
Группы
СН2
или СН в положении
к нитрогруппе проявляют свойства
СН-кислот,
причем в заметно большей степени, чем
аналогичные группы в положении
к группе С=О карбонильных соединений.
Это становится ясным при рассмотрении
структуры сопряженного основания (736),
в котором наблюдается делокализация
электронной плотности, причем структура
(736’’) является устойчивой:
Мононитроалканы по кислотности сравнимы с фенолами, а динитрометан СН2(NO2)2 по силе сравним с муравьиной кислотой.
 Б.
Если
с нитрогруппой сопряжена связь С=С
(737), то электронная плотность этой связи
понижена,
и она легко реагирует с нуклеофильными
реагентами (нуклеофильная атака на С2,
резонансная структура 737’’):
Б.
Если
с нитрогруппой сопряжена связь С=С
(737), то электронная плотность этой связи
понижена,
и она легко реагирует с нуклеофильными
реагентами (нуклеофильная атака на С2,
резонансная структура 737’’):
3. В нитрогруппе азот находится в высокой степени окисления; поэтому для нитрогруппы характерны реакции восстановления.
К наиболее важным химическим свойствам алифатических нитросоединений относятся: I. Таутомерия; II. Реакции нитрогруппы; III. Реакции α-положения к нитрогруппе; IV. Реакции связи С=С в α,β-ненасыщенных нитросоединениях.
