- •Лабораторная работа № 2 Определение интегральной теплоты растворения соли
- •Калориметрическая установка
- •1. Определение постоянной калориметра
- •Значения удельной теплоемкости для некоторых веществ
- •Порядок проведения опыта
- •3. Определение изменения температуры (t)
- •4. Вычисления
- •5. Определение теплоты растворения неизвестной соли
- •Порядок проведения опыта
- •Лабораторная работа № 8 давление насыщенного пара индивидуальных жидкостей
- •Экспериментальная часть
- •Лабораторная работа № 9 каталитическое разложение перекиси водорода на платиновом катализаторе в присутствии различных сред
- •Лабораторная работа № 16 Определение электропроводности слабых электролитов
- •Экспериментальная часть
- •1. Методика измерений
- •2. Определение постоянной сосуда
- •3. Измерение электропроводности слабого электролита
- •Работа № 20 Электрохимические цепи
- •Электрод Раствор
- •Лабораторная работа № 25 Исследование равновесия: двухкомпонентный раствор пар (полностью смешивающиеся жидкости)
Лабораторная работа № 9 каталитическое разложение перекиси водорода на платиновом катализаторе в присутствии различных сред
Краткая теория
Химическая кинетика - учение о скоростях химических реакций. Скорость протекания химических реакций имеет громадное практическое значение, поэтому определение ее является важной задачей экспериментатора. Факты показывают, что скорость химической реакции зависит от многих причин, в частности, от концентрации веществ, температуры, катализатора, а также часто зависит от присутствия веществ, которые с первого взгляда не имеют никакого отношения к реакции.
К математическому выражению скорости реакции можно подойти следующим путем.
Пусть концентрация вещества А в какой-либо
реакции в момент времени t0 равна
C0, с ходом реакции эта концентрация
уменьшается, и пусть к моменту времени
t1 она равна C1. За промежуток
времени t1-t0 произошло
изменение концентрации C0-C1-
(падение), тогда отношение
![]() является средней скоростью реакции за
данный промежуток времени. Если промежуток
времени мал, то изменение концентрации
также мало и равно С,
и соответственно средняя скорость
равна:
является средней скоростью реакции за
данный промежуток времени. Если промежуток
времени мал, то изменение концентрации
также мало и равно С,
и соответственно средняя скорость
равна:
![]()
Перейдя к пределу, в общем случае,
получим:
![]() ,
где знак (+) – относится к изменению
концентрации продуктов реакции, а знак
(–) – к изменению концентрации исходных
веществ. Это есть математическое
выражение для истинной скорости
реакции в данный момент времени: другими
словами, истинная скорость реакции
выражается производной от концентрации
реагирующего вещества по времени.
,
где знак (+) – относится к изменению
концентрации продуктов реакции, а знак
(–) – к изменению концентрации исходных
веществ. Это есть математическое
выражение для истинной скорости
реакции в данный момент времени: другими
словами, истинная скорость реакции
выражается производной от концентрации
реагирующего вещества по времени.
Основной постулат химической кинетики гласит:
истинная скорость химической реакции прямо пропорциональна произведению степенных функций от концентраций реагирующих веществ, т.е., например, для реакции:
а A + в B + ... n N + m M + ...
![]() ;
(1 )
;
(1 )
где К - коэффициент пропорциональности, и - степени, даваемые стехиометрическими коэффициентами а и в.
Реакции различаются молекулярностью и порядком.
Молекулярность реакции определяется количеством молекул, участвующих в элементарном акте химической реакции. Например, мономолекулярными реакциями называются те, в которых один только вид молекул претерпевает превращение.
Порядок реакции определяется суммой показателей степеней при концентрациях в уравнении основного постулата химической кинетики для данной реакции (n = + , где и - частные порядки реакции по веществу А и В соответственно).
Примером реакции первого порядка является реакция разложения перекиси водорода.
Если концентрация H2O2 в момент времени t равна C, то скорость разложения согласно постулату кинетики будет:
![]() (2 )
(2 )
Пусть в объеме V в момент времени t0
= 0 находится а молей перекиси
водорода, тогда начальная концентрация
С0 =
![]() ,
и пусть за время t разложилось
x молей перекиси водорода, значит
к моменту времени t остается
(а-x) молей перекиси. Тогда
,
и пусть за время t разложилось
x молей перекиси водорода, значит
к моменту времени t остается
(а-x) молей перекиси. Тогда
![]() ,
откуда:
,
откуда:
![]() ,
а после некоторых преобразований получим
,
а после некоторых преобразований получим
![]() ,
и, подставив в формулу (2) найдем
,
и, подставив в формулу (2) найдем
![]() ,
разделяя переменные и проинтегрировав,
получим:
,
разделяя переменные и проинтегрировав,
получим:
![]() ;
откуда
;
откуда ![]() ,
,
так как в момент времени t = 0 x= 0 то const = - ln a, откуда имеем
![]() .
.
Учитывая тот факт, что константу скорости необходимо находить в любые промежутки времени, последнее уравнение можно переписать
![]() .
.
Переходя к десятичным логарифмам получим:
![]() (3)
(3)
где: а - объем, который мог занять кислород при полном разложении
перекиси водорода, взятой для опыта;
t - время в минутах;
x1- объем кислорода, выделившегося за время t1;
x2 - объем кислорода, выделившегося за время t2.
Величину а рассчитывают исходя из концентрации перекиси водорода по уравнению реакции:
2Н2О2 2Н2О + О2 (4)
Если концентрация Н2О2 (например) равна 13,2 моль/л, это значит, что в 1000 мл раствора содержится 13,2 моль Н2О2. Так как мы использовали 0,3; 0,4 или 0,5 мл Н2О2, то необходимо рассчитать, сколько это составляет в молях.
Так как, из 2 моль Н2О2 по
уравнению (4) выделяется 1 моль О2
(22,4103 мл) [при
н.у.], то необходимо рассчитать, сколько
мл (V0,
при н.у.) О2 выделится из
использованного для реакции количества
Н2О2 (0,3 или 0,5 мл). Затем, объем
кислорода необходимо привести к реальным
условиям: ![]() ,
,
где полученное значение V и будет соответствовать величине а.
Целью настоящей работы является проверка того факта, что реакция разложения перекиси водорода следует выше описанному закону.
Перекись водорода в чистом виде – это бесцветная жидкость, почти в 1,15 раза плотнее, чем вода. Она является сильным окислителем.
Кислород, который она выделяет, превращает сернистую кислоту в серную, фосфористую в фосфорную. Органические кислоты - щавелевая, молочная сгорают от перекиси. Но самый сильный окислитель оказывается очень сильным восстановителем.
Кислород, выделяющийся при разложении перекиси, находится в атомном состоянии. Устойчивая форма кислорода - молекулярная (из двух атомов). Поэтому каждый атом кислорода, образовавшийся при разложении перекиси, стремится найти себе пару, второй кислородный атом. Именно поэтому перекись и взаимодействует с окисью серебра, отбирая у нее кислород и восстанавливая металлическое серебро. Перекись водорода разлагается от действия многих веществ: серебра, золота, платины, окиси железа. По-разному она разлагается и в различных средах: интенсивно в щелочных, менее интенсивно - в кислых средах.
Реакция идет по схеме:
1. Pt + H2O2 = Pt* O+H2O
2. Pt* O+H2O2=Pt+H2O+O2,
где Pt*O- возбужденный оксид
Первая стадия заключается в образовании возбужденного оксида активной формы этой реакции. Если на этот возбужденный оксид вскоре попадает молекула перекиси, то реакция протекает по второй стадии, определяющей скорость реакции, но в активном возбужденном состоянии оксид платины находится непродолжительное время.
Если на него вскоре после образования не попадет молекула Н2О2 , то связь между кислородом и платиной упрочняется, что по существу может привести к своеобразному отравлению таких активных центров. Таким образом, в первое время на платине реакция разложения перекиси водорода в серной кислоте протекает с большой скоростью на чистой поверхности, благодаря образованию и распаду некоторых возбужденных оксидов. Но по мере протекания реакции накапливается количество малоактивных прочных оксидов платины и ее активность падает. Значительно активнее идет реакция в щелочной среде. Объяснить данное явление можно наличием большой концентрации гидроксильных ионов, которые, как известно, увеличивают скорость разложения перекиси водорода. Слабее реакция идет в H2SO4 и совсем слабо в HСl. Выполнение работы
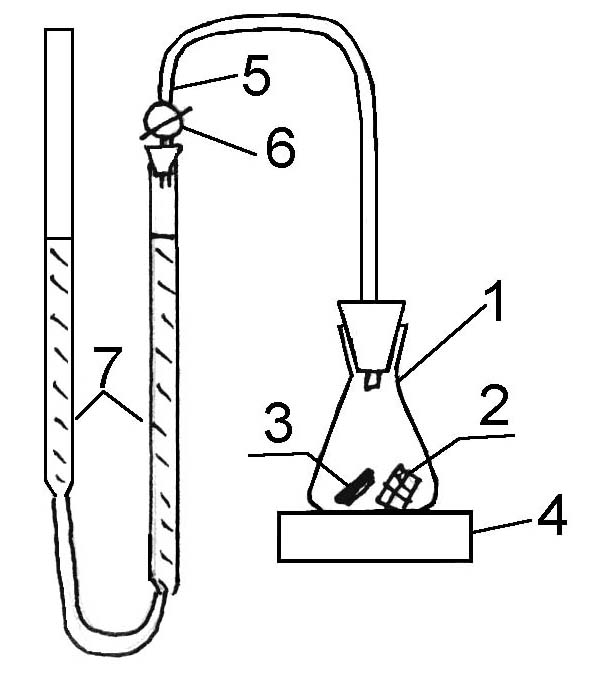
Во избежание побочных факторов, влияющих на скорость разложения перекиси, в частности, явление диффузии, работу выполняют при интенсивном перемешивании на магнитной мешалке. Реакционный сосуд имеет следующий вид (рис.1):
|
Рис.1
1. Коническая колба 2. Платиновая сетка 3. Мешалка 4. Аппарат для перемешивания 5. Газоотводная трубка 6. Трехходовой кран 7. Две бюретки, соединенные резиновой трубкой |
Перед началом работы реакционный сосуд с помещенной в него платиновой сеткой, мешалкой и 25 мл рабочего раствора соединяют в соответствии с рисунком и проверяют на герметичность. Для этого приводят давление внутри системы к атмосферному, уровняв на произвольной высоте жидкость в бюретках, поворачивают кран (6) так, чтобы пространство над жидкостью в колбе (1) сообщалось с бюреткой (7) и одну из бюреток то поднимают, то опускают. Если обеспечена достаточная герметичность, уровень жидкости в другой бюретке не должен смещаться.
Проверив систему на герметичность, при кране, сообщающемся с атмосферой, внести в реакционных сосуд от 0,3 до 0,5 мл перекиси водорода (по заданию преподавателя), включить мешалку одновременно с секундомером. Через минуту перекрыть кран, впуская кислород в бюретку и проводить замеры выделившегося кислорода при разложении перекиси водорода через каждую минуту.
Для измерения истинного объема выделившегося кислорода вторую бюретку опускать относительно первой. Опыты проводить в строгой последовательности в рабочих растворах:
1. 15 мин. в 1н H2SO4.
2. 15 мин. в 1н KOH
3. 12 мин. в 1н HСl
Результаты во время опытов записывать в таблицу:
Время, мин. |
Объем кислорода, мл |
||
в H2SO4 |
в KOH |
в HCl |
|
1 2 - -- 15 |
|
|
|
Перед каждой сменой рабочего раствора реакционный сосуд вместе с платиновой сеткой тщательно промыть дистиллированной водой (сливать растворы в кристаллизатор).
Вычисления.
Константа скорости рассчитывается по формуле (3) для каждого опыта с интервалом в 5 мин.
Находят 5 значений константы для каждой среды и вычисляют среднее значение К.
Рассчитать период полураспада перекиси водорода в каждой среде для реакций первого порядка:
![]() ,
где ln2 = 0,692
,
где ln2 = 0,692
По окончании работ промыть колбу водой и оставить Pt и мешалку в воде.
Отчет должен содержать:
Краткую теорию работы.
Методику выполнения работы.
Данные опытов.
Расчет констант скорости реакции в различных средах.
График зависимости
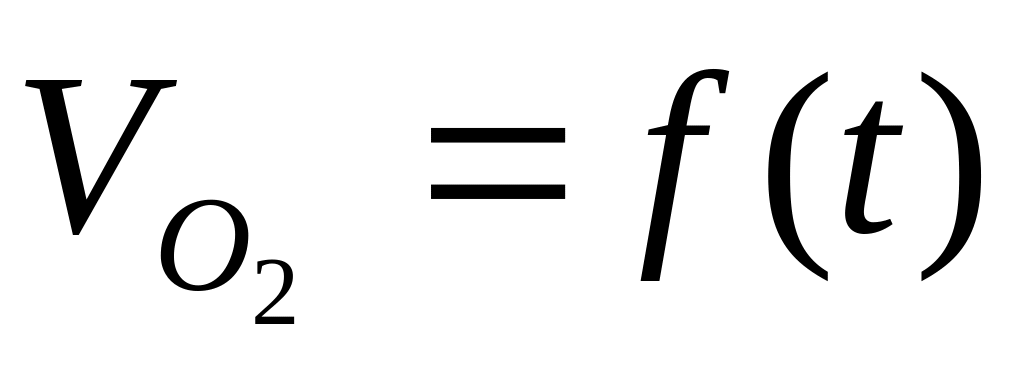 для всех сред.
для всех сред.Расчет периода полураспада.
Выводы.
Вопросы к работе
1. Скорость химической реакции, скорость реакции по данному веществу, связь между ними. Факторы, влияющие на скорость химической реакции.
2. Константа скорости реакции, ее физический смысл и размерность. Вывод выражений для констант скорости необратимых реакций нулевого, первого, второго и n-ного порядков.
3. Молекулярность и порядок реакции. Псевдопорядок. Экспериментальные методы определения порядка реакции.
4. Выражением какой зависимости является кинетическая кривая? Представьте графически эту зависимость для исходного вещества, если реакция имеет нулевой, первый, второй порядок.