- •Лабораторная работа № 2 Определение интегральной теплоты растворения соли
- •Калориметрическая установка
- •1. Определение постоянной калориметра
- •Значения удельной теплоемкости для некоторых веществ
- •Порядок проведения опыта
- •3. Определение изменения температуры (t)
- •4. Вычисления
- •5. Определение теплоты растворения неизвестной соли
- •Порядок проведения опыта
- •Лабораторная работа № 8 давление насыщенного пара индивидуальных жидкостей
- •Экспериментальная часть
- •Лабораторная работа № 9 каталитическое разложение перекиси водорода на платиновом катализаторе в присутствии различных сред
- •Лабораторная работа № 16 Определение электропроводности слабых электролитов
- •Экспериментальная часть
- •1. Методика измерений
- •2. Определение постоянной сосуда
- •3. Измерение электропроводности слабого электролита
- •Работа № 20 Электрохимические цепи
- •Электрод Раствор
- •Лабораторная работа № 25 Исследование равновесия: двухкомпонентный раствор пар (полностью смешивающиеся жидкости)
Лабораторная работа № 25 Исследование равновесия: двухкомпонентный раствор пар (полностью смешивающиеся жидкости)
Цель работы – построение диаграммы равновесия жидкость – пар бинарной системы в координатах: температура кипения – состав. Для этого следует определить температуры кипения растворов и чистых веществ, а также состав пара, находящегося в равновесии с жидкостью определенного состава при температуре кипения. Состав жидкой смеси и равновесного с ней пара, как правило, не совпадают.
Экспериментально установлено, что пар обогащается более летучим компонентом. Эта закономерность была выведена Д.П. Коноваловым и известна как первый закон Коновалова:
а) повышение относительного содержания данного компонента в жидкой фазе всегда увеличивает относительное содержание его и в парах;
б) в двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения смеси при данном давлении.
Так как при кипении раствора после образования даже небольшого количества пара состав жидкости изменяется и для того, чтобы эти изменения были, возможно, меньшими, жидкость доводится до кипения в сосуде, снабженном обратным холодильником. Это позволяет получить равновесную систему из кипящей жидкости и насыщенного пара без потери компонентов исходной смеси. Кроме того, для нахождения состава насыщенного пара над исходной жидкостью пар необходимо отбирать сразу, как только жидкость закипит. Проводя нагревание жидких смесей различного состава и отбирая от каждой из них “первый пар”, можно после определения составов конденсатов построить в координатах “температура – состав” кривые кипения и конденсации.
Порядок выполнения работы
1. В восьми чистых и сухих колбах с притертыми пробками на 20 мл приготовить бинарные органические растворы с различным объемным содержанием, например:
Таблица №1.
№ колбы |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
Объемное содержание компонента А, % |
100 |
90 |
80 |
70 |
60 |
50 |
40 |
30 |
20 |
10 |
0 |
Объемное содержание компонента В, % |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
*Род жидкостей, число и варианты смесей указывается преподавателем.
Каждая колба должна содержать по 10 мл смеси, кроме первой и последней (100 и 0% вещества А).
2. Измерить показатели преломления чистых жидкостей ирастворов известного объемного состава, построить кривую зависимости показателя преломления от состава (калибровочную кривую).
Во многих случаях можно считать, что показатель преломления линейно зависит от состава, выраженного в объемных процентах. Тогда достаточно измерить показатели преломления двух чистых жидкостей и соединить точки на графике прямой. Однако на диаграммах равновесия жидкость – пар состав обычно выражают не в объемных, а массовых или молярных процентах.
Для перевода объемных процентов в молярные надо найти количество (число молей) каждого компонента:
![]() ,
,
где
![]() -
объем компонента i в
растворе, а
-
объем компонента i в
растворе, а
![]() - молярный объем этого компонента в
чистом виде (
- молярный объем этого компонента в
чистом виде (![]() молярная
масса,
молярная
масса,
![]() -
плотность, г/см3).
-
плотность, г/см3).
Молярную долю компонента в растворе (Х) находят по уравнению:
 (I)
(I)
Можно сделать такой пересчет для нескольких произвольных концентраций (например, для состава 20, 40, 60, 80 об.%), а затем, найдя по прямой показатели преломления, соответст вующие выбранным составом, нанести против них вычисленные значения состава, выраженного уже в молярных процентах, и соединить их кривой.
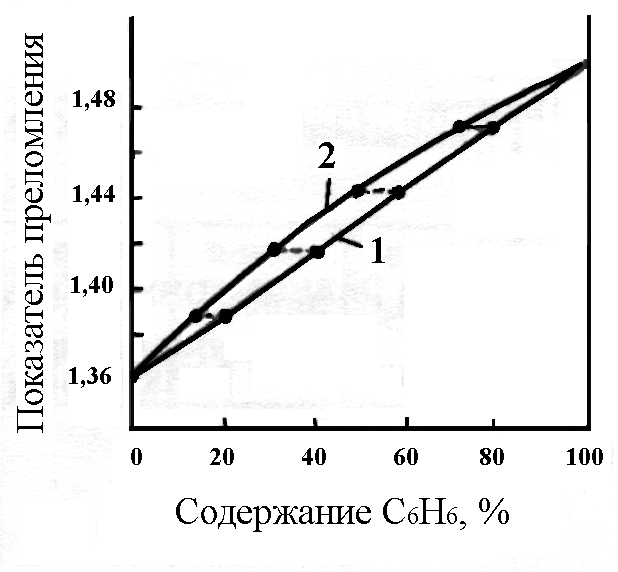
Ниже, в качестве примера, приведены данные для расчета состава в мольных процентах и график зависимости показателя преломления жидкости от состава для системы этанол – бензол.
Таблица №2.
вещество |
показатель преломления nD |
плотность , г/см3 |
молярный объем V, см3/моль |
С2Н5ОН |
1,3613 |
0,7895 |
58,33 |
С6Н6 |
1,5011 |
0,8790 |
88,80 |
По уравнению (I) при составе раствора 20 об.% С6Н6 и 80 об.% С2Н5ОН находим мольную долю бензола:
![]() .
.
Аналогично производят пересчет других составов,
Таблица №3.
-
Объем С6Н6, см3
2
4
6
8
Молярная доля С6Н6, Х
0,141
0,305
0,496
0,724
а затем наносят их на калибровочный график (рис. 1).
|
Рис. 1. Зависимость показателя преломления раствора С2Н5ОН – С6Н6 от содержания С6Н6, выраженного объемных процентах (1) и мольных процентах (2). |
3. Определение температуры кипения смесей и состава пара.
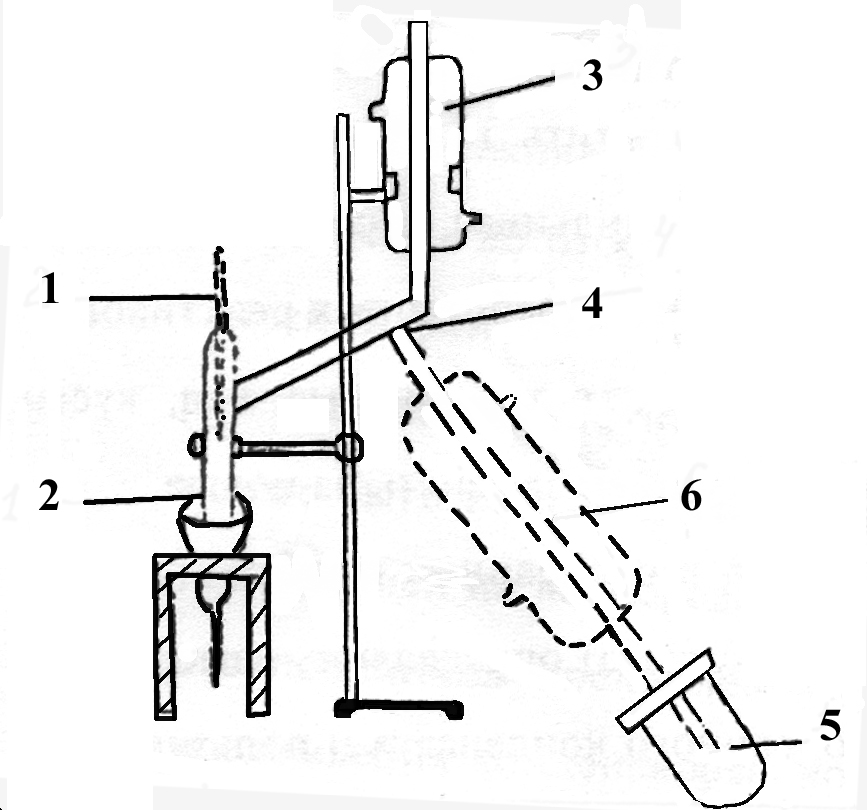
Для определения температуры кипения смесей служит установка, изображенная на рис. 2.
|
Рис. 2. Прибор для определения температуры кипения жидких смесей. 1 – сосуд для кипячения; 2 – термометр; 3 – обратный холодильник; 4 – отверстие для отбора конденсата.
|
Установка состоит из сосуда для кипячения (1), термометра (2), холодильника (3). Для отбора сконденсированного пара служит отверстие (4), закрытое пришлифованной стеклянной пробкой.
В сосуд для кипячения налить 10 мл смеси определенного состава и поместить мелкие кусочки фарфоровых трубок для достижения равномерного кипения и во избежание перегрева жидкости. После этого сосуд закрыть стеклянной пробкой с термометром так, чтобы ртутный шарик был погружен в жидкость. В обратный холодильник пустить воду, сосуд опустить в водяную баню и медленно ее нагревать. Раствор следует нагревать до установления постоянной температуры кипения, записать ее. Из отверстия (4), открыв пробку, которую следует немедленно закрыть хорошо подогнанной пробкой. После этого продолжить кипячение в течение 2-х минут и вновь записать температуру кипения при этом температура не должна отличаться от температуры до взятия пробы более, чем на 10. Затем нагревание следует прекратить и, после охлаждения сосуда, его отсоединить от холодильника, а содержимое вылить специальный сосуд для слива отработанных реактивов.
Такой же опыт провести с остальными смесями, куски фарфора перед каждым нагреванием заменять на новые.
Содержание компонентов в отобранных пробах (т.е. состав пара над кипящей жидкостью) определяют, измеряя показатель преломления собранного конденсата и пользуясь калибровочной кривой зависимости показателя преломления от состава. Измерения следует проводить при той же температуре, при которой были произведены измерения для построения калибровочной кривой. Призмы рефрактометра необходимо перед каждым определением осторожно осушить фильтровальной Результаты опытов заносятся в таблицу.
Таблица №4.
№ |
Температура кипения |
Показатель преломления |
Состав, % |
||||
пробы |
до отбора пробы |
после отбора пробы |
средняя |
жидкость |
конденсат |
жидкости |
пара |
1 2 3
|
|
|
|
|
|
|
|
На основании экспериментальных данных построить следующие графики:
калибровочная кривая показатель преломления – состав для жидких смесей;
график в координатах температура кипения – состав в %, причем нижняя ветвь графика строится по температурам кипения до отбора пробы и по процентному составу смесей. Верхняя кривая строится по средним температурам кипения и процентному составу пара. Этот состав не может быть измерен непосредственно. Его находят интерполяцией на калибровочной кривой, беря на ней вместо показателя преломления жидкой смеси показатель преломления конденсированного пара, и определяют соответствующий процентный состав конденсата;
график в координатах состав пара – состав жидкости.
Все три графика целесообразно чертить на одном листе миллиметровой бумаги, один под другим, сохраняя абсциссу (состав) в одном и том же масштабе.
Меры предосторожности
1. Нагревание прибора при определении температуры кипения должно производиться на закрытой электрической плитке.
2. Кипение жидкости должно быть равномерным (что достигается введением пористой керамики в реакционную колбу) и не слишком бурным.
3. Введение жидкости в прибор, отбор пробы конденсата и удаление остатка жидкости из прибора можно производить, лишь отключив электроплитку.
4. Работу следует вести под тягой.
Вопросы к работе:
1. Дайте определение идеального раствора. Каковы его основные признаки и при каких условиях он образуется?
2. Чем обусловлены положительные и отрицательные отклонения от закона Рауля.?
3. Законы Коновалова-Гиббса. Поясните эти законы на диаграммах состав - температура кипения и состав - давление.
4. Можно ли рассчитать состав пара, находящегося в равновесии с идеальным раствором?
5. В чем состоит и для чего используется “правило рычага”?
Литература
Курс физической химии (под. ред. Герасимова Я.И.) М.: Химия, 1969. Т.1.
Курс физической химии (под ред. Краснова К.С.) кн.1. М., Высш. шк., 1995.
Краткий справочник физико-химических величин под ред. А.А. Равделя и А.М.Пономаревой. Л., Химия, 1983.
Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л., Химия.