
- •Глава 1. Химии белков
- •Глава 2. Химия белков
- •Глава 5. Химия углеводов
- •Глава 8. Гормоны .... 248
- •Глава 6. Химия липидов 188
- •Глава 7. Витамины ... 204
- •Глава 9. Биомембраны и биоэнергетика
- •Глава 10. Метаболизм уг леводов
- •Глава 11. Пидов . .
- •Глава 14. Биосинтез белка 509
- •Глава 15. Взаимосвизь про цессов обмена веществ в ор ганизме 545
- •Глава 13. Обмен сложных
- •Глава 16. Печень .... 551
- •Глава 17. Кровь 567
- •Глава 18. Почки и моча 608
- •Глава 19. Нервиаи ткань 625
- •Глава 20. Мышечнаи ткань 645
- •Глава 21. Соединительная
- •Введение
- •Глава 1 химия белков
- •I 1.4. Аминокислотный состав некоторых природных белков, в процентах
- •Глава 2 химия сложных белков
- •Глава 3 химия нуклеиновых кислот
- •Глава 4 ферменты
- •Глава 5 химия углеводов
- •Глава 6
- •Глава 7 витамины
- •Жирорастворимые витамины
- •Водорастворимые витамины
- •Глава 8 гормоны
- •1. Тиролиберип (Пиро-Глу-Гис-Про-nHj):
- •2. Гонадолиберин является декапептидом, состоящим из 10 аминокислот в последовательности:
- •Глава 9 биомембраны и биоэнергетика
- •Глава 10 метаболизм углеводов
- •1,3 Бисфосфоглиц9рэт
- •Глава 11 метаболизм липидов
- •2 Ацетил-КоА
- •7 Ноос-сНг—c-ch3-co-
- •Глава 12 обмен простых белков
- •Глава 18 почки и моча
- •Глава 19 нервная ткань
- •В процентах от общих липидов
- •Глава 20 мышечная ткань
- •Глава 21 соединительная ткань
- •Глава 22 костнаяткань
Глава 1 химия белков
Мир самого сложного —жизнь. Н.Н. Семенов
Живой организм характеризуется высшей степенью упорядоченности составляющих его ингредиентов и уникальной структурной организацией, обеспечивающей как его фенотипические признаки, так и многообразие биологических функций. В этом структурно-функциональном единстве организмов, составляющем сущность жизни, белки (белковые тела) играют важнейшую роль, не заменяемую другими органическими соединениями.
Белки —это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Название «протеины» (от греч. protos—первый, важнейший), по-видимому, более точно отражает первостепенное биологическое значение этого класса веществ. Принятые в отечественной литературе термины «белки» и «белковые вещества» связаны с обнаружением в тканях животных и растений веществ, имеющих сходство с белком куриного яйца. В наше время, когда абсолютно достоверно установлено, что наследственная информация сосредоточена в молекуле ДНК клеток любых живых организмов, не вызывает сомнения, что только белки являются теми молекулярными инструментами, при помощи которых реализуется генетическая информация. Без белков, в частности ферментов, ДНК не может реплицироваться, не может самовоспроизводиться, т.е. лишена способности передавать генетическую информацию.
Живая природа характеризуется рядом свойств, отличающих ее от неживой природы, и почти все эти свойства связаны с белками. Прежде всего для живых организмов характерны широкое разнообразие белковых структур и их высокая упорядоченность; последняя существует во времени и пространстве. Удивительная способность живых организмов к воспроизведению себе подобных также связана с белками. Сократимость, движение — непременные атрибуты живых систем —имеют прямое отношение к белковым структурам мышечного аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т.е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков —ферментов.
Таким образом, белки (белковые вещества) составляют основу и структуры, и функции живых организмов. По образному выражению одного из основоположников молекулярной биологии Ф. Крика, белки важны прежде всего потому, что они могут выполнять самые разнообразные функции, причем с необыкновенной легкостью и изяществом. Подсчитано, что в природе примерно 1010—10м различных белков, обеспечивающих существование около 106 видов живых организмов различной сложности организации начиная от вирусов и кончая человеком. Из этого огромного количества природных белков известны точное строение и структура
19
ничтожно малой части (см. далее). Каждый организм характеризуется уникальным набором белков. Фенотипические признаки и многообразие функций обусловлены специфичностью объединения этих белков, во многих случаях в виде над- и мультимолекулярных структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
В клетке E.coli содержится около 3000 различных белков, а в организме человека насчитывается более 100000 разнообразных белков. Самое удивительное, что все природные белки состоят из небольшого числа сравнительно простых структурных блоков, представленных мономерными молекулами—аминокислотами, связанными друг с другом в полипептидные цепи. Природные белки построены из 20 различных аминокислот. Эти аминокислоты могут объединяться в самой разной последовательности, поэтому они могут образовывать громадное количество разнообразных белков. Число изомеров, которое можно получить при всевозможных перестановках указанного числа аминокислот в полипептиде, исчисляется огромными величинами. Так, если из 2 аминокислот возможно образование только двух изомеров, то уже из 4 аминокислот теоретически возможно образование 24 изомеров, а из 20 аминокислот — 2,4* 10" разнообразных белков.
Нетрудно предвидеть, что при увеличении числа повторяющихся аминокислотных остатков в белковой молекуле число возможных изомеров возрастает до астрономических величин. Ясно, что природа не может позволить случайных сочетаний аминокислотных последовательностей и для каждого вида характерен свой специфический набор белков, определяемый, как теперь известно, наследственной информацией, закодированной в молекуле ДНК живых организмов. Именно информация, содержащаяся в линейной последовательности нуклеотидов ДНК, определяет линейную последовательность остатков аминокислот в полипептидной цепи синтезируемого белка. Образовавшаяся линейная полипептидная цепь сама теперь оказывается наделенной функциональной информацией, в соответствии с которой она самопроизвольно преобразуется в определенную стабильную трехмерную структуру. Таким образом, лабильная полипептидная цепь складывается, скручивается в пространственную структуру белковой молекулы, причем не хаотично, а в строгом соответствии с информацией, содержащейся в последовательности аминокислотных остатков. Учитывая ведущую роль белков в живой природе и тот факт, что белки, составляя почти половину сухой массы живого организма, наделены удивительным разнообразием функций, изучение курса биохимии в медицинских высших учебных заведениях обычно начинают с этого класса органических веществ.
ФУНКЦИИ БЕЛКОВ
Белки выполняют множество самых разнообразных функций, характерных для живых организмов, с некоторыми из которых мы познакомимся более подробно при дальнейшем изучении курса. Ниже рассматриваются главные и в некотором смысле уникальные биологические функции белков, несвойственные или лишь частично присущие другим классам биополимеров.
Каталитическая функция. К 1995 г. было идентифицировано более 3400 ферментов. Большинство известных в настоящее время ферментов,
20
называемых биологическими катализаторами, является белками. Эта функция белков, хотя и не оказалась уникальной, определяет скорость химических реакций в биологических системах*.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода, осуществляется молекулами гемоглобина—белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином А и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Однако главную роль в этих жизненно важных процессах играют актин и миозин—специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток (расхождение хромосом в процессе митоза).
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Большое значение имеют комплексы белков с углеводами в формировании ряда секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная функция. Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не только в железах внутренней секреции, но и во многих других клетках организма (см. далее). Ряд гормонов представлен белками или полипептидами, например гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
Можно назвать еще некоторые другие жизненно важные функции белков. Это, в частности, экспрессия генетической информации, генерирование и передача нервных импульсов, способность поддерживать онкотическое
* Получены экспериментальные доказательства, что, помимо белков, ферментативной, каталитической активностью наделен и ряд других макромолекул, в частности РНК (названы рибозимами) и моно- и поликлональные антитела (абзимы)—см. главу «Ферменты».
давление в клетках и крови, буферные свойства, поддерживающие физиологическое значение рН внутренней среды, и др.
Таким образом, из этого далеко не полного перечня основных функций белков видно, что указанным биополимерам принадлежит исключительная и разносторонняя роль в живом организме. Если попытаться выделить главное, решающее свойство, которое обеспечивает многогранность биологических функций белков, то следовало бы назвать способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ. В частности, эта высокая специфичность белков (сродство) обеспечивает взаимодействие ферментов с субстратами, антител с антигенами, транспортных белков крови с переносимыми молекулами других веществ и т.д. Это взаимодействие основано на принципе биоспецифического узнавания, завершающегося связыванием фермента с соответствующей молекулой субстрата, что содействует протеканию химической реакции. Высокой специфичностью действия наделены также белки, которые участвуют в таких процессах, как дифференцировка и деление клеток, развитие живых организмов, определяя их биологическую индивидуальность.
СОДЕРЖАНИЕ БЕЛКОВ В ОРГАНАХ И ТКАНЯХ
Наиболее богаты белковыми веществами ткани и органы животных. Источником белка являются также микроорганизмы и растения. Большинство белков хорошо растворимо в воде. Некоторые органические вещества, выделенные из хряща, волос, ногтей, рогов, костной ткани и нерастворимые в воде, также были отнесены к белкам, поскольку по своему химическому составу оказались близки к белкам мышечной ткани, сыворотки крови, яйца.
В мышцах, легких, селезенке, почках на долю белков приходится более 70—80% от сухой массы, а во всем теле человека—45% от сухой массы (табл. 1.1)*. В отличие от животных тканей в растениях содержится значительно меньше белков (табл. 1.2).
Таблица 1.1. Содержание белков в органах н тканях человека
|
Содержание |
|
Содержание |
||
|
бежо |
в, 7о |
|
белков, % |
|
Органы и ткани |
от сухой массы |
от общего коли- |
Органы и ткани |
от сухой массы |
от общего коли- |
|
|
чества |
|
|
чества |
|
|
белка |
|
|
белка |
|
|
тела |
|
|
тела |
Кожа |
63 |
11,5 |
Почки |
72 |
0,5 |
Кости (твердые ткани) |
20 |
18,7 |
Поджелудочная |
47 |
0,1 |
Зубы (твердые ткани) |
18 |
0,1 |
железа |
|
|
Поперечнополосатые |
80 |
34,7 |
Пищеварительный |
63 |
1,8 |
мышцы |
|
|
тракт |
|
|
Мозг и нервная ткань |
45 |
2,0 |
Жировая ткань |
14 |
6,4 |
Печень |
57 |
3,6 |
Остальные ткани: |
|
|
Сердце |
60 |
0,7 |
жидкие |
85 |
1,4 |
Легкие |
82 |
3,7 |
плотные |
54 |
14,6 |
Селезенка |
84 |
0,2 |
Все тело |
45 |
100 |
* Ряд таблиц и рисунков учебника заимствован из руководств Б.И. I нова, СР. Мардашева (М., 1972) и Ю.Б. Филипповича (М., 1994).
22
фского, И.И. Ива-
Таблица 1.2. Содержание белков в |
органах животных |
н в |
растениях |
|
|
Содержание |
|
|
Содержание |
Органы животных |
белков, % от массы |
Органы растений |
|
белков, % от массы |
|
свежей ткани |
|
|
свежей ткани |
Мышцы |
18-23 |
Семена |
|
10-13 |
Печень |
18-19 |
Стебли |
|
1,5-3,0 |
Селезенка |
17-18 |
Листья |
|
1,2-3,0 |
Почки |
16-18 |
Корни |
|
0,5-3,0 |
Легкие |
14-15 |
Фрукты |
|
0,3-1,0 |
Мозг |
7-9 |
|
|
|
Для изучения химического состава, строения и свойств белков их обычно выделяют или из тканей, или из культивируемых клеток, или биологических жидкостей, например сыворотки крови, молока, мышц, печени, кожи и др. Элементный состав белков в пересчете на сухое вещество представлен 50—54% углерода, 21—23% кислорода, 6,5—7,3% водорода, 15—17% азота и до 0,5% серы. В составе некоторых белков присутствуют в небольших количествах фосфор, железо, марганец, магний, йод и др.
Таким образом, помимо углерода, кислорода и водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот, в связи с чем белки принято обозначать как азотсодержащие органические вещества. Содержание азота более или менее постоянно во всех белках (в среднем 16%), поэтому иногда определяют количество белка в биологических объектах по содержанию белкового азота.
МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ БЕЛКОВ
Для подробного исследования физико-химических и биологических свойств белков, а также для изучения их химического состава и структуры непременным условием является получение белков из природных источников в химически чистом, гомогенном состоянии. Последовательность операций по выделению белков обычно состоит в следующем: измельчение биологического материала (гомогенизация); извлечение белков, точнее, перевод белков в растворенное состояние (экстракция); выделение исследуемого белка из смеси других белков, т.е. очистка и получение индивидуального белка.
Белковые вещества весьма чувствительны к повышению температуры и действию многих химических реагентов (органические растворители, кислоты, щелочи). Поэтому обычные методы органической химии, применяемые для выделения того или иного вещества из смеси (нагревание, перегонка, возгонка, кристаллизация и др.), в данном случае неприемлемы. Белки в этих условиях подвергаются денатурации, т.е. теряют некоторые существенные природные (нативные) свойства, в частности растворимость, биологическую активность. Разработаны эффективные методы выделения белков в «мягких» условиях, при низкой температуре (не выше 4°С), с применением щадящих нативную структуру химических реагентов.
Гомогенизация биологического материала
Перед выделением белков из биологических объектов (органы и ткани животных, микроорганизмы, растения) исследуемый материал тщательно измельчают до гомогенного состояния, т.е. подвергают дезинтеграции
23
вплоть до разрушения клеточной структуры. Эту процедуру, называемую гомогенизацией, проводят при помощи ножевых гомогенизаторов типа Уорринга или пестикового гомогенизатора Поттера—Эльвегейма. Для выделения ряда белков из плотных животных и растительных объектов часто используют валковые или шаровые мельницы (рис. 1.1). Успешно применяется также метод попеременного замораживания и оттаивания ткани, в основе действия которого лежит разрушение клеточной оболочки, вызванное кристаллами льда. Для дезинтеграции тканей используют также ультразвук, пресс-методы (замороженный биоматериал пропускают через мельчайшие отверстия стального пресса под высоким давлением) и метод «азотной бомбы», при котором клетки (в частности, микробные) сначала насыщают азотом под высоким давлением, затем резко сбрасывают давление — выделяющийся газообразный азот как бы «взрывает» клетки.
Экстракция белков
Современные методы измельчения тканей обычно сочетают с одновременной экстракцией белков из гомогенатов тканей. Большинство белков тканей хорошо растворимо в 8—10% растворах солей. При экстракции белков широко применяют различные буферные смеси с определенными значениями рН среды, органические растворители, а также неионные детергенты — вещества, разрушающие гидрофобные взаимодействия между белками и липидами и между белковыми молекулами.
Из органических соединений, помимо давно применяемых водных растворов глицерина, широко используют (особенно для солюбилизации) слабые растворы сахарозы. На растворимость белков при экстракции большое влияние оказывает рН среды, поэтому в белковой химии применяют фосфатные, цитратные, боратные буферные смеси со значениями рН от кислых до слабощелочных, которые способствуют как растворению, так и стабилизации белков. Особенно широкое распространение получили трис-буферные системы, представляющие собой смеси 0,2 М раствора трис-(оксиметил)-аминометана (HOCH2)3CNH^ (сокращенно обозначают «трис») с 0,1 М раствором хлороводородной кислоты в разных соотношениях. Для выделения белков сыворотки крови используют способы их осаждения этанолом (см. метод Кона), ацетоном, бутанолом и их комбинации. Почти все органические растворители разрывают белок-липидные связи, способствуя лучшей экстракции белков.
Для получения из биологического материала белков в чистом, гомогенном, состоянии применяют различные детергенты, способствующие расщеплению белок-липидных комплексов и разрыву б ело к-белковых связей *. В частности, для освобождения белков (ферментов), прочно связанных с биомембранами митохондрий или других субклеточных структур, применяют тритон Х-100, додецилсульфат натрия и дезоксихолат натрия.
СН3—(СН2)10—СН2—О—SO3Na
Додецилсульфат натрия
С8Н17—(СеН4)—О—(СН2—СНОН)10Н
Тритон Х-100
* Здесь имеется в виду разрушение так называемых слабых связей (см. далее). Пептидные и другие ковалентные связи в белковых молекулах стараются сохранять.

![]()
![]()

Рис. 1.1. Л
знизатор: 1—п
стик, 2—корпус, 3—мотор, 4—ш (в): 1 —корпус с электродвигат*
Следует, однако, иметь в виду, что детергенты, вызывая разрыв белок-белковых связей, разрушают олитомерную (четвертичную) структуру белков.
Фракционирование и очистка белков
После достижения полной экстракции белков, т.е. перевода белков в растворенное состояние, приступают к разделению-фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: высаливание, тепловую денатурацию, осаждение органическими растворителями, хроматографию, электрофорез, распределение в двухфазных системах, кристаллизацию и др.
Растворение белков в воде связано с гидратацией каждой молекулы, что приводит к образованию вокруг белковой глобулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. По химическим и физическим свойствам вода, входящая в состав гидратной оболочки, отличается от чистого растворителя. В частности, температура замерзания ее составляет -40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы белков отличаются крайней неустойчивостью, и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также под влиянием физических факторов (нагревание, облучение и др.) наблюдаются дегидратация молекул белка и их выпадение в осадок.
Высаливание. При добавлении растворов солей щелочных и щелочноземельных металлов происходит осаждение белков из раствора. Обычно белок не теряет способности растворяться вновь в воде после удаления солей методами диализа или гельхроматографии. Высаливанием белков обычно пользуются в клинической практике при анализе белков сыворотки крови и других биологических жидкостей, а также в препаративной энзимо-логии для предварительного осаждения и удаления балластных белков или выделения исследуемого фермента. Различные белки высаливаются из растворов при разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок при 50% насыщении) и альбуминов (выпадают при 100% насыщении).
На величину высаливания белков оказывают влияние не только природа и концентрация солн, но и рН среды и температура. Считают, что главную роль при этом играет валентность ионов. Действие разных ионов принято сравнивать не по молярной концентрации соли, а по так называемой ионной силе (ц), которая равна половине суммы произведений концентрации каждого иона (с) на квадрат его валентности (V):
1
Более тонкое разделение белков плазмы крови человека на фракции достигается при использованнн различных концентраций этанола при низкой температуре (от -3 до -5°С) по методу Кона (рис. 1.2). В этих условиях белки сохраняют свои нативные свойства. Указанным методом часто пользуются для получения отдельных фракций крови, используемых в качестве кровезаменителей.
26

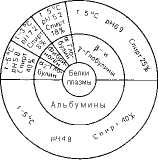
Рис. 1.2. Диаграмма фракционирования белков плазмы крови человека этанолом (по методу Кона).
В последнее время наибольшее распространение получили хроматогра-фические и электрофорегические методы разделения белков.
Хроматография. Принцип хроматографии, разработанный в 1903 г. русским ученым М. С. Цветом, основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке *.
В результате происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают подходящие элюенты, которые ослабляют силы адсорбции и выносят с током раствора индивидуальные вещества. Последние последовательно собирают в коллекторе фракций (принцип сорбции-десорбции).
Чрезвычайно эффективным средством фракционирования белков из смеси оказалась колоночная хроматография с гидроксилапатитом, различными ионообменными смолами и производными целллюлозы в качестве носителей. При выделении и очистке белков используют четыре основных типа хроматографии: адсорбционную, распределительную, ионообменную и аффинную (хроматография по сродству) - в соответствии с разными физическими и химическими механизмами, лежащими в основе каждого из них. Хроматография широко применяется не только для выделения белков, но и для разделения множества других органических и неорганических веществ, входящих в состав живых организмов.
Адсорбционная хроматография. Разделение компонентов смеси (образца) основано на их различной сорбируемое™ на твердом адсорбенте. В качестве адсорбентов используют активированный древесный уголь, гель фосфата кальция, оксиды алюминия или кремния. Адсорбент в виде суспензии с растворителем (чаще воего буферным раствором) вносят в стеклянную вертикальную трубку (колонку) и равномерно в ней упаковывают. Образец в небольшом объеме растворителя наносят на колонку -
общественностью Вот, например, что писал в 194S г швейцарский ученый П Каррер возможности исследования химика-органика, как хроматографический анализ Цвета Исследо-
щающихся по колонке с разной
компоненты разделяемой смеси адсорбируются на адсорбенте. Затем приступают к стадии освобождения-десорбции компонентов из колонки, применяя подходящие элюенты (рис. 1.3). Сбор фракций осуществляют при помощи автоматического коллектора фракций.
Распределительная хроматография. В отличие от адсорбционной твердая фаза служит только опорой (основой) для стационарной жидкой фазы. Один из типов распределительной хроматографии, как и адсорбционная, осуществляется на колонках, в которых в качестве стационарной фазы применяют влажный крахмал или силикагель. Образец растворяют в подходящем растворителе, затем наносят на колонку; разделяемые вещества, подвергающиеся многократному распределению между неподвижной стационарной фазой (водный слой) и движущейся фазой органического растворителя, с разной скоростью перемещаются ко дну колонки. Собранные при помощи коллектора фракции пробы, содержащие одно вещество, соединяют для выделения этого вещества в чистом виде.
Разновидностью распределительной хроматографии является хроматография на бумаге, широко используемая в биохимических лабораториях, в том числе клинических, для разделения пептидов, аминокислот и других веществ (рис. 1.4). В качестве стационарной фазы при этом служит вода, адсорбированная целлюлозными цепями фильтровальной бумаги. Образец помещают на одном конце бумажной полосы, этим же концом бумагу погружают в подходящую смесь органических растворителей (например, бутанол-уксусная кислота-вода в определенных соотношениях). При движении растворителя по бумаге благодаря силе капиллярности происходит разделение компонентов смеси. Проявленную хроматограмму высушивают, а местоположение каждого из разделяемых веществ определяют химическими или физико-химическими методами.
,2 Рис. 1.4. Хроматография на бумаге (схема).
А-восходящаяхроматография, Б-ни-
В-хроматограмма с разделенными и
Ионообменная хроматография. Ионообменные смолы являются полимерными органическими соединениями, содержащими функциональные группы, способные вовлекаться в ионный обмен. Различают положительно заряженные анионообмениики, представленные органическими основаниями и аминами, и отрицательно заряженные катионообмениики, содержащие фенольные, сульфо- или карбоксильные группы. Из сильно- и слабоосновных анионообменников чаще используют производные полистирола и целлюлозы, несущие функциональные группы:
CH2-O-C2H4NH,C,,H.,.;
Триметиламинополистирол Диэти^но^тющеллюлоза
Аналогичные функциональные группы содержат триэтиламиноэтил (ТЭАЭ)- и аминоэтил (АЭ)-целлюлозы.
Катионообмениики представлены сульфоиированными полистиролами (производные винилбензола или дивииилбензола) и карбоксиметилцеллю-лозой, имеющими следующие функциональные группы:
В зависимости от заряда разделяемых белков используют подходящую ионообменную смолу, с функциональными группами которой обменивается и задерживается на колонке часть белков, в то время как другие белки беспрепятственно элюируются с колонки. «Осажденные» на колонке белки снимают с колонки, применяя более концентрированные солевые растворы или изменяя рН элюеита.
Новейшие методы ионообменной хроматографии, в частности высокоэффективная жидкостная хроматография (ВЭЖХ), широко используются в фармакологии (при создании и определении лекарственных веществ), в клинической биохимии (при определении биологически активных веществ в физиологических жидкостях), в биотехнологических процессах и производствах и других областях: оии позволяют определять вещества в нано-, пико- и фемтаграммных количествах.
Аффинная хроматография (хроматография по сродству). Основана аффинная хроматография на принципе избирательного взаимодействия белков (или других макромолекул) с закрепленными (иммобилизованными) на носителе специфическими веществами-лигандами, которыми могут быть субстраты или коферменты (когда выделяют какой-либо фермент), антигены (или антитела), гормоны или рецепторы и т. д. Благодаря высокой специфичности белков к иммобилизованному лигаиду, связанному с носителем (которым заполняют хроматографическую колонку), присоединяется только один какой-либо белок из смеси. Снятие с колонки этого белка осуществляют элюированием буферными смесями с измененным рН или
29
измененной ионной силой, а также введением в состав элюента детергентов, ослабляющих связи между белками и лигандами. Несомненным достоинством метода является возможность одноэтапно выделить заданный белок или другой биополимер высокой степени чистоты. При помощи аффинной хроматографии, например, удалось сравнительно легко выделить очищенные препараты аминоацил-тРНК-синтетаз на полиакрилгидразидагаровом геле, к которому в качестве лигандов были присоединены определенные тРНК (транспортные РНК).
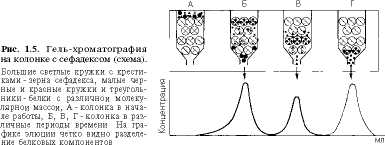
Гелъ-хроматография. В препаративных целях, особенно при очистке белков от примесей, широко используют метод молекулярных сит, или гель-хроматографию. При обработке эпихлоргидрином полисахарида дек-страна • образуются различной степени выраженности поперечные связи, приводящие к формированию крупных гидрофильных зерен, нерастворимых в воде и называемых сефадексами. Благодаря большому сродству к воде зерна сильно набухают в водной среде с образованием геля, которым заполняют хроматографическую колонку. Разделение веществ этим методом основано на том, что большие молекулы не проникают во внутреннюю водную фазу геля, являющуюся стационарной, и остаются снаружи, двигаясь вместе с подвижной фазой вниз вдоль колонки; небольшие молекулы, напротив, свободно диффундируют внутрь зерен, образуя равновесную систему между подвижной и стационарной фазами, и соответственно с меньшей скоростью двигаются вдоль колонки (рис. 1.5). Обычно момент появления веществ в вытекающем из колонки с сефадексом элюенте выражают формулой:
V= V, + K-V,
где V— объем элюирующей жидкости вещества с данным К, мл; Vtl — свободный объем колонки или общий объем внешнего растворителя (вне зерен геля), мл; Vt — объем растворителя внутри геля, мл; К— коэффициент распределения для растворенного вещества между растворителем внутри зерен геля и окружающим растворителем. Если анализируемую пробу, содержащую одно растворенное вещество с К = 1 и второе с К = 0, внести в колонку с сефадексом, то второе вещество появится в элюирующей жидкости сразу после выхода из колонки Vo, а первое—только после выхода объема V, + V,.
Поскольку молекулы белков, обладающие большими молекулярной массой и размерами, не диффундируют внутрь зерен сефадекса, они первыми вымываются из колонки после выхода свободного объема колонки Vo, в то время как все остальные вещества (включая низкомолекулярные примеси) вымываются после выхода объема, равного V, + К • V,.
Метод нашел широкое применение в препаративной энзимологии. С помощью сефадекса можно разделить белки с разной молекулярной массой.
Электрофорез. Метод свободного электрофореза, детально разработанный лауреатом Нобелевской премии А. Тизелиусом, основан на различии в скорости движения (подвижности) белков в электрическом поле, которая
* Декстран является полисахаридом, синтезируемым микроорганизмами. Сефадекс — коммерческий препарат, свое название получил от начальных слогов трех слов: separation (разделение), Pharmacia (наименование фармацевтической фирмы в Швеции), dextran (декстран). Наряду с сефадексом для разделения белков и других биомолекул используют также сефарозу, сефакрил, биогели, молселект, акрилекс и др.
30
определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества их по сравнению с методом свободного электрофореза состоят в том, что исключается размывание границы белок-растворитель в результате диффузии и конвекции, не требуется налаживания сложной аппаратуры для определения положения границы, а для анализа необходимо небольшое количество белка (подробно этн методы и соответствующая аппаратура рассматриваются в практических руководствах по биохимии).
Одним из наиболее распространенных методов фракционирования белков (как и методов оценки гомогенности) является диск-электрофорез (от англ. discontinuous—прерывистый, перемежающийся) в полиакриламид-ном геле, при котором используют пары буферных растворов с различными значениями рН и разной степени пористости гель. Следует отметить высокую разрешающую способность гель-электрофореза. Если при электрофорезе белков сыворотки крови человека на бумаге открываются всего 6 фракций, то при электрофорезе в крахмальном геле —10, а в полиакрил-амидном геле—до 18 разных белковых фракций.
Для выявления белков при электрофорезе в гелях их обрабатывают одним из следующих красителей: бромфеноловым синим, амидо черным 10В, кислотным синим 83, кумасси бриллиантовым голубым R-250 и др. Интенсивность окраски и соответственно относительное содержание каждой белковой фракции обычно определяют денситометрически путем прямого сканирования на денситометре. В последние годы стали применять методы электрофореза белков с градиентом концентрации геля, что значительно повышает разрешающую способность, особенно при фракционировании белков с высокой молекулярной массой, превышающей 50000— 100000.
Весьма перспективными методами разделения белков (как и определения ряда физико-химических свойств) оказались разные варианты метода изоэлектрического фокусирования—изотахофореза, основанные на проведении электрофореза в поддерживающих средах (на колонке или в тонком слое) с градиентом рН. Точное местоположение на колонке каждого белка из смеси определяется значением его изоэлектрической точки, т.е. состоянием, при котором суммарный электрический заряд белковой частицы при данном значении рН равен нулю. При использовании
31
метода изоэлектрического фокусирования применяют смеси синтетических полиаминополикарбоноввк кислот (амфолинв1) для создания градиента рН в диапазоне от 3,0 до 10,0.
В последние годв1 широкое распространение для фракционирования белков получили различнвт сочетания изоэлектрофокусирования и диск-электрофореза в полиакриламидном геле —методв1 двухмерного электрофореза, которвш позоляют параллелвно анализироватв сотни и даже тысячи белковвж фракций.
Очистка белков от низкомолекулярных примесей
Применение в определенной последователвности ряда перечисленных методов позволяет получитв белок в очищенном состоянии, не лишеннвш, однако, некоторвк примесей солей. Для полного освобождения белков от низкомолекулярнвж примесей в настоящее время исполвзуют методв1 диализа, гелвхроматографии, кристаллизации, улвтрафилвтрации. При диализе применяют полупроницаемые мембранв1 (целлофан, коллодийная пленка), диаметр пор которвгх варвирует в широких пределах. Белки, как правило, не диффундируют через такую мембрану, в то время как низкомо-лекулярнвт вещества легко проникают через нее в окружающую среду.
Метод кристаллизации белков основан на достижении критической точки начала осаждения белка из раствора сулвфата аммония при медленном поввпнении температуры. Уже полученв1 сотни кристаллических белков*. Однако не всякий кристаллический белок является гомогеннвш, посколвку при одной и той же концентрации раствора сулвфата аммония могут кристаллизоватвся близкие по размерам и массе разные белки.
Наилучшие резулвтатв1 при освобождении белков от низкомолекуляр-hbix примесей получают с помощвю гелвхроматографии и улвтрафилвтрации. Последняя основана на продавливании растворов белка через спе-циальные мембраны, задерживающие белковые молекулы, что позволяет не толвко освободитв белковые растворв1 от низкомолекулярнвж примесей, но и концентрироватв их.
Определение гомогенности белков
На заключителвном этапе выделения и очистки белков исследователя всегда интересует вопрос о гомогенности полученного белка. Нелвзя оцениватв гомогенноств индивидуалвного белка толвко по одному какому-либо физико-химическому показателю. Для этого полвзуются разивши критериями. Из огромного числа хроматографических, электрофоретиче-ских, химических, радио- и иммунохимических, биологических и гравита-ционнвгх методов наиболее достоверные резулвтатв1 при определении гомогенности белка дают улвтрацентрифугирование в градиенте плотности сахарозв1 или хлорида цезия, диск-электрофорез в полиакриламидном геле, изоэлектрическое фокусирование, иммунохимические методв1 и определение растворимости белка. Действителвно, если при гелв-электрофорезе белок движется в виде одной узкой полосв1 и в этой зоне сосредоточена его биологическая активноств (ферментативная, гормоналвная, токсическая
* Первый кристаллический фермент уреаза был получен Д. Самнером ] 32
и т.д.), то этн данные с большой долей вероятности могут свидетельствовать об однородности исследуемого белка.
В основе иммунохимического метода контроля гомогенности исследуемого белка лежит реакция преципитации его с соответствующей антисыво-роткой, полученной от иммунизированных этим белком животных. Для строгого доказательства гомогенности белка требуется одновременное использование нескольких методов.
Не потерял своего значения и метод кристаллизации белков с использованием сульфата аммония, а также метод определения растворимости белка. Последний, предложенный еще Д. Нортропом *, основан на правиле фаз Гиббса, согласно которому растворимость чистого вещества при данных условиях опыта зависит только от температуры, но не зависит от количества вещества, находящегося в твердой фазе. Метод может быть выполнен сравнительно легко и быстро в микромасштабах. Обычно определяют растворимость увеличивающегося количества исследуемого белка при постоянном количестве растворителя.
АМИНОКИСЛОТНЫЙ СОСТАВ БЕЛКОВ
Несмотря на то что первая аминокислота—глицин—была выделена А. Бра-конно еще в 1820 г. из кислотного гвдролизата желатина, полный аминокислотный состав белков был расшифрован только к 30-м годам XX в. Большая заслуга в этом принадлежит работам Н.Н. Любавнна, который в 1871 г. установил, что под действием ферментов пищеварительных соков белки расщепляются на аминокислоты.
Были сделаны два важных вывода: 1) в состав белков входят аминокислоты; 2) методами гидролиза может быть изучен химический, в частности амнокислотный, состав белков.
Для изучения аминокислотного состава белков пользуются сочетанием кислотного (НО), щелочного [Ва(ОН),] и, реже, ферментативного гидролиза ** или одним из них. Установлено, что при гидролизе чистого белка, не содержащего примеоей, освобождаются 20 различных а-аминокислот. Вое другие открытые в тканях животных, растений и микроорганизмов аминокислоты (более 300) существуют в природе в свободном состоянии либо в виде коротких пептидов или комплексов с другими органическими веществами.
а-Амннокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у а-углерода, замещен на аминогруппу (—NH,), например:
R—СНЭ—СНЭ—СООН R—СН—С ООН
Жирная кислота Н2
Следует подчеркнуть, что все аминокислоты, входящие в состав природных белков, являются а-аминокислотами, хотя аминогруппа в свободных аминокарбоновых кислотах может находиться, как увидим ниже, в Р-, у-, 5-и Е-положениях.
Классификация аминокислот
Все встречающиеся в природе аминокислоты обладают общим свойством — амфотерностью (от греч. amphoteros— двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения а-аминокислот может быть представлен в следующем виде:
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с а-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все а-амино- и а-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксилыше группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и одно-буквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (pi) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.
34
Таблица 1.3. Классификация аминокислот, основанная н |
а полярности радикалов |
||||
|
принят |
енияОиРодноНбук- |
|
Среднее |
|
АМИНОКИСЛОТЫ |
вен |
|
М/р1 |
содержание в белках, % |
|
|
англ |
СИМВ0Л |
русск |
||
I. Неполярные R-группы |
|
|
|
|
|
Глицин |
Gly |
G |
Гли |
75/5,97 |
7,5 |
Алании |
Ala |
A |
Ала |
89/6,02 |
9,0 |
Валин |
Val |
V |
Вал |
117/5,97 |
6,9 |
Лейцин |
Leu |
L |
Лей |
131/5,97 |
|
Изолейцин |
He |
I |
Иле |
131/5,97 |
4,6 |
Пролин |
Pro |
P |
Про |
115/6,10 |
4,6 |
П. Полярные, незаряженные R-группы |
|
|
|
|
|
Серии |
Ser |
S |
Сер |
105/5,68 |
7,1 |
Треонин |
Thr |
T |
Тре |
119/6,53 |
6,0 |
Цистеин |
Cys |
с |
Цис |
121/5,02 |
2,8 |
|
Met |
M |
Мет |
149/5,75 |
1,7 |
|
Asn |
N |
Асн |
132/5,41 |
4,4 |
Глутамин |
Gin |
Q |
|
146/5,65 |
3,9 |
III. Ароматические R- |
|
|
|
|
|
группы |
|
|
|
|
|
Фенилаланин |
Phe |
F |
Фен |
165/5,98 |
3,5 |
Тирозин |
Туг |
Y |
Тир |
181/5,65 |
3,5 |
Триптофан |
Trp |
W |
Трп |
204/5,88 |
1,1 |
IV. Отрицательно заря- |
|
|
|
|
|
женные R-группы |
|
|
|
|
|
Аспарагиновая |
Asp |
D |
Асп |
133/2,97 |
5,5 |
Глутаминовая |
Glu |
E |
Глу |
147/3,22 |
6,2 |
V. Положительно заря- |
|
|
|
|
|
женные R-группы |
|
|
|
|
|
Лизин |
Lys |
К |
Лиз |
146/9,74 |
7,0 |
Аргинин Гистидин |
Arg His |
R H |
Apr Гис |
174/10,76 155/7,59 |
4,7 2,1 |
Неполярные R-группы
J;CH+CH -СООН1
н3с
L-аланин L-валин L-лейцин
СН2-СНг
H+CH-COOHI CH2-j-N—^H-COOHJ CHj-CHj-CH-'CH-COOHl
|NH2 I '--^ CH3INH2 j
.ним. imu L-пролин L-изолейцин
Полярные, незаряженные R-группы
CH24CH-COOHI СН2-ЮН-СООН1 О=С-СН2-СН2ТСН-СООН '
ОН ! ННг \ SH !nh2 ! NH2 [ NH2 I
L-серин L-цистеин L-глутамин
CH3-CH4CH-COOH! CH2-CH2{CH-COOH I О=С-СН2|СН-СООН ! ОН INH2 | S-CH3 ! NH2 ! NH2 [ NH2 !
L-треонин L-метионин L-аспарагин
Отрицательно заряженные R-фуппы
HOOC-CH2-CHS-[CH-COOH I HOOC-CH2TCH-COOH '
! NH2 I [ NH; I
L-аспарагиновая кислота
Положительно заряженные R-группы
снг-снг-сн2-снг+сн-соон ] ^=^-сн2-
NH2 InH, ; HN^N
I.™™» l"~~ " L-гистидин
C-NH-CHj-CHj-CH2-fCH-COOH '
А роматические
R-группы
роматические
R-группы
сн2ч:н-соон i но—<Г^—сн2-£н-соон 1
iNH2 [ nh2 |
энилаланин L-тирозин
сн2-рн-соон i
NH2 I
Перечисленные аминокислоты присутствуют в разных количественных соотношениях и последовательностях в тысячах белков, хотя отдельные индивидуальные белки не содержат полного набора всех этих аминокислот. Помимо наличия в большинстве природных белков 20 аминокислот, в некоторых белках обнаружены производные аминокислот *: оксипролин, окси-лизин, дийодтнрозин, фосфосерин и фосфотреонин (последние две аминокислоты представлены в главе 2):
СН2-СН-{СН2)2-СН-СООН \ . \ ,
I I I ( У-соон нонд))-сн,-сн-соон
NH2 NH2 N^/ V^/ 2 |
Оксипролин 3,5-Дийодтирозин
Первые две аминокислоты содержатся в белке соединительной ткани -коллагене, а дийодтирозин является основой структуры гормонов щитовидной железы. В мышечном белке миозине обнаружен также e-N-метиллизин; в состав протромбина (белок свертывания крови) входит у-карбоксиглута-миновая кислота, а в глутатионпероксидазе открыт селеноцистеин, в котором ОН-группа серина заменена на селен (Se):
СН2-(СН,;)3-СН-СООН НООС-СН-СН2 -СН СООН СН2-СН-СООН
■ NH NH? "■• ■■ NH2 -!" NH?
e-N-метиллизин у-Карбоксиглутаминовая Селеноцистеин
кислота
Помимо указанных, ряд а-аминокислот выполняет важные функции в обмене веществ, хотя и не входит в состав белков, в частности орнитнн, цитруллин, гомосерин, гомоцистеин, цистеинсульфиновая кислота, диокси-фенилаланин и др.
Общие свойства аминокислот
Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотер-ных) ионов (цвиттерионов), а не в виде недиссоциированных молекул (последнюю структуру приводят для удобства представления, однако все аминокислоты при физиологических значениях рН имеют структуру цвитте-риона).
При растворении в воде кристаллическая аминокислота, например аланин, может реагировать или как кислота (донатор протона):
+NH3CH(CH3)COO"<=>H+ + ЫНгСН(СН3)СОО", или как основание (акцептор протона):
+NH3CH(CH3)COO-+H+< = >+NH3CH(CH3)COOH.
Если радикалы аминокислот нейтральные, то они почти не оказывают влияния на диссоциацию а-карбоксильной группы или а-аминогруппы, и величины рК (отрицательный логарифм константы диссоциации) остаются относительно постоянными. Вследствие этого кривые диссоциации почти всех нейтральных аминокислот накладываются друг на друга и могут быть рассмотрены на примере аланина. Если к раствору аланина (например, 0,1 М) в воде постепенно прибавлять сильную кислоту (0,1 М раствор HCL) или сильную щелочь (0,1 М раствор NaOH), то получим кривую титрования аланина, типичную для всех нейтральных аминокислот (рис. 1.6).
Кажущиеся величины рК' для а-карбоксильной группы и а-аминогрупп (т.е. значения рН, при которых эти группы в среднем наполовину диссоциированы) довольно сильно различаются, составляя рК, = 2,34 и рКг = 9,69. При низком значении рН (ниже рК/) почти все молекулы аланина являются полностью прогонированными и несут положительный заряд. Другими словами, при высокой концентрации водородных ионов в растворе тенденция к диссоциации водорода из структуры аланина оказывается незначительной. Из кривой титрования видно, что точка перехода между ветвями кривой располагается при рН 6,02. Это означает, что при данном значении рН суммарный (или средний) электрический заряд молекулы аланина равен нулю и она не перемещается в электрическом поле ни к аноду, ни к катоду (изоэлектрическое состояние). Такое значение рН получило название изо-электрической точки и обозначается pi. Из о электрическая точка аминокислот, не содержащих дополнительных NH,- или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК':
соответственно для аланина
2,34+9,6'
Изоэлектрическая точка ряда других аминокислот, содержащих дополнительные кислотные или основные группы (аспарагиновая и глутаминовая кислоты, лизин, аргинин, тирозин и др.), зависит, кроме того, от кислотности или основности радикалов этих аминокислот. Для лизина, например, pi должна вычисляться из полусуммы значений рК' для а- и £-NH,-rpynn. Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. Следует отме-
38
Рис. 1.6. Кривые, полученные пр
на 0,1 М раствором НС1 (а) 0,1 М раствором NaOH (б).
pi = 6,02 |
|
тнть, что при физиологических значениях рН тканей и крови (7,1 и 7,4 соответственно) аминокислоты (за ислючением гистидина) не обладают измеримой буферной емкостью. Эту способность они приобретают только при значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8).
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Будучи растворенными в воде (или в НС1), они способны вращать плоскость поляризованного луча (исключение составляет глицин). Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в а-положении асимметрического атома углерода (т. е. атома углерода, все четыре валентные связи которого заняты различными заместителями). Величины удельного вращения вправо или влево являются количественной характеристикой оптической активности, и для большинства аминокислот [и]]] составляет от Ю до 30°. Примерно половина аминокислот белков оказалась правовращающей, их обозначают знаком « + » (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины-левовращающей (Фен, Трп, Лей и др.), их обозначают знаком «-». Все этн аминокислоты принадлежат к L-ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическое вращение.
Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Ниже представлены L- и D-стереоизомеры глицеринового альдегида. Рядом показаны пространственные конфигурации L-и D-аланина:
сно
соон
соон
СН2ОН
CHjOH
ицеральдегид
СН
Все аминокислоты, образующиеся при гидролизе природных белков ■ условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким
образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида. Следует еще раз подчеркнуть, что символы L и D означают принадлежность данной аминокислоты по своей стереохимической конфигурации к L- или D-ряду, в то время как знак « + » или «-» указывает на направление изменения плоскости поляризации светового луча. Среди белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Следовательно, если не в природе, то, во всяком случае, в лаборатории возможно получить четыре стереоизо-мерные формы этих аминокислот*. Для треонина известны все четыре изомера. Если условно обозначить символом L выделенный из природных белков треонин, то его зеркальное отображение называют D-треонином. Два других изомера, получивших наименование диастереоизомеров, или аллоформ, также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров треонина можно представить следующими формулами:
соон |
СОО |
с ~-' |
„■4 |
г; 11 |
'■Л „ |
СООН СООН СООН СООН
11 i -■
Как отмечалось, в белковой молекуле D-аминокислоты не обнаружены **, однако в живой природе они широко распространены.
Так, D-изомерыглутаминовой кислоты, аланина, валина, фенилаланина, лейцина и ряда других открыты в клеточной стенке бактерий; в составе некоторых антибиотиков, в частности актиномицинов, бацитрацина, грами-цидинов А и S, содержатся аминокислоты D-конфигурации.
Аминокислотный состав (качественный и количественный) многих тысяч белков, полученных из разных источииков, выяснен (табл. 1.4).
При анализе данных табл. 1.4 виден ряд закономерностей. На долю дикарбоновых аминокислот и их амидов в большинстве белков приходится до 25-27% всех аминокислот. Этн же аминокислоты вместе с лейцином и лизином составляют около 50% всех аминокислот. В то же время на долю таких аминокислот, как цистеин, метионин, триптофан, гистидин, приходится не более 1,5-3,5%. В протаминах и гистонах отмечено высокое содержание основных аминокислот аргинина и лизина, соответственно 26,4 и 85,2% (см. «Химия простых белков»).
Химические реакции для открытия и определения аминокислот в гидроли-затах белков. В курсе органической химии подробно рассмотрено множество химических реакций, характерных для а-амино- и а-карбоксильных групп аминокислот (ацилирование, алкилирование, нитрование, этерификация
обычно образуется оптически неактивная смесь L- и D-изомеров, обозначаемых как DL-** D-Аминокислоты, очевидно, не играют важной физиологической роли в организме
4 0
0
