
- •Глава 1. Химии белков
- •Глава 2. Химия белков
- •Глава 5. Химия углеводов
- •Глава 8. Гормоны .... 248
- •Глава 6. Химия липидов 188
- •Глава 7. Витамины ... 204
- •Глава 9. Биомембраны и биоэнергетика
- •Глава 10. Метаболизм уг леводов
- •Глава 11. Пидов . .
- •Глава 14. Биосинтез белка 509
- •Глава 15. Взаимосвизь про цессов обмена веществ в ор ганизме 545
- •Глава 13. Обмен сложных
- •Глава 16. Печень .... 551
- •Глава 17. Кровь 567
- •Глава 18. Почки и моча 608
- •Глава 19. Нервиаи ткань 625
- •Глава 20. Мышечнаи ткань 645
- •Глава 21. Соединительная
- •Введение
- •Глава 1 химия белков
- •I 1.4. Аминокислотный состав некоторых природных белков, в процентах
- •Глава 2 химия сложных белков
- •Глава 3 химия нуклеиновых кислот
- •Глава 4 ферменты
- •Глава 5 химия углеводов
- •Глава 6
- •Глава 7 витамины
- •Жирорастворимые витамины
- •Водорастворимые витамины
- •Глава 8 гормоны
- •1. Тиролиберип (Пиро-Глу-Гис-Про-nHj):
- •2. Гонадолиберин является декапептидом, состоящим из 10 аминокислот в последовательности:
- •Глава 9 биомембраны и биоэнергетика
- •Глава 10 метаболизм углеводов
- •1,3 Бисфосфоглиц9рэт
- •Глава 11 метаболизм липидов
- •2 Ацетил-КоА
- •7 Ноос-сНг—c-ch3-co-
- •Глава 12 обмен простых белков
- •Глава 18 почки и моча
- •Глава 19 нервная ткань
- •В процентах от общих липидов
- •Глава 20 мышечная ткань
- •Глава 21 соединительная ткань
- •Глава 22 костнаяткань
Глава 10 метаболизм углеводов
Метаболизм (обмен) углеводов в организме человека состоит в основном из следующих процессов:
Расщепление в пищеварительном тракте поступающих с пищей по лисахаридов и дисахаридов до моносахаридов. Всасывание моносахаридов из кишечника в кровь.
Синтез и распад гликогена в тканях, прежде всего в печени.
Гликолиз. Понятие «гликолиз» означает расщепление глюкозы. Пер воначально этим термином обозначали только анаэробное брожение, за вершающееся образованием молочной кислоты (лактата) или этанола и СО2. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глю- козо-6-фосфата, фруктозобисфосфата и пирувата как в отсутствие, так и в присутствии кислорода. В последнем случае употребляют термин «аэробный гликолиз» в отличие от «анаэробного гликолиза», завершаю щегося образованием молочной кислоты (лактата).
Аэробный путь прямого окисления глюкозы или, как его называют, пентозофосфатный путь (пентозный цикл).
5. Взаимопревращение гексоз.
Аэробный метаболизм пирувата. Этот процесс выходит за рамки углеводного обмена, однако может рассматриваться как завершающая его стадия: окисление продукта гликолиза—пирувата.
Наконец, важным является процесс глюконеогенеза, или образование углеводов из неуглеводных продуктов. Такими продуктами являются в пер вую очередь пировиноградная и молочная кислоты, глицерин, амино кислоты и ряд других соединений.
ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ УГЛЕВОДОВ
Расщепление крахмала (и гликогена) начинается в полости рта под действием амилазы слюны.
Известны три вида амилаз, которые различаются главным образом по конечным продуктам их ферментативного действия: а-амилаза, [3-амилаза и Y-амилаза. а-Амилаза расщепляет в полисахаридах внутренние а-1,4-свя-зи, поэтому ее иногда называют эндоамилазой. Молекула а-амилазы содержит в своих активных центрах ионы Са2*, необходимые для ферментативной активности. Кроме того, характерной особенностью а-амилазы животного происхождения является способность активироваться одновалентными анионами, прежде всего ионами хлора.
Под действием [3-амилазы от крахмала отщепляется дисахарид мальтоза, т.е. р-амилаза является экзоамилазой. Она обнаружена у высших растений, где выполняет важную роль в мобилизации резервного (запасного) крахмала.
319
7-Амилаза отщепляет один за другим глюкозные остатки от конца полигликозидной цепочки. Различают кислые и нейтральные 7"амилазы в зависимости от того, в какой области рН они проявляют максимальную активность. В органах и тканях человека и млекопитающих кислая 7~ами-лаза локализована в лизосомах, а нейтральная —в микросомах и гиало-плазме. Амилаза слюны является а-амилазой. Под влиянием этого фермента происходят первые фазы распада крахмала (или гликогена) с образованием декстринов (в небольшом количестве образуется и мальтоза). Затем пища, смешанная со слюной, попадает в желудок.
Желудочный сок не содержит ферментов, расщепляющих сложные углеводы. В желудке действие а-амилазы слюны прекращается, так как желудочное содержимое имеет резко кислую реакцию (рН 1,5—2,5). Однако в более глубоких слоях пищевого комка, куда не сразу проникает желудочный сок, действие амилазы некоторое время продолжается и происходит расщепление полисахаридов с образованием декстринов и мальтозы. Наиболее важная фаза распада крахмала (и гликогена) протекает в двенадцатиперстной кишке под действием а-амилазы поджелудочного сока. Здесь рН возрастает приблизительно до нейтральных значений, при этих условиях а-амилаза панкреатического сока обладает почти максимальной активностью. Этот фермент завершает превращение крахмала и гликогена в мальтозу, начатое амилазой слюны. Напомним, что в молекулах амило-пектина и гликогена в точках ветвления существуют также а(1—>6)-глико-зидные связи. Эти связи в кишечнике гидролизуются особыми ферментами: амило-1,6-глюкозидазой и олиго-1,6-глюкозидазой (терминальная декстри-наза).
Таким образом, расщепление крахмала и гликогена до мальтозы происходит в кишечнике под действием трех ферментов: панкреатической а-амилазы, амило-1,6-глюкозидазы и олиго-1,6-глюкозидазы.
Образующаяся мальтоза оказывается только временным продуктом, так как она быстро гидролизуется под влиянием фермента мальтазы (а-глюкозидазы) на 2 молекулы глюкозы. Кишечный сок содержит также активную сахаразу, под влиянием которой из сахарозы образуются глюкоза и фруктоза*.
Лактоза, которая содержится только в молоке, под действием лактазы кишечного сока расщепляется на глюкозу и галактозу. В конце концов углеводы пищи распадаются на составляющие их моносахариды (преимущественно глюкоза, фруктоза и галактоза), которые всасываются кишечной стенкой и затем попадают в кровь.
Следует заметить, что активность свободных дисахаридаз в просвете кишечника невелика. Большая часть их ассоциирована с небольшими «выпуклостями» на щеточной каемке эпителиальных клеток кишечника.
Напомним, что на внутренней поверхности тонкой кишки располагаются ворсинки. В тощей кишке человека на 1 мм2 поверхности приходится 22—40, в подвздошной — 18—30 ворсинок. Снаружи ворсинки покрыты кишечным эпителием, клетки которого имеют множественные выросты —микроворсинки (до 4000 на каждой клетке). На 1 мм2 поверхности тонкой кишки у человека 80—140 млн микроворсинок.
При соответствующей обработке препаратов над микроворсинками обнаруживается волокнистая сеть, представляющая собой гликопротеино-
* Гидролиз сахарозы сопровождается изменением знака оптического вращения: правовращающая сахароза превращается в левовращающую смесь глюкозы и фруктозы. Эту смесь называли раньше инвертированным сахаром.
320
вый комплекс —гликокаликс. В поверхностных слоях гликокаликса задерживаются крупные молекулы и бактерии. Полисахариды не проникают через гликокаликс и, оставшись нерасщепленными при полостном пищеварении, гидролизуются на поверхности энтероцитов. Мальтоза, сахароза и лактоза могут гидролизоваться в гликокаликсе. Такое переваривание получило название пристеночного, или внеклеточного, пищеварения.
Маловероятным представляется всасывание значительных количеств дисахаридов, так как из экспериментов с парентеральным их введением известно, что большая часть дисахаридов, поступивших в кровяное русло, выделяется с мочой неизмененной; это является тем единственным и притом нефизиологическим случаем, когда дисахариды появляются в моче.
Скорость всасывания отдельных моносахаридов различна. Глюкоза и галактоза всасываются быстрее, чем другие моносахариды. Принято считать, что всасывание маннозы, ксилозы и арабинозы осуществляется преимущественно путем диффузии, всасывание же большинства других моносахаридов происходит за счет активного транспорта.
Щеточная каемка энтероцитов содержит системы переносчиков. Установлено существование переносчика, способного связывать различными своими участками глюкозу и Na+ и переносить их через плазматическую мембрану кишечной клетки. Считают, что глюкоза и Na+ высвобождаются затем в цитозоль, позволяя переносчику захватить новую порцию «груза». Na+ транспортируется по градиенту концентрации, стимулируя переносчик к транспорту глюкозы против указанного градиента. Свободная энергия, необходимая для этого активного транспорта, образуется благодаря гидролизу АТФ связанному с натриевым насосом, который «откачивает» из клетки Na+ в обмен на К+. Динамика происходящих при этом процессов пока остается недостаточно ясной и в настоящее время обстоятельно изучается.
Судьба всосавшихся моносахаридов. Более 90% всосавшихся моносахаридов (главным образом глюкоза) через капилляры кишечных ворсинок попадает в кровеносную систему и с током крови через воротную вену доставляется прежде всего в печень. Остальное количество моносахаридов поступает по лимфатическим путям в венозную систему. В печени значительная часть всосавшейся глюкозы превращается в гликоген, который откладывается в печеночных клетках в форме своеобразных, видимых под микроскопом блестящих гранул.
СИНТЕЗ И РАСПАД ГЛИКОГЕНА
Гликоген —главная форма запасания углеводов у животных и человека. Накапливается гликоген главным образом в печени (до 6% от массы печени) и в скелетных мышцах, где его содержание редко превышает 1%. Запасы гликогена в скелетных мышцах ввиду значительно большей массы последних превышают его запасы в печени. Гликоген присутствует в цито-золе в форме гранул диаметром от 10 до 40 нм. На электронных микрофотографиях гликогеновые гранулы выглядят плотными. Установлено, что эти гранулы, кроме гликогена, содержат ферменты, катализирующие синтез и распад гликогена. Однако гликогеновые гранулы отличаются от мульти-ферментных комплексов (например, от пируватдегидрогеназного комплекса). Степень структурной организации гликогеновых гранул ниже, чем в мультиферментных комплексах. Следует подчеркнуть, что синтез и распад гликогена в клетке осуществляются разными метаболическими путями.
321
В частности, считалось, что гликогенфосфорилаза (фосфорилаза а) катализирует как распад гликогена, так и его синтез, потому что в опытах in vitro было показано, что гликогенфосфорилазная реакция обратима. Однако в дальнейшем было установлено, что в клетке (in vivo) фосфорилаза а катализирует только распад гликогена, синтез гликогена осуществляется при участии совершенно другого фермента. Оба эти процесса (синтез и распад гликогена) регулируют содержание глюкозы в крови и создают резерв глюкозы для интенсивной мышечной работы.
Синтез гликогена (гликогенез)
Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени-и глюкокиназы. Далее глюкоз о-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-
фат *:
?н'он дтф ДДФ ch2oiv,.,,, сн2он
,1 -°. \ /
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглю-козу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорила-за):
Глюкозо-1-фосфат + УТФ <=> УДФ-глюкоза + Пирофосфат.
Приводим структурную формулу УДФ-глюкозы:
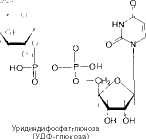
На второй стадии - стадии образования гликогена-происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена («затравочное» количество). При этом образуется а-(1->4)-связь между первым атомом углерода добавляемого остатка глюкозы и 4-гидроксильной группой остатка глюкозы цепи. Эта реакция катализируется ферментом гликогенсиитазой. Необходимо еще раз подчеркнуть, что реакция, катализируемая гликогенсинтазой, возможна только при условии, что полисахаридная цепь уже содержит более 4 остатков D-глю-козы.
/ ° ° " \ОН /LqJCoh J-O-R
„/Я -р-О-Р-О-^ридин НПЧ / ^ \ V
■J-1 ОН ОН ОН ОН
CHnOH CH2OH
и_\он ,До-\ОН Ло-R 1 Г 1 I
Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
В целом образование а-1,4-глюкозидной ветви («амилозной» ветви) гликогена можно представить в виде следующей схемы:
Глюкоэо-1 -фосфат
^—- УТФ-
![]()
Установлено, что гликогенсинтаза неспособна катализировать образование а-(1—>6)-связи, имеющейся в точках ветвления гликогена. Этот процесс катализирует специальный фермент, получивший название гликоген ветвяще го фермента, или амило-(1—>4)—>(1—>6)-трансглюкозидазы. Последний катализирует перенос концевого олигосахаридного фрагмента, состоящего из 6 или 7 остатков глюкозы, с нередуцирующего конца одной из боковых цепей, насчитывающей не менее 11 остатков, на 6-гидроксиль-ную группу остатка глюкозы той же или другой цепи гликогена. В результате образуется новая боковая цепь.
Ветвление повышает растворимость гликогена. Кроме того, благодаря ветвлению создается большое количество невосстанавливающих концевых остатков, которые являются местами действия гликогенфосфорилазы и гликогенсинтазы.
Таким образом, ветвление увеличивает скорость синтеза и расщепления гликогена.
Благодаря способности к отложению гликогена (главным образом в печени и мышцах и в меньшей степени в других органах и тканях) создаются условия для накопления в норме некоторого резерва углеводов. При повышении энерготрат в организме в результате возбуждения ЦНС обычно происходят усиление распада гликогена и образование глюкозы.
Помимо непосредственной передачи нервных импульсов к эффекторным органам и тканям, при возбуждении ЦНС повышаются функции ряда желез внутренней секреции (мозговое вещество надпочечников, щитовидная железа, гипофиз и др.), гормоны которых активируют распад гликогена, прежде всего в печени и мышцах (см. главу 8).
Как отмечалось, эффект катехоламинов в значительной мере опосредован действием цАМФ, который активирует протеинкиназы тканей. При участии последних происходит фосфорилирование ряда белков, в том числе гликогенсинтазы и фосфорилазы Ъ — ферментов, участвующих в обмене углеводов. Фосфорилированный фермент гликогенсинтаза сам по себе малоактивен или полностью неактивен, но в значительной мере активируется положительным модулятором глюкозо-6-фосфатом, который увеличивает VmaK фермента. Эта форма гликогенсинтазы называется D-формой, или зависимой (dependent) формой, поскольку ее активность зависит от глюкозо-6-фосфата. Дефосфорилированная форма гликогенсинтазы, называемая также I-формой, или независимой (independent) формой, активна и в отсутствие глюкозо-6-фосфата.
Таким образом, адреналин оказывает двойное действие на обмен углеводов: ингибирует синтез гликогена из УДФ-глюкозы, поскольку для проявления максимальной активности D-формы гликогенсинтазы нужны очень высокие концентрации глюкозо-6-фосфата, и ускоряет распад гликогена, так как способствует образованию активной фосфорилазы а. В целом суммарный результат действия адреналина состоит в ускорении превращения гликогена в глюкозу.
Распад гликогена (гликогенолиз)
Известно, что фосфоролитический распад играет ключевую роль в мобилизации полисахаридов *.
* В тканях человека и животных отечественными биохимиками Е.Л. Розенфельд и И.А. Поповой обнаружен также фермента-амилаза, катализирующий отщепление остатков глюкозы от молекулы гликогена по ос-1,4-связи. Однако ведущая роль в расщеплении гликогена в клетках принадлежит фосфорилазам.
324
1 Аден |
"и™" |
|
|1-.дрен,„и„ |
j Аден |
Г«17" \ |
1 |
|
1 L
Н.Р.С |
|
|
|
|
|
||
(активная) |
|
|
|
|
|||
Фосфорилазы переводят полисахариды (в частности, гликоген) из запасной формы в метаболически активную форму; в присутствии фосфо рилазы гликоген распадается с образованием фосфорного эфира глюкозы (глюкозо-1-фосфата) без предварительного расщепления на более крупные _с „ —_ т> ~5щей форме эту реакцию можно
^арида. В представить в следующем виде:
(С6Н10О6)п +
О4 -> (СвН10О6)м
Глюкозо-1 -фосфат,
а (С(Н10О5)п,- ту
где (СйН10О5)п означает полис ах аридную цепь глию же цепь, но укороченную на один глюкозный остаток.
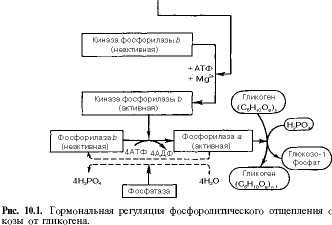
На рис. 10.1 изображены процесс распада гликогена до глюкозо-1-фосфата и участие в этом процеосе цДМФ. Фермент фосфорилаза существует в двух формах, одна из которых (фосфорилаза а) активна, в то время как другая (фосфорилаза Ь) обычно неактивна. Обе формы могут диссоциировать на субъединицы. Фосфорилаза b состоит из двух субъединиц, а фосфорилаза а—из четырех. Превращение фосфорилазы b в фосфорилазу а осуществляется ф ос формированием белка:
325
2 Фосфорилаза b + 4 АтФ -> Фосфорилаза а + 4 АДФ.
горый называется киназой может существовать как шаза фосфор и лазы жнкиназы (киназа цАМФ-зависимой
Катализируется эта реакция фермент фосфорилазы Ъ. Установлено, что эта киназа м в активной, так и в неактивной форме. Неактивн превращается в активную под влиянием фермента киназы фосфорилазы), и не просто протеинкнна: проте иикии азы.
Активная форма последней образуется при участии цАМФ, которая в свою очередь образуется из АТФ под действием фермента аденилатцик-лазы, стимулируемой, в частности, адреналином и глюкагоном. Увеличение содержания адреналина в крови приводит в этой сложной цепи реакций к превращению фосфорилазы Ъ в фосфорилазу а и, следовательно, к освобождению глюкозы в виде глюкозо-1-фосфата из запасного полисахарида гликогена. Обратное превращение фосфорилазы а в фосфорилазу Ъ катализируется ферментом фосфатазой (эта реакция практически необратима).
Образовавшийся в результате фосфоролитического распада гликогена глюкозо-1-фосфат превращается под действием фосфоглюкомутазы в глюкозо-6-фосфат. Для осуществления данной реакции необходима фосфо-рилироваиная форма фосфоглюкомутазы, т.е. ее активная форма, которая образуется, как отмечалось, в присутствии глюкозо-1,6-бисфосфата*.
![]()
![]()
'етфосфорили] гно, переноситх зо-1-бисфосфа!
ш козо-6-фосф:
ОЙ форШ
Во .рем ту при С-
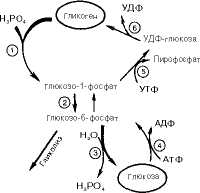
Жирными стрелками указан путь распада, тонкими-путь синтеза Цифрами обозначены ферменты 1 - фосфорилаза, 2-фос-фоглюкомутаза, 3 - глюкозо-б-фосфатаза,
зо-1-фосфат-уридилтрансфераза, б- глико-
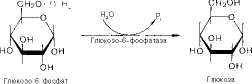
Заметим, что фосфорилированная глюкоза в противоположность неэте-рифицированной глюкозе не может легко диффундировать из клеток. Печень содержит гидролитический фермент глюкозо-6-фосфатазу, который и обеспечивает возможность быстрого выхода глюкозы из этого органа. В мышечной тканн глюкозо-6-фосфатаза практически отсутствует.
На рис. 10.2 отражены представления о путях распада и синтеза гликогена в печени *.
Можно считать, что сохранение постоянства концентрации глюкозы в крови является результатом одновременного протекания двух процессов: поступления глюкозы в кровь из печени и потребления ее из крови тканями, где она используется в первую очередь как энергетический материал.
В тканях (в том числе в печени) распад глюкозы происходит двумя основными путями: анаэробным (при отсутствии кислорода) и аэробным, для осуществления которого необходим кислород.
гликолиз
Гликолиз (от греч. glycys-сладкий и lysis-растворенне, распад)-это последовательность ферментативных реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ.
При аэробных условиях пируват проникает в митохондрии, где полностью окисляется до СО, и Н,О. Если содержание кислорода недостаточно, как это может иметь место в активно сокращающейся мышце, пируват превращается в лактат.
Итак, гликолиз-не только главный путь утилизации глюкозы в клетках, но и уникальный путь, поскольку он может использовать кислород, если
-б-фосфат ых ферм(

 последний
доступен (аэробные условия), но может
протекать и в отсутствие кислорода
(анаэробные условия).
последний
доступен (аэробные условия), но может
протекать и в отсутствие кислорода
(анаэробные условия).
Анаэробный гликолиз — сложный ферментативный процесс распада глюкозы, протекающий в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная кислота. В процессе гликолиза образуется АТФ. Суммарное уравнение гликолиза можно представить следующим образом:
СДА + 2АДФ + 2ФН->2СН3СН(ОН)СООН + 2АТФ + 2НгО. Глюкоза Молочная кислота
В анаэробных условиях гликолиз-единственный процесс в животном организме, поставляющий энергию. Именно благодаря гликолизу организм человека и животных определенный период может осуществлять ряд физиологических функций в условиях недостаточности кислорода. В тех случаях, когда гликолиз протекает в присутствии кислорода, говорят об аэробном гликолизе *.
Последовательность реакций анаэробного гликолиза, так же как и их промежуточные продукты, хорошо изучена. Процесс гликолиза катализируется одиннадцатью ферментами, большинство из которых выделено в гомогенном, клисталлическом или вые око очищенном виде и свойства которых достаточно известны. Заметим, что гликолиз протекает в гиало-плазме (цитозоле) клетки.
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофосфата на глюкозу за счет АТФ. Реакция катализируется ферментом гексокиназой:
![]()
АТФ АДФ I о
![]()
Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы и может считаться практически необратимым процессом.
Наиболее важным свойством гексокиназы является ее ингибирование глюкозо-6-фосфатом, т.е. последний служит одновременно и продуктом реакции, и аллостерическим ингибитором.
Фермент гексокиназа способен катализировать фосфорилирование не только D-глюкозы, но и других гексоз, в частности D-фруктозы, D-маннозы и т.д. В печени, кроме гексокиназы, существует фермент глюкокиназа, который катализирует фосфорилирование только D-глюкозы. В мышечной ткани этот фермент отсутствует (подробнее см. главу 16).
Второй реакцией гликолиза является превращение глюкозо-6-фос-фата под действием фермента глюкоз о-6-фосфат-изомер азы во фруктозо-6-фосфат:
снэон
СН2ОРОЭН2 [N.OH / Т
Эта реакция протекает легко в обоих направлениях, и для нее не требуется каких-либо кофакторов.
Третья реакция катализируется ферментом фосфофруктокнназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:
![]()
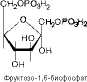
Фосфофруктокиназа относится к числу аллостерическнх ферментов. Она ингибируется АТФ и стимулируется АМФ *. При значительных величинах отношения АТФ/АМФ активность фосфофруктокнназы угнетается и гликолиз замедляется. Напротив, при снижении этого коэффициента интенсивность гликолиза повышается. Так, в неработающей мышце активность фосфофруктокнназы низкая, а концентрация АТФ относительно высокая. Во время работы мышцы происходит интенсивное потребление АТФ и активность фосфофруктокнназы повышается, что приводит к усилению процесса гликолиза.
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента фруктозо-1,6-бисфосфат расщепляется на две фосфотриозы:
. ~ с—о * неон
CHjOH СНзО, (.;j
Фруктозо 1,6 бисфосфат фосфат гид 3 фосфат
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов (дигидро-ксиацетонфосфата и глицеральдещц-3-фосфата)*.
Пятая реакция-это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:
С-О СН2ОРО3Нэ
3-фосфат
Равновесие данной изомеразной реакции сдвинуто в сторону дигид-роксиацетонфосфата: 95% дигидроксиацетонфосфата и около 5% глице-ральдегид-3-фосфата. В последующие реакции гликолиза может непосредственно включаться только один из двух образующихся триозофосфатов, а именно глицер альдегид- 3-фосфат. Вследствие этого по мере потребления в ходе дальнейших превращений альдегидной формы фосфотриозы ди-гидроксиацетонфосфат превращается в глицер альдегид-3-фосфат.
Образованием глицеральдегид-3-фосфата как бы завершается первая стадия гликолиза. Вторая стадия-наиболее сложная и важная. Она включает окислительно -во сстаиовительную реакцию (реакция гликолитической оксидо редукции), сопряженную с субстратным фосфор илироваиием, в процессе которого образуется АТФ.
В результате шестой реакции глицер альдегид-3-фосфат в присутствии фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-бисфосфоглицериновой кислоты** и восстановленной формы НАД (НАДН). Эта реакция блокируется йод- или бромацетатом, протекает в несколько этапов:
г ид-3-фосфатг
ид-3-фосфатг
' Глицеральдегид-3-фосфат- последний углевод в им превращениям подвергаются органические киот |й форме, поэтому наряду с названием свободных ]
НСОН + НАД* + Н3РО,
I
СН;О О
НАДН + Н+
