
- •Глава 1. Химии белков
- •Глава 2. Химия белков
- •Глава 5. Химия углеводов
- •Глава 8. Гормоны .... 248
- •Глава 6. Химия липидов 188
- •Глава 7. Витамины ... 204
- •Глава 9. Биомембраны и биоэнергетика
- •Глава 10. Метаболизм уг леводов
- •Глава 11. Пидов . .
- •Глава 14. Биосинтез белка 509
- •Глава 15. Взаимосвизь про цессов обмена веществ в ор ганизме 545
- •Глава 13. Обмен сложных
- •Глава 16. Печень .... 551
- •Глава 17. Кровь 567
- •Глава 18. Почки и моча 608
- •Глава 19. Нервиаи ткань 625
- •Глава 20. Мышечнаи ткань 645
- •Глава 21. Соединительная
- •Введение
- •Глава 1 химия белков
- •I 1.4. Аминокислотный состав некоторых природных белков, в процентах
- •Глава 2 химия сложных белков
- •Глава 3 химия нуклеиновых кислот
- •Глава 4 ферменты
- •Глава 5 химия углеводов
- •Глава 6
- •Глава 7 витамины
- •Жирорастворимые витамины
- •Водорастворимые витамины
- •Глава 8 гормоны
- •1. Тиролиберип (Пиро-Глу-Гис-Про-nHj):
- •2. Гонадолиберин является декапептидом, состоящим из 10 аминокислот в последовательности:
- •Глава 9 биомембраны и биоэнергетика
- •Глава 10 метаболизм углеводов
- •1,3 Бисфосфоглиц9рэт
- •Глава 11 метаболизм липидов
- •2 Ацетил-КоА
- •7 Ноос-сНг—c-ch3-co-
- •Глава 12 обмен простых белков
- •Глава 18 почки и моча
- •Глава 19 нервная ткань
- •В процентах от общих липидов
- •Глава 20 мышечная ткань
- •Глава 21 соединительная ткань
- •Глава 22 костнаяткань
Глава 9 биомембраны и биоэнергетика
ОСНОВНЫЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ БИОМЕМБРАН
Все клетки отграничены друг от друга и от окружающей среды с помощью специальной оболочки-клеточной мембраны. Со времен К. Негели, описавшего в 1855 г. структуру мембран, окружающих живые клетки, представления об устройстве и функциях мембран существенно обогатились. Клеточная мембрана во многом определяет свойства, поведение и даже форму клетки. Мембраны прокариот и эукариот различаются между собой по составу и свойствам. Растительные и животные клетки также отличаются друг от друга как по набору органелл, так и по свойствам мембран (рис. 9.1).
Состав и строение биологических мембран. Биологические мембраны состоят из белков и липидов. Углеводы присутствуют лишь в качестве составных частей сложных белков (гликопротеинов) и сложных липидов (гликолипидов). Нуклеиновые кислоты в небольшом количестве бывают ассоциированы с мембранами, но в состав мембранных структур не включаются. Вода составляет 20% от мембранного материала, а отношение белок/липид в зависимости от вида мембран колеблется от 0,25 (клетки миелиновой оболочки) до 3,0 (митохондриальные мембраны).
Лнпиды мембран представлены четырьмя основными группами: фосфо-липидами (основная доля), сфинголипидами, гликолипидами и стероидами. Фосфолипиды-это сложные эфиры фосфатидной кислоты. Основными фосфолипидами являются фосфатидилэтаноламин, фосфатидилсерин, фос-фатидилинозит и фосфатидилхолин. В состав фосфолипидов входят также дифосфатидилглицерины (кардиолипин), плазмалогены (1-О-алкенил-2-О ацилфосфолипиды) и диольные фосфолипиды. Сфинголипиды, которые являются производными церамида и монофосфорных эфиров различных спиртов, представлены в основном сфингомиелином. Гликолипиды-глико-зильные производные церамида —представлены как нейтральными церебро-зидами, так и их кислыми сульфоэфирами — сульфатидами. Производные церамида и нейраминовой кислоты-ганглиозиды-часто выделяют в отдельную группу липидов - гликосфинголипиды. Стероиды представлены холестерином (в мембранах животных клеток), ситостерином (в растительных клетках) и тетрахименином (обнаружен у тетрахимены).
Несмотря на различия в составе, все мембранные липиды построены по единому плану и легко смешиваются друг с другом, образуя монослойные или бислойные структуры (рис. 9.2). В этих структурах реализуется 2 типа взаимодействий: ионные взаимодействия полярных «голов» и гидрофобные взаимодействия жирнокислотных цепей. Благодаря этому мицеллы и липо-сомы, создаваемые протяженными бислойными структурами, достаточно стабильны в водном окружении.
В наружных (плазматических) мембранах животных клеток обнаруживается большое количество холестерина (около 21 моль%), меньше —фос-
298
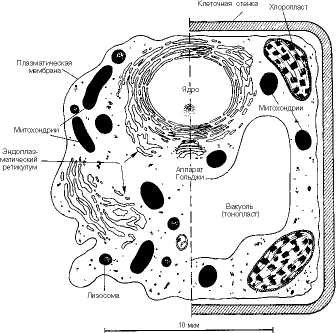
Рис. 9.1. Схематическое изображение животной (слева) и растительной (справа) клетки.
фатидилэтаноламина и еще меньше фосфатидилхолина. Для внутриклеточных мембран основным компонентом является фосфатидилхолин, и соотношение фосфатидилхолин/фосфатидилэтаноламин в них воегда больше 1.
Соотношение основных классов липидов мембран нейронов у различных животных почти не подвержено изменениям. По-видимому, это соотношение сформировалось на самых ранних стадиях эволюции и обеспечивает как стабильность липидного бислоя, так и возможность включения в него белковых молекул. В то же время жирнокислотные компоненты мембранных липидов сильно подвержены эволюционной и оезонной изменчивости.
Жирные кислоты, составляющие «хвост» липидных молекул, представлены насыщенными [от лауриновой (С12) до лигноцериновой (С24)] и ненасыщенными (мононенасыщенные пальмитоолеиновая и олеиновая; полиненасыщенные линолевая, линоленовая, арахидоновая) кислотами. У высших растений преобладают пальмитиновая, олеиновая и линолевая кислоты, а стеариновая почти не обнаруживается; в ряде случаев выявляются оксикислоты. В мембранах животных клеток, кроме пальмитиновой и олеиновой, много стеариновой кислоты и больше высокомолекулярных жирных кислот (содержат 20-24 углеродных фрагмента). Жирные кислоты, как
299
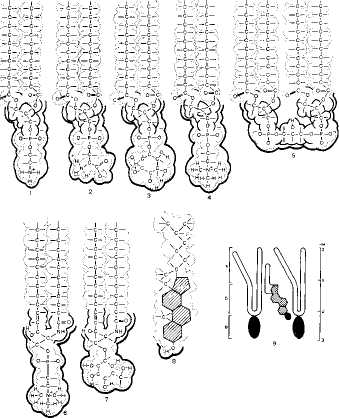
Рис. 9.2 Химичес кие форм\пы pv пространенных липидов биологических мембран 1 -фосфшщилэпночшин 2 фафшщилсерин; 3-фосфатидилинозит; 4-фосфатидилхолш 5-кардиотшшш 6 с фингомиспин " цсрсброзид; 8-холестерин; 9-расположение молекул) холестерин! мсад\ дв\мя мопскмши фосфолипидов: а-наименее упорядоченная облает бислоя, о оотсть упорядочив №М1я \о песте рином, в-область полярных «голов». Красные
правило, имеют четное число атомов углерода, но у цереброзидов и ган-глиозидов встречаются и нечетные углеводородные остовы. У бактерий полнненасыщенные жирные кислоты практически отсутствуют, но часто имеются разветвленные окси- и циклопропансодержащие кислоты. Для мембран термоацидофилышх, галофильных и метанообразующих архебак-терий характерно наличие нетипичных липидов, содержащих изопреноид-
300
Рис. 9.3. Распределение липидов между наружной (а) и внутренней (б) сторонами бислоя в мембранах эритроцитов (I), вируса гриппа (II) и с ар ко плазматического ретикулума кролика (III).
Фл-обищефосфолипвды; Фх-фосфатидилхолин; Фэ-фосфатидилэтаноламин; Фс-фосфати-дилсерин; См-офингомиелин; Фи-фоофатвдилинозит.
ные цепи, метальные концы которых соединены друг с другом ковалент-ными связями. Такие «шпильки» обеспечивают повышенную прочность липидного бислоя. (Подробнее о жирных кислотах см. главу 11.)
Липиды в составе бислоя распределяются асимметрично. Это свойство диктуется особенностями строения их молекул: фосфатидилхолину, фосфат-идилсерину, сфингомиелину присуща цилиндрическая форма, фосфатидил-этаноламину-форма конуса, а лизофосфолипидам (получаются в результате отщепления от молекулы одной жирнокислотной цепи)-форма перевернутого конуса. Природные мембраны также обладают исходной асимметрией (рис. 9.3).
Белки взаимодействуют с мембранным бислоем, в результате чего они либо ассоциируются с поверхностью мембраны - периферические белки, либо пересекают бислой один или несколько раз, прочно ннтегрируясь в него,- это интегральные белки. Интеграция оказывается возможной, если в первичной структуре белка имеются достаточно протяженные участки, содержащие гидрофобные аминокислотные последовательности. В таком случае белковые молекулы способны самопроизвольно встраиваться в бислой. При ассоциации рибосом с мембранными структурами встраивание гидрофобных белков в мембрану осуществляется синхронно с их синтезом при участии специальных механизмов, потребляющих энергию АТФ.
Участки белка, которые обращены во внеклеточную среду, могут подвергаться гликозилированию. В мембранах растений и бактерий полисахара играют самостоятельную роль, образуя наружную оболочку. В клетках животных, в которых наружный слой включает углеводы, имеется внутренний цитоскелет, состоящий из актина и других легко полимеризующихся белков; он имеет регулярную связь с мембранными белками и выполняет формообразующую и опорную функцию (рис. 9.4).
Фазовое состояние мембранных липидов. Мембранные липиды могут находиться в нескольких фазовых состояниях, т. е. они обладают мезомор-физмом. Два основных ламеллярных состояния, характерных для мембранных липидов в клеточных системах: кристаллическое и жидкокристаллическое-различаются плотностью упаковки и подвижностью находящихся в бислое белковых молекул. При более плотной упаковке ацильные цепи
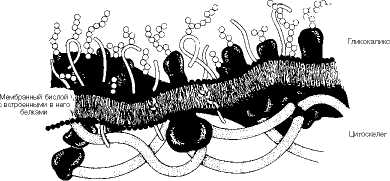
Рис. 9.4. Схематическое изображение клеточной мембраны.
липидов расположены под углом, близким к 90°, и все С—С-связи находятся в трйнс-конформации (максимально вытянуты). Фазовый переход приводит к увеличению подвижности ацильных цепей в бислое, увеличению угла их наклона и уменьшению плотности упаковки. Латеральная подвижность мембранных белков после фазового перехода возрастает, увеличивается вероятность образования их ассоциатов.
В липидном бислое могут также образовываться гексагональные структуры (вывернутые мицеллы). При их образовании в мембране возникают дефекты регулярной упаковки, что позволяет проникать через мембрану крупным молекулам, а также обеспечивает обмен компонентами монослоев в бислойной мембране.
Фазовые переходы мембранных липидов могут быть вызваны изменением температуры среды. Значение температуры, при котором наблюдается фазовый переход, называется критической температурой фазового перехода, или разделения фаз, если различные участки мембраны вследствие гетерогенности липидного состава по-разному отвечают на изменения температуры. Ионы Саг+, изменение числа ненасыщенных жирнокислотных цепей мембранных фосфолипидов и некоторые другие факторы также могут индуцировать фазовые переходы в бислое. Обычно критическая температура фазовых переходов приближена к температуре тела гомойотермных животных (или к температуре среды обитания пойкилотермных животных). Таким образом, достаточно незначительного изменения условий, чтобы изменить упаковку мембраны.
Специфические свойства биологических мембран. Благодаря указанным особенностям биологические мембраны имеют присущие им характерные черты. Они образуют протяженные бислойные структуры малой толщины (6-10 им), объединяющие белковые и липидные компоненты с различными свойствами.
Целостная структура мембраны создается за счет гидрофобных и электростатических взаимодействий, а не за счет ковалентных связей между составляющими ее молекулами белков и липидов. Гидрофобный липидный бислой представляет естественную преграду для проникновения полярных молекул. Мембраны асимметричны по своему исходному строеняю, что
302
обеспечивает градиент кривизны и спонтанное образование замкнутых структур.
Мембранный бислой обладает относительно малой микровязкостью. Другими словами, мембраны рыхло упакованы, что позволяет отдельным компонентам проявлять высокую подвижность в латеральном направлении.
Наружные мембраны клеток отличаются от внутренних по липидному составу (последние почти не содержат стеринов, имеют соотношение ФХ/ФЭ > 1) и обладают специфическим набором ферментов и рецепторов. Как правило, белки плазматических мембран со стороны внеклеточной среды обильно гликозилированы. Внутриклеточные мембраны содержат мало гликопротеинов и гликолипидов и характеризуются меньшей микровязкостью. Благодаря этому они могут образовывать органеллы малого размера. Мембранные белки выполняют различные специфические функции: рецепторные, транспортные, ферментативные, энергопреобразующие и т.д. (см. далее).
Функции биологических мембран. Как отмечалось, клеточные мембраны отграничивают содержимое клетки (или клеточной органеллы) от окружающей среды. Благодаря наличию специальных рецепторов они воспринимают сигналы из внешней среды (например, молекулы гормонов, называемые первичными мессенджерамн, или посредниками), в ответ на которые образуются вторичные мессенджеры, высвобождающиеся внутрь клетки. Так осуществляется преобразование сигналов, изменяющих клеточный метаболизм в соответствии с изменяющимися условиями среды (см. главу 8).
Мембранные рецепторы выполняют функции узнавания (иммунокомпе-тентная система), адгезии (обеспечение межклеточных контактов, формирование тканей), регуляции активности ионных каналов (электрическая возбудимость, создание мембранного потенциала). Мембранные ферменты в составе бислоя приобретают большую стабильность и способность к осуществлению реакций, которые в гидрофильном окружении протекали бы с весьма малой скоростью. Липидное окружение предоставляет таким белкам «привилегированные» условия функционирования, но и накладывает ограничения на поведение белковых ассоциатов: последнее сильно зависит от плотности упаковки (микровязкости) мембран. Поэтому факторы, влияющие на липидный состав и свойства клеточной мембраны, оказывают регулирующее влияние на функции мембранных белков.
Мембранные белки часто образуют олнгомерные ансамбли, взаимодействия между которыми (или длительность их существования в бислое) оказывается под контролем их мембранного окружения. Изменения микровязкости мембран в таком случае позволяют контролировать активность этих надмолекулярных структур.
Транспортная функция является одной из важных функций клеточных мембран (рис. 9.5). Мембрана создает существенные ограничения для проникновения различных веществ, однако она не является полностью непроницаемой: небольшие нейтральные молекулы могут проникать через бислой в области структурных дефектов. Этот процесс осуществляется по градиенту концентрации переносимого вещества-из области, где его содержание высоко, в область с более низким содержанием. Такой процесс называется простой диффузией, он осуществляется не избирательно и с низкой скоростью.
При облегченной днффузнн вещества также переносятся в направлении их концентрационного градиента, но с использованием специальных структур - переносчиков или каналов, увеличивающих скорость и специфичность переноса. Извест-
303
;::§::
1
Котрэнспорт '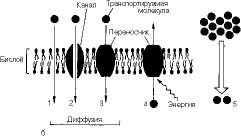
Рис. 9.5. Перенос веществ через мембрану.
а-виды переноса, б-пассивный и активный транспорт 1 - пассивная диффузия, 2-диффузия
н ы
высокоспецифические транслоказы
белковые
молекулы, переносящие аденило-вые
нуклеотиды через внутреннюю мембрану
митохондрий: Na+/Ca!+-обмен
ник -белок, входящий в состав плазматических
мембран многих клеток; низкомолекулярный
пептид бактериального происхождения
валиномицин-специфический переносчик
для ионов К+.
ы
высокоспецифические транслоказы
белковые
молекулы, переносящие аденило-вые
нуклеотиды через внутреннюю мембрану
митохондрий: Na+/Ca!+-обмен
ник -белок, входящий в состав плазматических
мембран многих клеток; низкомолекулярный
пептид бактериального происхождения
валиномицин-специфический переносчик
для ионов К+.
Облегченная диффузия, осуществляемая с помощью каналов, не обладает высокой специфичностью (специфичность определяется лишь размерами канала), но протекает с большей скоростью, а процесс переноса не достигает насыщения в широком диапазоне концентраций переносимого вещества. Функционирование
нирование переносчиков. Все эти примеры относятся к пассивному транспорту через мембрану.
Активный транспорт веществ осуществляется такими же механизмами, но протекает против концентрационного градиента и для своего осуществления должен быть сопряжен с энергодающим процессом. Основным источником энергии для активного транспорта является АТФ. Поэтому, как правило, эти системы представляют собой АТФазы. Примером систем активного транспорта ионов является Na+/K+-АТФаза плазматических мембран животных клеток, которая «выкачивает» из клетки ионы натрия в обмен на ионы калия, затрачивая на выполнение этой работы АТФ в стехиометрии Ша+/2К+/1АТФ. Саг+-АТФаза осуществляет активный транспорт кальция через мембрану со стехиометрией 2Саг+/1АТФ.
работающие как Н+-АТФазы. В результате их функционирования на мембране
возникает разность концентраций протонов (ДрН) и разность электрических потенциалов, в совокупности образующие протонный электрохимический потенциал, обозначаемый ДцН+ (см. далее). За счет работы Н+-АТФазы создается кислая среда в некоторых органеллах клетки (например, лизосомах, хромаффинных клетках надпочечников). В митохондриальной мембране Н+-АТФаза работает в обратном направлении, используя ДцН+, создаваемый в дыхательной цепи, для образования АТФ.
Наконец, в клетках широко представлен вторично-активный транспорт, в процессе которого градиент одного вещества используется для транспорта другого. С помощью вторично-активного транспорта клетки аккумулируют сахара, аминокислоты и выводят некоторые продукты метаболизма, используя градиент Na+, создаваемый в ходе работы Na+/K+-ATOa3bi (см. рис. 9.5).
БИОЭНЕРГЕТИКА
С позиций термодинамики (см. главу 4) метаболизм представляет собой совокупность процессов, в которой реакции, потребляющие энергию из внешней среды (эндэргонические), сопрягаются с энергодающими (экзэрго-ническими) реакциями, что позволяет живым существам оказывать постоянное сопротивление нарастанию энтропии. Выяснение биохимических механизмов, приводящих к генерации различных форм биологической энергии, является предметом биоэнергетики. Источником энергии служат реакции, в ходе которых соединения, содержащие атомы углерода в высо-ковосстановленном состоянии, подвергаются окислению, а специальные дыхательные переносчики присоединяют протоны и электроны (восстанавливаются) и в таком виде транспортируют атомы водорода к дыхательной цепи.
Биологические виды энергии. Энергетические превращения в живой клетке подразделяют на две группы: локализованные в мембранах и протекающие в цитоплазме. В каждом случае для «оплаты» энергетических затрат используется своя «валюта»: в мембране это ДцН+ или A^Na+, а в цитоплазме—АТФ, креатинфосфат и другие макроэргические соединения. Непосредственным источником АТФ являются процессы субстратного и окислительного фосфорилирования. Процессы субстратного фосфорилирования наблюдаются при гликолизе и на одной из стадий цикла трикарбоновых кислот (реакция сукцинил-КоА —> сукцинат; см. главу 10). Генерация ДцН+ и Д ц N а , используемых для окислительного фосфорилирования, осуществляется в процессе транспорта электронов в дыхательной цепн энергосопря-гающих мембран.
Энергия разности потенциалов на сопрягающих мембранах может обратимо превращаться в энергию АТФ. Эти процессы катализируются Н+-АТФ-синтазой в мембранах, генерирующих протонный потенциал, или Ка+-АТФ-синтазой (Ка+-АТФазой) в «натриевых мембранах» алкалофиль-ных бактерий, поддерживающих Д^Ша+ [Скулачев В.П., 1989]. На рис. 9-6 представлена схема энергетики живых клеток, использующих ДцН+ в качестве мембранной формы конвертируемой энергии. На схеме видно, что свет или энергия субстратов дыхания утилизируется ферментами фотосинтетической или дыхательной редокс-цепи (у галобактерий-бактериородопси-ном). Генерируемый потенциал используется для совершения полезной работы, в частности для образования АТФ. Будучи макроэргическим соединением, АТФ выполнняет функцию аккумулирования биологической энергии и ее последующего использования для выполнения клеточных функций. «Макроэргичность» АТФ объясняется рядом особенностей его
305
[с [ БэетериородопС! |
вет| |
[ Редокс-цепи| |
|
|_ТрэнСгидрогенэ: |
|
|
■т |
[Тепло]* |
|
|
•|Ыа-градиент| |
работа \" работа |
|
|
| работа | |
Ир] |
|
|
■[Креэтинфосфэт |
1 работа |
у" |
I |
' работа ] |
|
|
Субстратное ;форилировэ|- |
ние ' |
Рис. 9-6. Взаимозаменяемость различных видов биологической энергии при выполнении клеточной работы [Скулачев В.П., 1989].
Красной стрелкой показана взаимозаменяемость в клетке двух клеточных видов энергии-АТФ и ДцН+, для которых имеются также специальные буферные системы: креатинфосфат для АТФ
молекулы. Это прежде всего высокая плотность зарядов, сконцентрированная в «хвосте» молекулы, обеспечивающая легкость диссоциации терминального фосфата при водном гидролизе. Продукты этого гидролиза представляют собой АДФ и неорганический фосфат и далее-АМФ и неорганический фосфат. Это обеспечивает высокую величину свободной энергии гидролиза терминального фосфата АТФ в водной среде.
Тканевое дыхание и биологическое окисление. Распад органических соединений в живых тканях, сопровождающийся потреблением молекулярного кислорода и приводящий к выделению углекислого газа и воды и образованию биологических видов энергии, называется тканевым дыханием. Тканевое дыхание представляют как конечный этап пути превращений моносаха-ров (в основном глюкозы) до указанных конечных продуктов, в который на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов (жирные кислоты), белков (аминокислоты) и нуклеиновых оснований. Итоговая реакция тканевого дыхания будет выглядеть следующим образом:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О + 2780 кДж/моль.
(1)
Впервые сущность дыхания объяснил А.-Л. Лавуазье (1743-1794), обративший внимание на сходство между горением органических веществ вне организма и дыханием животных. Постепенно становились ясными принципиальные различия между этими двумя процессами: в организме окисление протекает при относительно низкой температуре в присутствии воды, и его скорость регулируется обменом веществ. В настоящее время биологическое окисление определяется как совокупность реакций окисления субстратов в живых клетках, основная функция которых- энерге-
306
тическое обеспечение метаболизма. В развитие концепций биологического окисления в XX в. важнейший вклад внесли А.Н. Бах, О. Варбург, Г. Крепе, В.А. Энгель-гардт, В.И. Палладии, В.А. Белицер, СЕ. Северин, В.П. Скулачев.
Потребление кислорода тканями зависит от интенсивности реакций тканевого дыхания. Наибольшей скоростью тканевого дыхания характеризуются почки, мозг, печень, наименьшей-кожа, мышечная ткань (в покое). Уравнение (2) описывает суммарный результат многоступенчатого процесса, приводящего к образованию молочной кислоты (см. главу 10) и протекающего без участия кислорода:
+ 65 кДж/моль.
(2)
Этот путь отражает, по-видимому, энергетическое обеспечение простейших форм жизни, функционировавших в бескислородных условиях. Современные анаэробные микроорганизмы (осуществляющие молочнокислое, спиртовое и уксуснокислое брожение) получают для жизнедеятельности энергию, производимую в процессе гликолиза или его модификаций.
гамид
ад ениндинукл е о ti
фосфат
(НЙДФ+)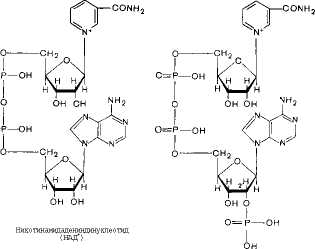
НАД+ НАДН
При этом в молекулу НАД+ (НАД Ф+) включаются 2 электрона и одни протон, а второй протон остается в среде.
Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазнновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно:
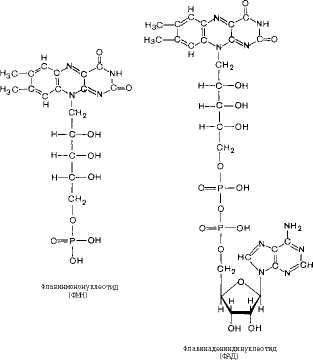
НДДН
+ Н+
+ флавиновый фермент - =^
НДД+
+ Флавиновь1й
ферм(
(ФМН) (ФМНН;)
Н [
Восстановленные формы этих кофакторов способны транспортировать водород и электроны к дыхательной цепи митохондрий или иных энерго-сопрягаюших мембран (см. далее).
Организация и функционирование дыхательной цепи. В клетках эукариот дыхательная цепь расположена во внутренней мембране митохондрий, у дышащих бактерий—в цитоплазматической мембране и специализированных структурах-мезосомах, или тилакоидах. Компоненты дыхательной цепи митохондрий в порядке убывания окислительно-восстанови тельного потенциала можно расположить, как показано в табл. 9-1.
Таблица 9.1. Окисштеньно-восстановитеиьныи потенциаи компонентов дыхательной цепи в стандартных >стювпях (кониентрапия компонентов 1М, рН 7,25°С)
Восстановлении J tin |
LII Л'ННН |
1 |
tin |
F, В |
||
НАДН + Н |
|
НАД+ |
|
|
-0,32 |
|
ФАДН, |
|
ФА1Г |
|
|
-0,05 |
|
Убихинол |
(KoQ-H,) |
Убихинон |
|
|
|
0,04 |
Цитохром |
|
Цитохром Ь |
F |
^) |
|
0,07 |
|
|
|
F |
е ) |
|
0,23 |
» |
с (Fe3+) |
» с |
F |
е ) |
|
1- 0,25 |
|
a (Fe!+) |
» а |
F |
е ) |
|
ь 0 29 |
* аг |
(Fe!+) |
а3 |
F |
е3+) |
|
Н0.55 |
нго |
|
'/Л |
|
|
+ 0,82 |
|
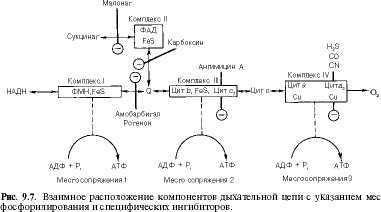
Молярные соотношения компонентов дыхательной цепи являются постоянными, ее компоненты встроены в митохоидриальную мембрану в виде 4 бел ко во -лип ид ных комплексов: НАДН-КоО^-редуктаза (комплекс I), сукцинат-Кор-редуктаза (комплекс II), KoQH,-цитохром с-редуктаза (комплекс III) и цитохром а- цитохром о кси-даза (комплекс IV) (рис. 9-7).
Если субстратом окисления служат а-кетокислоты, в переносе электронов на НАД? участвуют липоатсодержащие дегидрогеназы. В случае окисления пролина, глутамата, изоцнтрата и других субстратов перенос электронов происходит непосредственно на НАД"1". Восстановленный НАД в дыхательной цепи окисляется НАДН-дегидрогеназой, содержащей железосерный белок (FeS) и ФМН и прочно связанной с дыхательной цепью.
309
пгдыхате
юй и
[ производ-э представ-
у млекопитающих чг
1ву 7). Как любой хинон, KoQ с
тов, поставляемых в дыхательную цепь через флавиновые дегидрогеназы. Содержание его значительно превосходит содержание других компонентов дыхательной цепи.
Дополнительным участником дыхательной цепи является железосерный белок FeS {негемовое железо). Он участвует в окислительно-восстановительном процессе, протекающем по одноэлектронному типу. Первый участок локализации FeS находится между ФМН и KoQ, второй- между цитохромами b и cv Это соответствует тому факту, что со стадии ФМН путь протонов и электронов разделяется: первые накапливаются в митохоидриальном матриксе, а вторые идут на гидрофобные переносчики- KoQ и цитохромы.
Цитохромы в дыхательной цепи выстроены в порядке возрастания окислительно-восстановительного потенциала. Они представляют собой гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Ионы железа в составе гема при получении и отдаче электронов обратимо изменяют свою валентность.
В процессах тканевого дыхания наиболее важную роль играют цитохромы Ь, си с, а и аъ. Цитохром аъ представляет собой терминальный участок дыхательной цепи-цитохромоксидазу, которая осуществляет окисление цитохрома с и образование воды. Элементарный акт представляет собой двухэлектронное восстановление одного атома кислорода, т.е. каждая молекула кислорода одновременно взаимодействует с двумя электрон-транспортными цепями. При транспорте каждой пары электронов во внутримитохондриальном пространстве может накапливаться до 6 протонов (рис. 9-8).
Строение дыхательной цепи интенсивно исследуется. В числе последних достижений молекулярной биохимии-установление тонкой структу-
310
ры дыхательных ферментов с помощью рентгеноструктурного анализа. С помощью электронного микроскопа с наивысшим доступным в настоящее время разрешением можно «увидеть» структуру цитохромоксидазы (рис. 9.9).
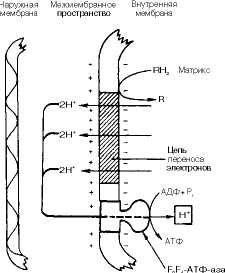
Окислительное фосфорилирование и дыхательный контроль. Функция дыхательной цепи-утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов (главным образом в цикле трикарбоновых кислот). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим окислительно-восстановительным потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи (см. рис. 9-7). В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая ДрН, электроны движутся по цепи переносчиков от убихннола к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-сннтазой. Таким образом, тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее.
Разность электрических потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника электронов, является движущей силой для образования АТФ и других видов полезной биологической энергии (см. рис. 9.6). Механизмы этих превращений описываетхемиосмотическая концепция превращения энергии в живых клетках. Она была выдвинута П. Митчеллом в 1960 г. для объяснения молекулярного механизма
311
![]()
 Рис.
9-9- Схематическое изображение
цитохромоксидазы с разрешением 05 нм
(а) иееактивногоцентрасразрешением2,8нм(б)
[Tsukiharaetal,Science.-1966.-Vol.
269.- P.
1069]
(Печатается с любезного разрешения
редакции журнала).
Рис.
9-9- Схематическое изображение
цитохромоксидазы с разрешением 05 нм
(а) иееактивногоцентрасразрешением2,8нм(б)
[Tsukiharaetal,Science.-1966.-Vol.
269.- P.
1069]
(Печатается с любезного разрешения
редакции журнала).
сопряжения транспорта электронов и образования АТФ в дыхательной цепи и быстро получила международное признание. За развитие исследований в области биоэнергетики П. Митчеллу в 1978 г. была присуждена Нобелевская премия. В 199? г. П. Бойеру и Дж. Уокеру была присуждена Нобелевская премия за выяснение молекулярных механизмов действия главного фермента биоэнергетики-протонной АТФ-синтазы.
Согласно хемиосмотической концепции, движение электронов по дыхательной цепи является источником энергии для транслокации протонов через митохоидриальную мембрану. Возникающая при этом разность электрохимических потенциалов (ДдН+) приводит в действие АТФ-синтазу, катализирующую реакцию
АДФ+Р, = АТФ.
(3)
В дыхательной цепи есть только 3 участка, где перенос электронов сопряжен с накоплением энергии, достаточным для образования АТФ (см. рис. 9.7), на других этапах возникающая разность потенциалов для этого процесса недостаточна. Максимальная величина коэффициента фосфорили-рования, таким образом, составляет 3, если реакция окисления идет с участием НАД, и 2, если окисление субстрата протекает через флавиновые дегидрогеназы. Теоретически еще одну молекулу АТФ можно получить в трансгидрогеназной реакции (если процесс начинается с восстановленного НАДФ):
НАДФН + НАД+ = НАДФ+ + НАДН + 30 кДж/моль.
(4)
Обычно в тканях восстановленный НАДФ используется в пластическом обмене, обеспечивая разнообразные синтетические процессы, так что равновесие трансгидрогеназной реакции сильно сдвинуто влево.
Эффективность окислительного фосфор ил ирования в митохондриях определяется как отношение величины образовавшегося АТФ к поглощенному кислороду: АТФ/О или Р/О (коэффициент фосфорилирования). Экспериментально определяемые значения Р/О, как правило, оказываются меньше 3. Это свидетельствует о том, что процесс дыхания не полностью сопряжен с фосфор ил ированием. Действительно, окислительное фосфорилирование в отличие от субстратного не является процессом, в котором окисление жестко сопряжено с образованием макроэргов. Степень сопряжения зависит главным образом от целостности митохондриальной мембраны, сберегающей разность потенциалов, создаваемую транспортом электронов. По этой причине соединения, обеспечивающие протонную проводимость (как 2,4-ди-нитрофенол), являются разобщителями.
Несопряженное дыхание (свободное окисление) выполняет важные биологические функции. Оно обеспечивает поддержание температуры тела на более высоком уровне, чем температура окружающей среды. В процессе эволюции у гомойотерм-ныхживотныхичеловека сформировались специальные ткани (бурыйжир), функцией которых является поддержание постоянной высокой температуры тела за счет регулируемого разобщения окисления и фосфорилирования в митохондриальной дыхательной цепи. Процесс разобщения контролируется гормонами.
В норме скорость митохондриального транспорта электронов регулируется содержанием АДФ. Выполнение клеткой функций с затратой АТФ приводит к накоплению АДФ, который в свою очередь активирует тканевое дыхание. Таким образом, клеткам свойственно реагировать на интенсивность клеточного метаболизма и поддерживать запасы АТФ на необходимом уровне. Это свойство называется дыхательным контролем.
За сутки человек потребляет около 550 л (24,75 моля) кислорода. Если считать, что в тканевом дыхании за этот период восстанавливается 40 г атомов кислорода (20 молей), а величину Р/О принять за 2,5, то в митохондриях должно синтезироваться 100 молей, или около 50 кг АТФ! При этом часть энергии окисления субстратов расходуется на совершение полезной работы, не превращаясь в АТФ (см. рис. 9.6).
Приведенные данные показывают, как важно организму поддержание процессов жизнедеятельности.
Свободное окисление. Одна из задач свободного (несопряженного) окисления—превращения природных или неприродных субстратов, называемых в этом случае ксенобиотиками (ксено —несовместимый, биос—жизнь). Они осуществляются ферментами днокснгеназамн и моноокснгеназамн. Окисление протекает при участии специализированных цитохромов, локализованных чаще всего в эндоплазматическом ретикулуме, поэтому иногда этот процесс называют мнкросомальным окислением [Арчаков А.И., 1975].
В реакциях свободного окисления участвуют также кислород и восстановленные дыхательные переносчики (чаще всего НАДФН). Акцептором электронов является цитохром Р-450 (иногда цитохром Ь5). Окисление субстрата протекает по следующей схеме:
SH+O2->SOH. (5)
Механизм действия оксигеназ включает изменение валентности входящих в их состав ионов двухвалентных металлов (железа или меди). Диоксигеназы присоединяют к субстрату молекулярный кислород, активируя его за счет электрона атома
313
железа в активном центре (железо при этом становится трехвалентнвш). Оксигена-ция протекает как атака субстрата образующимся супероксид-анионом кислорода. Одной из биологически важных реакций такого типа является превращение р-каротина в витамин А. Монооксигеназв1 требуют участия в реакции НАДФН, атомв1 водорода которого взаимодействуют с одним из атомов кислорода, посколвку толвко один электрон связывается с субстратом. К широко распространенным монооксигеназам относятся разнообразные гидроксилазы. Они принимают участие в окислении аминокислот, оксикислот, полиизопреноидрв.
В процессе свободного окисления вследствие особенностей используемых цепей передачи электронов не происходит образования АТФ; биологическая роль этих процессов заключается в метаболизме ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную функцию модификации чужеродных соединений. К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные свойства. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма (см. главу 12 и 13).
ГЕНЕРАЦИЯ СВОБОДНЫХ РАДИКАЛОВ В КЛЕТКЕ
Свободное окисление протекает при участии свободнорадикальных форм кислорода, которые образуются в процессе одноэлектронного восстановления кислорода и прежде всего супероксид-аннона кислорода.
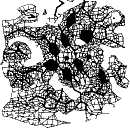
Обычно эти реакции своднорадикального окисления протекают в активном центре соответствующих ферментов, а промежуточные продукты не появляются во внешней среде. При изменении условий функционирования дыхательной цепи (например, при гипоксии) в ней также возможно одно-электронное восстановление кислорода, объясняющееся тем, что его сродство к убихинону выше, чем к цитохромоксидазе. Эти процессы приводят к образованию супероксид-аниона кислорода. Этот радикал может образовываться и под влиянием ультрафиолетовых лучей, а также путем взаимодействия кислорода с ионами металлов переменной валентности (чаще всего с железом) или в ходе спонтанного окисления некоторых соединений, например дофамина. Наконец, он может продуцироваться в клетках и такими ферментами, как ксантиноксидаза или НАДФН-оксидаза.
Образование супероксид-аниона кислорода имеет важное биологическое значение. Он является высокореакционным соединением, которое вследствие высокой гидрофильности не может покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей (рис. 9.10). Он способен активировать NO-синтазу, которая образует в тканях NO-радикал, обладающий свойствами вторичного посредника (активирует растворимую гуанилатциклазу, продукт которой — цГМФ—проявляет вазодилататорные свойства). С другой стороны, супероксид-анион способен снижать содержание NO-радикала, превращая его в пероксинитрит ONOOH (см. рис. 9.10).
Живые клетки имеют системы защиты от повышенной продукции свободных радикалов. Фермент супе роке идднсмутаза превращает супероксид-анион кислорода в менее реакционноспособный и более гидрофобный пероксид водорода Н2О2. Пероксид водорода является субстратом ката-лазы и глутатионзависимых пероксидаз, которые катализируют его превра-
314
щенне в молекулу воды. Однако пероксид водорода может генерировать гидроксил-радикал в присутствии двухвалентного железа или превращаться в гипохлорит-аннон ОСГ ферментом миелопероксидазой.
Как гипохлорит-анион, так и гидроксил-раднкал являются сильными окислителями. Они способны модифицировать белки, нуклеиновые кислоты, индуцировать перекисное окисление липидов (от которого наиболее сильно «страдают» полиненасыщенные мембранные липиды) и в результате цепных реакций приводить к множественным нарушениям мембран и к гибели клеток. Важным дополнением этих реакций является способность NO-радикала при взаимодействии с супероксид-анионом образовывать пероксинитрит, который может индуцировать так называемый апоптоз (запрограммированная гибель клеток), а в ходе своего спонтанного распада превращаться в гидроксил-радикал. Последний может образовываться также из гипохлорит-аннона в присутствии ионов железа.
Процессы, протекающие до момента образования гипохлорит-аниона или гидроксил-радикала, локализованы в цитоплазме и контролируются цитоплазматическими ферментами или природными водорастворимыми антиоксидантами. Например, таурин способен связывать гипохлорит-анион в форме хлорамннового комплекса, дипептид карнозин и его производные нейтрализуют гидроксил-радикал, а такие соединения, как белок ферритин, связывают железо. Перекисное окисление липидов, инициируемое в гидрофобном пространстве клеточных мембран, способен прерывать широко известный гидрофобный антиоксидант а-токоферол (витамин Е). Его высокая концентрация в биологических мембранах препятствует их повреждению свободными радикалами.
Полное подавление перекисных процессов в тканях, по-видимому, нецелесообразно, свободные радикалы обладают полезными свойствами. Они индуцируют апоптоз, участвуют в формировании клеточного иммунитета. Образование гидроперекисей жирнокислотных цепей полиненасыщенных фосфолипидов повреждает бислой и, стимулируя работу фосфолипаз, способствует высвобождению жирных кислот из состава мембранных липидов. Полиненасыщенная арахидоновая кислота является обычной мишенью для
315
свободнорадикальной атаки. Этот процесс может стимулировать ферментативные превращения ее по одному из двух путей — липоксигеназному или циклооксигеназному. В результате в клетке образуются важные биологические регуляторы: простагландины, лейкотриены, тромбоксаны. Лизофос-фолипиды, образующиеся при отщеплении модифицированной жирной кислоты, могут быть восстановлены до исходного состояния с использованием другой жирной кислоты (в форме ацил-КоА). Таким образом может регулироваться жирнокислотный состав липидных молекул в клеточной мембране.
Высокореакционные свободные радикалы кислорода, характеризующиеся высоким окислительным потенциалом и способностью к быстрым превращениям, могут индуцировать цепные реакции. В настоящее время признается важная роль свободнорадикальных процессов в развитии возрастных и патологических состояний в тканях [Владимиров Ю.А. и др., 1983]. Свободнорадикальные превращения вовлекаются в механизмы, повышающие выживаемость клеток в неблагоприятных условиях, а снижение генерации свободных радикалов в организме способствует ослаблению клеточного иммунитета. Однако усиленная генерация свободных радикалов сопровождает патологические состояния (болезнь Паркинсона, Альцгейме-ра) и сам процесс биологического старения.
МЕМБРАННЫЕ МЕХАНИЗМЫ РЕГУЛЯЦИИ МЕТАБОЛИЗМА
Биологические мембраны представляют собой динамическую структуру, компоненты которой подвержены быстрому метаболизму. Благодаря этому липидное окружение мембранных белков обладает способностью в соответствии с изменением условий функционирования изменять свои физико-химические свойства: упаковку, микровязкость, латеральную подвижность компонентов в бислое и т.д. Подавляющее большинство мембранных белков функционирует в составе олигомерных ансамблей, например в дыхательной цепи митохондрий. Транспортные белки также организуют ассоциаты в бислое: димеры (Са2*-АТФаза), тетрамеры (Na+/K*-AT<J>a3a) или даже более высокоорганизованные надмолекулярные комплексы.
Примером таких комплексов являются сложные мембранные структуры, включающие рецепторы и преобразователи сигналов, действие которых начинается с восприятия внешнего импульса (первичного посредника) на внешней стороне клеточной мембраны и завершается образованием вторичного посредника на внутренней стороне мембраны. Рассмотрим передачу и трансформацию сигнала от первичного посредника, роль которого, как правило, выполняют разнообразные гормоны, не проникающие через клеточную мембрану (см. главу 8).
Первичный посредник взаимодействует с соответствующим рецептором, что приводит к изменению конформации последнего и, как следствие, к увеличению латеральной подвижности в мембране. Это повышает вероятность взаимодействия активированного рецептора с преобразователем (роль преобразователей выполняют специфические мембраносвязанные белки, содержащие ГТФ в связанном состоянии,—G-белки, или ГТФ-связы-вающие белки) [Авдонин П.В., Ткачук В.А, 1994].
G-белки—центральная часть регуляторного мембранного ансамбля, представлены сложным олигомерным комплексом. Они относятся к гетеро-тримерным протеолипидам, состоящим из а-, р- и 7-субъединиц. [3-субъеди-
316
н ица
комплекса тесно ассоциирована с а- и
у-субъединицами. Последние модифицированы
жирнокислотными радикалами-миристоильным
радикалом в случае а-субъединицы
(присоединен через остаток глутаминовой
кислоты)
и геранилышм радикалом в случае
у-субъединицы (присоединен к
радикалу цистеина). Такая модификация
прочно ассоциирует G-белки
с
мембранным бислоем. Следовательно,
регуляторные белки функционируют
в тесной связи с мембраной, и их свойства
зависят от физико-химических характеристик
мембраны.
ица
комплекса тесно ассоциирована с а- и
у-субъединицами. Последние модифицированы
жирнокислотными радикалами-миристоильным
радикалом в случае а-субъединицы
(присоединен через остаток глутаминовой
кислоты)
и геранилышм радикалом в случае
у-субъединицы (присоединен к
радикалу цистеина). Такая модификация
прочно ассоциирует G-белки
с
мембранным бислоем. Следовательно,
регуляторные белки функционируют
в тесной связи с мембраной, и их свойства
зависят от физико-химических характеристик
мембраны.
Установлено, что нарушение взаимодействия между белковыми молекулами в олигомерном ансамбле №+/К+-АТФазы, происходящее, например, при ее свободиорадикальной модификации в ишемическом мозге, устраняет способность АТФ регулировать активность этого фермента.
Приведенные примеры указывают на важное биологическое значение олигомерных ассоциатов мембранных белков, состоящее в том, что при изменении физико-химических свойств мембраны соответственно изменяется и характер взаимодействия мембранных структур. Таким образом формируются обратные связи для приспособления обмена веществ к потребностям организма.
G-белки делятся на несколько типов, причем один из них выполняет стимулирующую, а остальные-ингибирующую функции. Взаимодействие соответствующего G-белка с ферментом-усилителем сигнала приводит к изменению свойств фермента и соответственно к изменению его активности. В случае циклического АМФ (рис. 9-11) возможна как активация адеинлатциклазы, так и ее ингибирование (в зависимости от типа G-белков, участвующих в трансформации сигнала). Итогом будет изменение скорости синтеза цитоплазматического цАМФ-активатора протеинкиназ, регулирующих функцию клеточных белков в результате их фосфорилирования. В неактивном состоянии протеинкиназа представляет собой димер из
каталитической и регуляторной субъединиц. Активация протеинкиназы обеспечивается связыванием цАМФ с регуляторной субъединицей, что вызывает диссоциацию и активацию каталитической субъединицы.
Субстратами протеинкиназ являются разнообразные белки, фосфорипи-рование которых изменяет их активность. Например, активация протеинкиназы А со стороны цАМФ приводит к фосфорипированию гликогенсин-тазы и гликогенфосфорипазы. При этом активность первого фермента подавляется, а второго усиливается (см. главу 10). Таким образом, появление в кровяном русле адреналина, активирующего аденилатциклазу миоци-тов, улучшает энергетическое обеспечение сокращений сердечной мышцы.
Известно несколько типов протеинкиназ, активируемых различными эффекторами. Субстраты протеинкиназ —огромное количество белков, фос-форипирование которых приводит к изменению их активности. Более того, обнаружены протеинфосфатазы, которые, осуществляя гидролиз фосфатной группы, возвращают белковую молекулу в исходное состояние. Во многих случаях мишенью действия киназ являются другие киназы, которые фосфорилируют фосфатазы, в свою очередь регулируя их функцию. Таким образом, регуляция метаболизма имеет каскадный характер.
