
- •Глава 1. Химии белков
- •Глава 2. Химия белков
- •Глава 5. Химия углеводов
- •Глава 8. Гормоны .... 248
- •Глава 6. Химия липидов 188
- •Глава 7. Витамины ... 204
- •Глава 9. Биомембраны и биоэнергетика
- •Глава 10. Метаболизм уг леводов
- •Глава 11. Пидов . .
- •Глава 14. Биосинтез белка 509
- •Глава 15. Взаимосвизь про цессов обмена веществ в ор ганизме 545
- •Глава 13. Обмен сложных
- •Глава 16. Печень .... 551
- •Глава 17. Кровь 567
- •Глава 18. Почки и моча 608
- •Глава 19. Нервиаи ткань 625
- •Глава 20. Мышечнаи ткань 645
- •Глава 21. Соединительная
- •Введение
- •Глава 1 химия белков
- •I 1.4. Аминокислотный состав некоторых природных белков, в процентах
- •Глава 2 химия сложных белков
- •Глава 3 химия нуклеиновых кислот
- •Глава 4 ферменты
- •Глава 5 химия углеводов
- •Глава 6
- •Глава 7 витамины
- •Жирорастворимые витамины
- •Водорастворимые витамины
- •Глава 8 гормоны
- •1. Тиролиберип (Пиро-Глу-Гис-Про-nHj):
- •2. Гонадолиберин является декапептидом, состоящим из 10 аминокислот в последовательности:
- •Глава 9 биомембраны и биоэнергетика
- •Глава 10 метаболизм углеводов
- •1,3 Бисфосфоглиц9рэт
- •Глава 11 метаболизм липидов
- •2 Ацетил-КоА
- •7 Ноос-сНг—c-ch3-co-
- •Глава 12 обмен простых белков
- •Глава 18 почки и моча
- •Глава 19 нервная ткань
- •В процентах от общих липидов
- •Глава 20 мышечная ткань
- •Глава 21 соединительная ткань
- •Глава 22 костнаяткань
Глава 6
химиялипидов
Липиды представляют собой обширную группу соединений, существенно различающихся по своей химической структуре и функциям. Поэтому трудно дать единое определение, которое подошло бы для всех соединений, относящихся к этому классу.
Можно сказать, что липиды представляют собой группу веществ, которые характеризуются следующими признаками: нерастворимостью в воде; растворимостью в неполярных растворителях, таких, как эфир, хлороформ или бензол; содержанием высших алкильных радикалов; распространенностью в живых организмах.
Под это определение попадает большое количество веществ, в том числе такие, которые обычно причисляют к другим классам соединений: например, жирорастворимые витамины и их производные, каротиноиды, высшие углеводороды и спирты. Включение всех этих веществ в число липидов в известной степени оправдано, потому что в живых организмах они находятся вместе с липидами и вместе с ними экстрагируются неполярными растворителями. С другой стороны, имеются представители липидов, которые довольно хорошо растворяются в воде (например, лизолецитины). Термин «липиды» является более общим, чем термин «липоиды», который объединяет группу жироподобных веществ, таких, как фосфолипиды, стерины, сфинголипиды и др.
БИОЛОГИЧЕСКАЯ РОЛЬ ЛИПИДОВ
Липиды играют важнейшую роль в процессах жизнедеятельности. Будучи одним из основных компонентов биологических мембран, липиды влияют на их проницаемость, участвуют в передаче нервного импульса, создании межклеточных контактов. Жир служит в организме весьма эффективным источником энергии либо при непосредственном использовании, либо потенциально —в форме запасов жировой ткани. В натуральных пищевых жирах содержатся жирорастворимые витамины и «незаменимые» жирные кислоты. Важная функция липидов-создание термоизоляционных покровов у животных и растений, защита органов и тканей от механических воздействий.
КЛАССИФИКАЦИЯ ЛИПИДОВ
Существует несколько классификаций липидов. Наибольшее распространение получила классификация, основанная на структурных особенностях липидов. По этой классификации различают следующие основные классы липидов.
188
A. Простые лишщы: сложные эфиры жирных кислот с различными спиртами.
Глицериды (ацилглицерины, или ацилглицеролы —по международной номенклатуре) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот.
Воска: сложные эфиры высших жирных кислот и одноатомных или двухатомных спиртов.
Б. Сложные липиды: сложные эфиры жирных кислот со спиртами, дополнительно содержащие и другие группы.
1. Фосфолипиды: липиды, содержащие, помимо жирных кислот и спир та, остаток фосфорной кислоты. В их состав часто входят азотистые основания и другие компоненты:
а) глицерофосфолипиды (в роли спирта выступает глицерол);
б) сфинголипиды (в роли спирта-сфингозин).
2. Гликолипиды (гликосфинголипиды).
Стероиды.
Другие сложные липиды: сульфолипиды, аминолипиды. К этому классу можно отнести и липопротеины.
B. Предшественники и производные липидов: жирные кислоты, глице рол, стеролы и прочие спирты (помимо глицерола и стеролов), аль дегиды жирных кислот, углеводороды, жирорастворимые витамины и гормоны.
ЖИРНЫЕ КИСЛОТЫ
Жирные кислоты —алифатические карбоновые кислоты —в организме могут находиться в свободном состоянии (следовые количества в клетках и тканях) либо выполнять роль строительных блоков для большинства классов липидов *.
В природе обнаружено свыше 200 жирных кислот, однако в тканях человека и животных в составе простых и сложных липидов найдено около 70 жирных кислот, причем более половины из них в следовых количествах. Практически значительное распространение имеют немногим более 20 жирных кислот. Все они содержат четное число углеродных атомов, главным образом от 12 до 24. Среди них преобладают кислоты, имеющие С16 и С18 (пальмитиновая, стеариновая, олеиновая и линолевая). Нумерацию углеродных атомов в жирно-кислотной цепи начинают с атома углерода карбоксильной группы. Примерно 3/4 всех жирных кислот являются непредельными (ненасыщенными), т.е. содержат двойные связи. Ненасыщенные жирные кислоты человека и животных, участвующие в построении липидов, обычно содержат двойную связь между (9-м и 10-м атомами углеводородов); дополнительные двойные связи чаще бывают на участке между 11-м атомом углерода и метальным концом цепи. Своеобразие двойных связей природных ненасыщенных жирных кислот заключается в том, что они всегда отделены двумя простыми связями, т.е. между
* В природе значительно чаще встречаются длинноцепочечные жирные кислоты с числом углеродных атомов больше двенадцати, часто их называют - «высшие жирные кислоты».
ними всегда имеется хотя бы одна метиленовая группа (—СН=СН— —СН2—СН=СН—). Подобные двойные связи обозначают как «изолированные».
Систематическое название жирной кислоты чаще всего образуется путем добавления к названию углеводорода окончания -овая. Насыщенные кислоты при этом имеют окончание -ановая (например, октановая кислота -систематическое название, каприловая кислота-тривиальное название), а ненасыщенные кислоты - -еновая (например, октадеценовая кислота -систематическое название, олеиновая кислота-тривиальное название) (табл. 6.1; 6.2).
Таблица 6.1. Некоторые физиологически важные насыщенные жирные кислоты
Число |
Тривиальное название |
Систематическое |
Химическая формула |
атомов С |
|
название |
соединения |
6 |
Капроновая |
Гексановая |
CHj-fCHJ.-COOH |
8 |
Каприловая |
Октановая |
сн3-(сн:).-соон |
10 |
Каприновая |
Декановая |
СН3-(СН,),-СООН |
12 |
Лауриновая |
Додекановая |
СН3-(СН,)|0-СООН |
14 |
Миристиновая |
Тетраде кановая |
СН,-(СНД,-СООН |
16 |
Пальмитиновая |
Гексадекановая |
СН,-(СН,) ,-СООН |
18 |
Стеариновая |
Октаде кановая |
СН3-(СН2),.-СООН |
20 |
Арахиновая |
Эйкозановая |
СН,-(СЮ, -СООН |
22 |
Беге новая |
Докозановая |
СН,-(СН,),.-СООН |
24 |
Лигноцериновая |
Те тракозановая |
СН3-(СН2)22-СООН |
В соответствии с систематической номенклатурой количество и положение двойных связей в ненасыщенных жирных кислотах часто обозначают с помощью цифровых символов: например, олеиновую кислоту как 18:1;9, линолевую кислоту как 18:2;9,12, где первая цифра—число углеродных атомов, вторая —число двойных связей, а следующие цифры — номера ближайших к карбоксилу углеродных атомов, вовлеченных в образование двойной связи.
В специальной литературе жирные кислоты часто изображают в виде зигзагообразной вытянутой линии, отражающей жесткость валентного угла атомов углерода в ИГ для насыщенной и в 123°—для двойной связи. Однако такая конформация является условной и справедлива только для случая, когда жирная кислота находится в кристаллическом состоянии. В растворах жирно-кислотная цепь может образовывать бесчисленное количество конформаций вплоть до клубка, в котором имеются и линейные участки различной длины в зависимости от числа двойных связей. Клубки могут слипаться между собой, образуя так называемые мицеллы. В последних отрицательно заряженные карбоксильные группы жирных кислот обращены к водной фазе, а неполярные углеводородные цепи спрятаны внутри мицеллярной структуры. Такие мицеллы имеют суммарный отрицательный заряд и в растворе остаются суспендированными благодаря взаимному отталкиванию.
Известно также, что при наличии двойной связи в жирнокислотной цепи вращение углеродных атомов относительно друг друга ограничено. Это обеспечивает существование ненасыщенных жирных кислот в виде геомет-
190
Таблица 6.2. Некоторые физиологически важиые ненасыщенные жириые кислоты
Число атомов С |
Тривиальное название |
Систематическое название, включая местонахождение двойных связей |
|
|
Моиоеиовые кислоты |
16 |
Пальмитиновая |
9 - ге ксаде це но вая |
18 |
Олеиновая |
9-октадеце новая |
22 |
Эруковая |
13-докозеновая |
|
|
Диеновые кислоты |
18 |
Ли нолевая |
9,12-октадека-диеновая |
|
|
Триеиовые кислоты |
18 |
Линоленовая |
9,12,15-октаде-катриеновая |
Химическая формра соединения
СН3— (CH2)S— СН= =СН—(СН2)_—СООН СН3—(СН2)7—СН= =СН-(СН,).-СООН СН3-(СН2),-СН= =СН—(СЩп—СООЖ
СН,-(СН,).-СН= =СН—СН2—СН = =СН-(СН2)7-СООН
СН3—СН2—СН = =СН—СН2—СН= =СН-СН2-СН= =СН—(СНА—СООН
20 Арахидоновая
Тетраеиовые кислоты
5,8,11,14-эйко-затетраеновая
СН3— (СН,)4— СН= = СН—СН,—СН = =СН—СН2—СН = =СН-СН2-СН== =СН-(СН2)3-СООН
22 Клупанодоновая
Пентаеиовые кислоты
7,10,13,16,19-доко-запентаеновая
СН3—СН2—СН= =СН —СН2—СН = =СН —СН2—СН = =СН — СН2— СН= = СН—СН2—СН = =СН-(СН2),-СООН
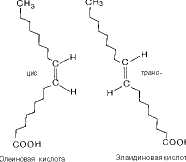
рических изомеров (рис. 6.1), причем природные ненасыщенные жирные кислоты имеют ({t/c-конфигурацию и крайне редко т^янс-конфигурации. Считают, что жирной кислоте с несколькими двойными связями ({реконфигурация придает углеводородной цепи изогнутый и укороченный вид. По этой причине молекулы этих кислот занимают больший объем, а при образовании кристаллов упаковываются не так плотно, как т^янс-изомеры. Вследствие этого цис-шомеры имеют более низкую температуру плавления (олеиновая кислота, например, при комнатной температуре находится в жидком состоянии, тогда как элаидиновая —в кристаллическом). Цис-конфигурация делает ненасыщенную кислоту менее стабильной и более подверженной катаболизму.
191
ГЛИЦЕРИДЫ (АЦИЛГЛИЦЕРОЛЫ)
Глицериды (ацилглицерины, или ацилглицеролы *) представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот. Если жирными кислотами этерифицированы все три гидроксильные группы глицерина (ацильные радикалы 1^, ГЦ и 1Ц могут быть одинаковы или различны), то такое соединеине называют триглицеридом (триацилглице-рол), если две-диглицеридом (диацилглицерол) и, наконец, если этери-фицирована одна группа-моноглицеридом (моноацилглицерол):
сн2—он
но—сн
I
сн2— он
но—сн
CH-J — ОН
-о—сн
о
сн,—о—
* Согласно рекомендации Международной номенклатурной комиссии, глицериды следует называть ацилглицеролами
Наиболее распространенными являются триглицериды, часто называемые нейтральными жирами или просто жирами. Нейтральные жиры находятся в организме либо в форме протоплазматического жира, являющегося структурным компонентом клеток, либо в форме запасного, резервного, жира. Роль этих двух форм жира в организме неодинакова. Протоплазматический жир имеет постоянный химический состав и содержится в тканях в определенном количестве, не изменяющемся даже при патологическом ожирении, в то время как количество резервного жира подвергается большим колебаниям.
Как отмечалось, основную массу природных нейтральных жиров составляют триглицериды. Жирные кислоты в триглицеридах могут быть насыщенными и ненасыщенными. Из жирных кислот чаще встречаются пальмитиновая, стеариновая и олеиновые кислоты. Если все три кислотных радикала принадлежат одной и той же жирной кислоте, то такие триглицериды называют простыми (например, трипальмитин, тристеарин, три олеин и т.д.), если разным жирным кислотам, то смешанными. Названия смешанных триглицеридов образуются в зависимости от входящих в их состав жирных кислот, при этом цифры 1, 2 и 3 указывают на связь остатка жирной кислоты с соответствующей спиртовой группой в молекуле глицерина (например, 1-олео-2-пальмитостеарин). Необходимо отметить, что положение крайних атомов в молекуле глицерина на первый взгляд равнозначно, тем не менее их обозначают сверху вниз-1 и 3. Это объясняется прежде всего тем, что в структуре триглицерида при пространственном ее рассмотрении крайние «глицериновые» атомы углерода становятся уже не равнозначными, если гидроксилы 1 и 3 ацилированы разными жирными кислотами. При необходимости применяют также систему стереохими-ческой нумерации (обозначают sn-stereochemical numbering): например, 1,2-дистеарил-З-пальмитил-зп-глицерол:
![]()
По этой системе, если в проекции Фишера гидроксильная группа при 2-м углеродном атоме глицерина располагается слева, атому углерода, находящемуся над ним, присваивается номер 1, а расположенному под ним-номер 3.
Действительно, углероды 1 и 3 глицерола, учитывая их пространственное расположение, неидентичны. Особенно четко это видно на примере молекулы триглицерида. Ферменты это различают и всегда специфичны только к одному из трех углеродов глицерина. Так, глицеролкиназа фосфорилирует глицерин в положении sn-З, в результате чего образуется глицерол-3-фосфат, но не глицерол-1-фосфат.
Жирные кислоты, входящие в состав триглицеридов, практически определяют их физико-химические свойства. Так, температура плавления триглицеридов повышается с увеличением числа и длины остатков насыщенных жирных кислот. Напротив, чем выше содержание ненасыщенных жирных кислот, или кислот с короткой цепью, тем ниже точка плавления.
193
Животные жиры (сало) обычно содержат значительное количество насыщенных жирных кислот (пальмитиновой, стеариновой и др.). благодаря чему при комнатной температуре оин твердые. Жиры, в состав которых входит много ненасыщенных кислот, при обычной температуре жидкие и называются маслами. Так, в конопляном масле 95% всех жирных кислот приходится на долю олеиновой, линолевой и линоленовой кислот и только 5%-на долю стеариновой и пальмитиновой кислот. В жире человека, плавящемся при температуре 15°С (при температуре тела он жидкий), содержится 70% олеиновой кислоты.
Глицериды способны вступать во все химические реакции, свойственные сложным эфирам. Наибольшее значение имеет реакция омыления, в результате которой из триглицеридов образуются глицерол и жирные кислоты. Омыление жира * может происходить как при ферментативном гидролизе, так и при действии кислот или щелочей.
ВОСКА
Воска-сложиые эфиры высших жирных кислот и высших одноатомных или двухатомных спиртов с числом углеродных атомов от 16 до 22 Общие их формулы можно представить так:
о о
R—О-С -Ч ; R—СН —О — 6- -г . R—СН —СН2 —О—С - К
В этих формулах R, R' и R"-возможные радикалы.
Воска могут входить в состав жира, покрывающего кожу, шерсть, перья. У растений 80% от всех липидов, образующих пленку на поверхности листьев и плодов, составляют воска. Известно также, что воска являются нормальными метаболитами некоторых микроорганизмов. Природные воска (например, пчелиный воск, спермацет, ланолин) обычно содержат, кроме указанных сложных эфиров, некоторое количество свободных жирных кислот, спиртов и углеводородов с числом углеродных атомов 21-35.
ФОСФОЛИПИДЫ
Фосфолипиды представляют собой сложные эфиры многоатомных спиртов глицерина или сфингозина с высшими жирными кислотами и фосфорной кислотой. В состав фосфолипидов входят также азотсодержащие соединения: холин, этаноламин или серии. В зависимости от того, какой многоатомный спирт участвует в образовании фосфолипида (глицерин или сфиигозин), последние делят на 2 группы: глицерофосфолипиды и сфинго-фосфолипиды. Необходимо отметить, что в глицерофосфолипидах либо холин, либо этаноламин или серии соединены эфирной связью с остатком фосфорной кислоты; в составе сфинголипидов обнаружен только холин. Наиболее распространенными в тканях животных являются глицерофосфолипиды.
Глицерофосфолипиды
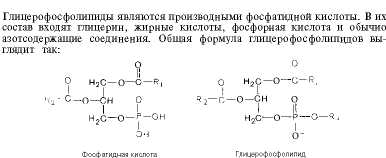
8 этих формулах Rj и Rj-радикалы высших жирных кислот, а R^-чаще радикал азотистого соединения. Для всех глицерофосфолипидов характерно, что одна часть их молекул (радикалы Rt и R;) обнаруживает резко выраженную гидрофобность, тогда как другая часть гидрофильна благодаря отрицательному заряду фосфорной кислоты и положительному заряду радикала R3.
Из всех липидов глицерофосфолипиды обладают наиболее выраженными полярными свойствами. При помещении глицерофосфолипидов в воду в истинный раствор переходит лишь небольшая их часть, основная же масса липидов находится в виде мицелл. Существует несколько групп (подклассов) глицерофосфолипидов. В зависимости от характера азотистого основания, присоединенного к фосфорной кислоте, Глицерофосфолипиды подразделяют на фосфатидилхолины (лецитины), фосфатидилэта-ноламины (кефалины) и фосфатидилсерины. В состав некоторых глицеро-фосфолипидов вместо азотсодержащих соединений входит не содержащий азота шестиуглеродный циклический спирт инозит, называемый также инозитолом. Эти липиды называются фосфатидилинозитолами.
Фосфатидилхолипы (лецитины). В отличие от триглицеридов в молекуле фосфатидилхолина одна из трех гидроксильных групп глицерина связана не с жирной, а с фосфорной кислотой. Кроме того, фосфорная кислота в свою очередь соединена эфирной связью с азотистым основанием-холином [НО — СН,—СН,—N+(CH3)j]. Таким образом, в молекуле фосфатидилхолина соединены глицерин, высшие жирные кислоты, фосфорная кислота и холин:
о II
О HjC-0-C-R.
II I
R,.- С-О-СН о
Фосфатидилэтаноламины. Основное различие между фосфатидилхоли-нами и фосфатидилэтаноламинами-наличие в составе последних азотистого основания этаноламина (НО—СН;—СН;—N+H3):
н,с—о—р—
о—сн
Фосфатидилсерины. В молекуле фосфатидилсерина азотистым соединением служит остаток аминокислоты серина (ПО СП; СП N11,):
О н9с—О — с—R, II I
— С—О—СН О
Фосфатидилсерины распространены гораздо менее широко, чем фос-фатидилхолины и фосфоэтаноламины, и их значение определяется в основном тем, что они участвуют в синтезе фосфатидилэтаноламинов.
Фосфатидилинозитолы. Эти липиды относятся к группе производных фосфатидиой кислоты, но не содержат азота. Радикалом (RJ в этом подклассе глицерофосфолипидов является шестиуглеродный циклический спирт инозитол:
О
ОН (,.C-O-C-R[ ,— 1 о
R,—С—О-СН
Фосфатидилинозитолы довольно широко распространены в природе. Оин обнаружены у животных, растений и микроорганизмов. В животном организме найдены в мозге, печени и легких.
Плазмалогены. От рассмотренных глицеролипидов плазмалогены отличаются тем, что вместо одного остатка высшей жирной кислоты со-
196
держат остаток а,|3-ненасыщеиного спирта, который образует простую связь (в отличие от сложиоэфирной связи, образуемой остатком жирной кислоты) с гидроксильной группой глицерина в положении С-1:
О Н2С—О—CH---CH--R
II I
R2 —С —О—СН О
Н?С — О — Р—О — СН2— СН2 — N(CH-,)3
Основными подклассами плазмалогенов являются фосфатидальхолины, фосфатидальэтаноламины и фосфатидальсерины. В разбавленных кислотах плазмалогены гидролизуются с образованием альдегида соответствующего а,|3-ненасыщенного спирта, т.е. при кислотном гидролизе плазмалогенов образуются «жирные» альдегиды, называемые плазмалями, что и легло в основу термина «плазмалоген».
Кардиолинин. Своеобразным представителем глицерофосфолипидов является кардиолипин, впервые выделенный из сердечной мышцы. По своей химической структуре кардиолипин можно рассматривать как соединение, в котором 2 молекулы фосфатидной кислоты связаны с помощью одной молекулы глицерина. В отличие от остальных глицерофосфолипидов кардиолипин является как бы «двойным» глицерофосфолипидом. Кардиолипин локализован во внутренней мембране митохондрий. Функция его пока неясна, хотя известно, что в отличие от других фосфолипидов кардиолипин обладает иммунными свойствами.
R.-C-O-CH HC-0-C-R^
I I
R2-C-O-CH2 H2C-O-C-R4
В этой формуле R1( R;, R3, R4-paniiKanbi высших жирных кислот.
Необходимо отметить, что в природе встречается свободная фосфатид-ная кислота, но в относительно небольших количествах по сравнению с глицерофосфолипидами. Среди жирных кислот, входящих в состав гли-церофосфолипидов, обнаружены как насыщенные, так и ненасыщенные (чаще стеариновая, пальмитиновая, олеиновая и линолевая).
Установлено также, что большинство фосфатидилхолинов и фосфати-дилэтаноламинов содержат одну насыщенную высшую жирную кислоту в положении С-1 и одну ненасыщенную высшую жирную кислоту в положении С-2. Гидролиз фосфатидилхолинов и фосфатидилэтаноламинов
197
при участии особых ферментов (эти ферменты относятся к фосфолипазам А,), содержащихся, например, в яде кобры, приводит к отщеплению ненасыщенной жирной кислоты и образованию лизофосфолипидов-лизофосфатидилхолинов, или лизо ф ос фатидил этаноламинов, оказывающих сильное гемолитическое действие:
Н,С—О—С— R.
|]
о
ио-сн „
Н,С—О—Р—О основание (холин или этэнолэмин)
Сфинголипиды (сфингофосфолипиды)
Сфингомиелины. Это наиболее распространенные сфинголипиды. В основном они находятся в мембранах животных и растительных клеток. Особенно богата ими нервная ткань. Сфингомиелины обнаружены также в ткани почек, печени и других органов. При гидролизе сфингомиелины образуют одну молекулу жирной кислоты, одну молекулу двухатомного ненасыщенного спирта сфингозина, одну молекулу азотистого основания (чаще это холин) и одну молекулу фосфорной кислоты. Общую формулу сфингомиелинов можно представить так:
СНч-(СНг)|3-СН=СН— СН — СН — NH-C-R
!.. 1 Д
Общий план построения молекулы сфингомиелина в определенном отношении напоминает строение глицерофосфолипидов. Молекула сфингомиелина содержит как бы полярную «головку», которая несет одновременно и положительный (остаток холина), и отрицательный (остаток фосфорной кислоты) заряды, и два неполярных «хвоста» (длинная алифатическая цепь сфингозина и ацильный радикал жирной кислоты). В некоторых сфингомиелинах, например выделенных из мозга и селезенки, вместо сфингозина найден спирт дигидросфингозин (восстановленный сфиигозин):
СН3-<СН2)12-СН=СН-СН-СН-СНЭОН CH3-(CH5)|4-CH-CH-CH3OH
ОН NHS ОН NH3
ГЛИКОЛИПИДЫ (ГЛИКОСФИНГОЛИПИДЫ)
Гликолипиды широко представлены в тканях, особенно в нервной ткани, в частности в мозге. Главной формой гликолипидов в животных тканях являются гликосфинголипиды. Последние содержат церамид, состоящий из спирта сфингозина и остатка жирной кислоты, и одни или несколько остатков Сахаров.
Простейшими гликосфинголипидами являются галактозилцерамиды и глюкозилцерамиды.
Галактозилцерамиды *-главные сфинголипиды мозга и других нервных тканей, но в небольших количествах встречаются и во многих других тканях. В состав галактозилцерамидов входит гексоза (обычно это D-галактоза), которая связана эфирной связью с гидроксильной группой аминоспирта сфингозина. Кроме того, в составе галактозилцерамида имеется жирная кислота. Чаще всего это лигноцериновая, нервоновая или це-реброновая кислота, т.е. жирные кислоты, имеющие 24 углеродных атома.
Сфингозин
СН3-(СНг),а-СН=СН-СН-СН-Ы-С-СН(ОН)-(СНг}а|-СНэ
![]()
Глюкозилцерамиды-простые гликосфинголипиды, представлены в тканях, отличных от нервной, причем главным образом глюкозил-церамидами. В небольших количествах они имеются в ткани мозга. В отличие от галактозилцерамидов у них вместо остатка галактозы имеется остаток глюкозы.
Более сложными гликосфинголипидами являются ганглиозицы, образующиеся из гликозилцерамидов. Ганглиозиды дополнительно содержат одну или несколько молекул сиаловой кислоты. В тканях человека доминирующей сиаловой кислотой является нейраминовая. Кроме того, вместо остатка глюкозы они чаще содержат сложный олигосахарид. Ганглиозиды в больших количествах находятся в нервной ткани. Они,
* ПрО!
дереброз!.
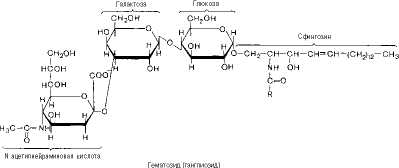
по-видимому, выполняют рецепторные и другие функции. Одним из простейших ганглиозидов является гематозид, выделенный из стромы эритроцитов. Он содержит церамид (ацилсфингозин), одну молекулу глюкозы, одну молекулу N-ацетилнейраминовой кислоты.
Все рассмотренные липиды принято называть омыляемыми, поскольку при их щелочном гидролизе образуются мыла. Однако имеются липиды, которые не гидролизуются с освобождением жирных кислот. К таким липидам относятся стероиды. Стероиды-широко распространенные в природе соединения. Они часто обнаруживаются в ассоциации с жирами. Их можно отделить от жира путем омыления * (они попадают в неомыляемую фракцию). Все стероиды в своей структуре имеют ядро, образованное гидрированным фенантреном (кольца А, В и С) и циклопентаном (кольцо D):

фгидрофенэнтрен Цик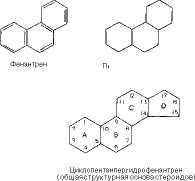
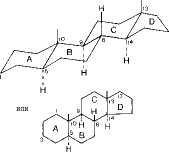
Рис. 6.2. Обобщенное стероидное ядро.
К стероидам относятся, например, гормоны коркового вещества надпочечников, желчные кислоты, витамины группы D, сердечные гликозиды и другие соединения. В организме человека важное место среди стероидов занимают стерины (стеролы), т.е. стероидные спирты. Главным представителем стеринов является холестерин (холестерол).
Ввиду сложного строения и асимметрии молекулы стероиды имеют много потенциальных стереоизомеров. Каждое из шестиуглеродных колец (кольца А, В и С) стероидного ядра может принимать две различные пространственные конформации - конформацию «кресла» либо «лодки».
В природных стероидах, в том числе и в холестерине, вое кольца в форме «кресла» (рис. 6.2), что является более устойчивой конформацией. В свою очередь по отношению друг к другу кольца могут находиться в цис- или т^янс-положениях.
Холестерин. Как отмечалось, среди стероидов выделяется группа соединений, получивших название стеринов (стеролов). Для стеринов характерно наличие гидроксильной группы в положении 3, а также боковой цепи в положении 17. У важнейшего представителя стеринов-холестерина-вое кольца находятся в трлнс-положении; кроме того, он имеет двойную связь между 5-м и 6-м углеродными атомами. Следовательно, холестерин является ненасыщенным спиртом:
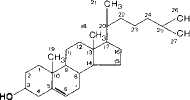
Кольцевая структура холестерина отличается значительной жесткостью, тогда как боковая цепь - относительной подвижностью. Итак, холестерин
содержит спиртовую гидроксильную группу при С-3 и разветвленную алифатическую цепь из 8 атомов углерода при С-17. Химическое название холестерина 3-гидрокси-5,6-холестен. Гидроксильная группа при С-3 может быть этерифицирована высшей жирной кислотой, при этом образуются эфиры холестерина (холестериды).
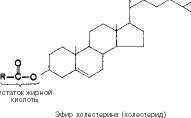
Каждая клетка в организме млекопитающих содержит холестерин. Находясь в составе мембран клеток, неэтерифицированный холестерин вместе с фосфолипидами и белками обеспечивает избирательную проницаемость клеточной мембраны и оказывает регулирующее влияние на состояние мембраны и на активность связанных с ней ферментов. В цитоплазме холестерин находится преимущественно в виде эфиров с жирными кислотами, образующих мелкие капли-так называемые вакуоли. В плазме крови как неэтерифицированный, так и этерифицированный холестерин транспортируется в составе липопротеинов.
Холестерин-источник образования в организме млекопитающих желчных кислот, а также стероидных гормонов (половых и кортикоидных). Холестерин, а точнее продукт его окисления-7-дегидрохолестерин, под действием УФ-лучей в коже превращается в витамин D3. Таким образом, физиологическая функция холестерина многообразна.
Холестерин находится в животных, но не в растительных жирах. В растениях и дрожжах содержатся близкие по структуре к холестерину соединения, в том числе эргостерин.
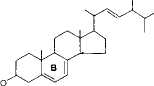
Эргостерин-предшественник витамина D. После воздействия на эргостерин УФ-лучами он приобретает свойство оказывать противорахитное действие (при раскрытии кольца В).
Восстановление двойной связи в молекуле холестерина приводит к образованию копростерина (копростанола). Копростерин находится в составе фекалий и образуется в результате восстановления бактериями кишечной микрофлоры двойной связи в холестерине между атомами С5 и С6.
![]()
Указанные стерины в отличие от холестерина очень плохо всасываются в кишечнике и потому обнаруживаются в тканях человека в следовых количествах.
