
- •Реферат
- •Содержание
- •Введение
- •1 Аналитический обзор
- •Транстиретин
- •1.1.1 Строение и функции ттr
- •1.1.2 Роль мутаций гена ттr в образовании амилоидов
- •1.2 Амилоидоз
- •1.2.1 Представления об амилоидозах
- •1.2.2 Структура амилоида и фибрилл
- •1.2.3 Механизм образования амилоидных фибрилл
- •Общие сведения о кардиомиопатии
- •Методы выявления мутаций
- •Патентный поиск
- •Цель и задачи работы
- •Экспериментальная часть
- •Материалы исследования
- •4.1.1 Реактивы
- •4.1.2 Лабораторное оборудование
- •4.2 Методы исследования
- •4.2.1 Стандартные растворы
- •4.2.2 Выделение днк из замороженной крови
- •4.2.3 Электрофоретическое разделение днк в агарозном геле
- •4.2.4 Выделение и очистка амплификатов из агарозного геля
- •4.2.5 Полимеразная цепная реакция
- •4.2.6 Электрофоретическое разделение продуктов амплификации в 8% полиакриламидном геле (пааг)
- •4.2.7 Окрашивание гелей
- •4.2.7.1 Окрашивание бромистым этидием
- •4.2.7.2 Окрашивание пааг нитратом серебра
- •4.2.8 Анализ конформационного полиморфизма одноцепочечной днк (sscp)
- •4.2.9 Анализ полиморфизма длин рестрикционных фрагментов
- •Результаты и обсуждение
- •5.1 Результаты
- •4 Экзона гена ttr в 9% пааг
- •2 Экзона гена ttr в 12% пааг
- •5.2 Обсуждение полученных результатов
- •Список использованных источников
- •Приложение а Охрана труда и окружающей среды
- •1 Опасные и вредные производственные факторы
- •1.1 Химические вредные и опасные факторы
- •1.2 Психофизиологические вредные и опасные факторы
- •2 Категория помещения по взрывопожароопасности
- •3 Вентиляционная установка
- •4 Освещение помещения
- •5 Аптечка и ее содержимое
- •6 Меры первой помощи
- •7 Охрана окружающей среды
- •Приложение б Оценка технико-экономических результатов исследования
- •1 Краткое резюме
- •2 Расчет затрат на проведение исследовательской работы
- •2.1 Затраты на сырье, материалы и реактивы
- •2.2 Энергетические затраты
- •2.3 Затраты на заработную плату
- •2.4 Амортизационные отчисления
- •2.5 Смета затрат на проведение научно-исследовательской работы
- •7 Расчет уровня рентабельности и цены нир
Общие сведения о кардиомиопатии
Кардиомиопатии (с греч. «kardia» - сердце , «mys, myos» - мышца, «pathos» - страдание, болезнь) — группа болезней сердца, при которых происходит поражение миокарда. Причины развития этого заболевания могут быть различны. Одной из них является амилоидоз [2]. Отложения амилоида располагаются во внеклеточном матриксе и около малых сосудов, расположенных в толще миокарда.
Поражение миокарда при кардиомиопатии характеризуется в основном такими патологическими процессами, как дистрофия и склероз, которые из-за неясности происхождения являются как бы первичными (идиопатическими). Выяснение этиологии данного заболевания затруднено, так как установление этиологии и уточнение патогенеза какого-либо заболевания, относящегося к кардиомиопатиям, способствовали бы выделению его из этой группы в ряд известных болезней или их исходов либо в самостоятельную нозологическую форму [39].
Кардиомиопатии включают несколько форм поражений сердца. Наиболее распространено подразделение кардиомиопатий на следующие основные формы: дилатационная, гипертрофическая и рестриктивная [40].
Дилатационная кардиомиопатия (застойная, или конгестивная) – характеризуется резким увеличением объема полостей сердца за счет дилатации при относительно тонких стенках (отношение толщины стенки желудочка к объему его полости значительно ниже нормы). Наиболее распространенная форма, встречается в 20-30% всех случаев [41].
Гипертрофическая кардиомиопатия включает разные формы:
1) диффузная, или симметричная, гипертрофическая — гипертрофия межжелудочковой перегородки и стенок левого (очень редко правого) желудочка, обозначаемая как идиопатическая гипертрофия миокарда, или как необструктивная гипертрофическая кардиомиопатия; характеризуется значительным увеличением толщины стенок желудочка и ее отношения к объему его полости;
2) асимметричная гипертрофия миокарда; проявления болезни зависят от локализации процесса; а) гипертрофия преимущественно верхней (базальной) части межжелудочковой перегородки (изолированная или в сочетании с гипертрофией передней боковой стенки левого желудочка); б) гипертрофия преимущественно апикальной части левого желудочка [42];
Рестриктивная кардиомиопатия — форма, объединяющая эндомиокардиальный фиброз и эозинофильный фибропластический эндокардит Леффлера; характеризуется значительным уменьшением диастолического объема желудочков из-за ригидности их стенок с резким ограничением растяжимости в диастолу, что проявляется нарушениями сердечной деятельности, напоминающими таковые при амилоидозе сердца, конструктивном перикардите [14].
Мутации в гене транстиретина приводят к образованию амилоидных отложений в сердце, что часто является причиной кардиомиопатий и других сердечных заболеваний [43].
Методы выявления мутаций
Выявление мутаций, представляющих собой замену одного или нескольких нуклеотидов, с помощью одного лишь ПЦР-анализа невозможно: длина мутантного фрагмента ДНК остается прежней; нарушается лишь конформационная структура, а вместе с ней и некоторые физико-химические свойства молекулы ДНК. Для обнаружения мутаций в виде замен используют анализ конформационного полиморфизма одноцепочечной ДНК (SSCP) и метод денатурирующего градиентного гель-электрофореза (DGGE). Еще два метода выявления точковых мутаций - гетеродуплексный анализ (НА) и химическое расщепление некомплементарных сайтов (CMC) - основаны на возникновении структурных нарушений в месте негомологичного спаривания при гибридизации нормальной и мутантной цепей ДНК [44]. Все эти методы анализа амплифицированных продуктов (кроме CMC-метода) для точной идентификации точковых замен в обязательном порядке предполагают секвенирование. В данной работе использовался анализ конформационного полиморфизма одноцепочечной ДНК.
Анализ конформационного полиморфизма одноцепочечной ДНК (SSCP - от англ. single strand conformation polymorphism). SSCP-анализ — наиболее часто используемый метод для выявления точковых замен внутри фрагмента ДНК (как правило, размером от 50 до 300 п.н.), полученного в результате ПЦР [45, 46]. Этот метод, предложенный в 1989 году, чрезвычайно эффективен, так как основан на регистрации различий электрофоретической подвижности одноцепочечной ДНК исследуемого и контрольного образцов одинаковых по длине, но различающихся по нуклеотидному составу (рисунок 4). Различие в нуклеотидной последовательности обусловливает разницу вторичной конформации одноцепочечных фрагментов, образующихся при денатурации (химической или температурной). Именно от вторичной конформации зависит электрофоретическая подвижность молекул ДНК в полиакриламидном геле. На процесс конформации также влияют различные внешние факторы: температура, концентрация акриламида и глицерина в геле, ионная сила буферных растворов.
Эффективность выявления мутаций этим методом существенно зависит от размера анализируемого фрагмента: при его длине менее 200 п.н. она составляет 80-95%, а при размере более 400 п.н. - около50% [47].
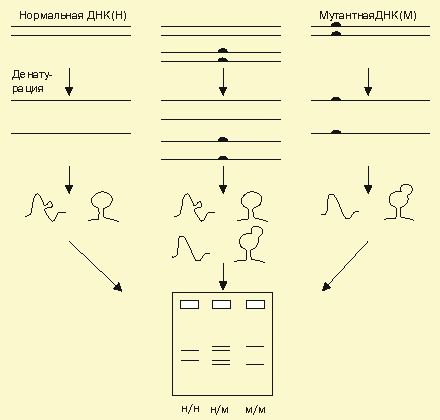
Рисунок 5 - Принципиальная схема SSCP метода [47]
После обнаружения фрагмента с измененной электрофоретической подвижностью, как правило, проводится секвенирование первичной последовательности ДНК мутантного фрагмента для определения конкретной нуклеотидной замены.
Наиболее эффективный способ выявления первичных мутаций - секвенирование кДНК или отдельных экзонов. Довольно часто первичный поиск нарушений в колирующих областях гена осуществляют именно таким образом. Для генов, имеющих сравнительно небольшие размеры, метод прямого секвенирования иногда используют как основной метод сканирования мутаций. Однако, несмотря на наличие методик (различные модификации ПЦР, использование мРНК для получения кДНК), переводящих секвенирование в разряд рутинных методов, секвенирование полноразмерной кДНК (т.е. всех экзонов) для выявления мутаций у отдельных индивидов остается трудоемкой, дорогой и требующей больших затрат времени процедурой [48].
С помощью ПЦР и последующего электрофореза продуктов амплификации в полиакриламидном или агарозном геле обнаруживают мутации, изменяющие длину амплифицированных фрагментов [49].
В основе метода ПЦР лежит природный процесс - комплементарное достраивание ДНК матрицы, осуществляемое с помощью фермента ДНК-полимеразы [50]. Эта реакция носит название репликации ДНК.
Естественная репликация ДНК включает в себя несколько стадий: 1) Денатурация ДНК (расплетение двойной спирали, расхождение нитей ДНК); 2) Образование коротких двухцепочечных участков ДНК (затравок, необходимых для инициации синтеза ДНК);
3) Синтез новой цепи ДНК (комплементарное достраивание обеих нитей).
Комплементарное достраивание цепи начинается не в любой точке последовательности ДНК, а только в определенных стартовых блоках- коротких двунитевых участках. Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные затравки (20 нуклеотидных пар), называемые праймерами. Праймеры комплементарны последовательностям ДНК на левой и правой границах специфического фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК протекает только между ними.
Для получения достаточного количества копий искомого характеристического фрагмента ДНК амплификация включает несколько (20-40) циклов.
Каждый цикл амплификации включает 3 этапа, протекающих в различных температурных режимах:
1 этап: денатурация ДНК (расплетение двойной спирали). Протекает при 93-95°C в течение 30-40 сек.
2 этап: присоединение праймеров (отжиг). Присоединение праймеров происходит комплементарно к соответствующим последовательностям на противоположных цепях ДНК на границах специфического участка. Для каждой пары праймеров существет своя температура отжига, значения которой располагаются в интервале 50-65°С. Время отжига -20-60 сек.
3 этап: достраивание цепей ДНК. Комплементарное достраивание цепей ДНК происходит от 5’-конца к 3’-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей ДНК служат добавляемые в раствор дезоксирибонуклеотидтрифосфаты (дНТФ). Процесс синтеза катализируется ферментом термостабильной ДНК-полимеразой (Taq-полимеразой) и проходит при температуре 70-72°С. Время протекания синтеза - 20-40 сек [51].
Образовавшиеся в первом цикле амплификации новые цепи ДНК служат матрицами для второго цикла амплификации, в котором происходит образование искомого специфического фрагмента ДНК (ампликона). В последующих циклах амплификации ампликоны служат матрицей для синтеза новых цепей. Поэтому, даже если в исходном растворе находилась только одна двухцепочечная молекула ДНК, то за 30-40 циклов в растворе накапливается около 108 молекул ампликона. Этого количества достаточно для достоверной визуальной детекции этого фрагмента методом электрофореза в агарозном геле [52].
Как упоминалось выше, мутации, изменяющие длину амплифицированных фрагментов, могут быть выявлены с помощью нативного электрофореза в полиакриламидном или агарозном гелях.
К менее трудоемким методам диагностики относят рестрикционный анализ – метод идентификации мутаций, которые затрагивают сайты рестрикции, проводится путем ПЦР, рестрикции амплифицированных фрагментов и определения их длины с помощью электрофореза. В основе метода лежит использование специальных ферментов – рестриктаз. Эти ферменты способны “находить” участки ДНК, в которых может быть локализована мутация, и “расщеплять” их. По количеству и длине фрагментов ДНК, полученных после действия рестриктаз, можно судить о наличии или отсутствии мутации или генетического нарушения в исследуемом гене.
Наличие сайтов рестрикции в геномной ДНК и их взаимное расположение однозначно определяются последовательностью нуклеотидов исследуемой ДНК, поскольку сам сайт рестрикции - не что иное, как строго определенная последовательность нуклеотидов ДНК, узнаваемая и расщепляемая рестриктазами. Следовательно, любая мутация, изменяющая последовательность нуклеотидов сайта рестрикции, уничтожает этот сайт. Полное расщепление анализируемой геномной ДНК отдельными рестриктазами приводит к образованию определенного набора фрагментов ДНК, число и размеры которых соответствуют расположению сайтов рестрикции. При отсутствии сайта узнавания в исследуемой области ДНК размеры амплифицированного фрагмента не изменятся после его обработки соответствующей эндонуклеазой, тогда как при полном соответствии полиморфной области сайгу pecтрикции образуются два фрагмента меньшей длины. У гетерозигот будут присутствовать 3 фрагмента, один из которых по длине будет соответствовать размеру амплификата до рестрикции, плюс 2 маленьких фрагмента с той же суммарной длиной. Таким образом, для выявления мутации используют разные молекулярно-генетические методы, в зависимости от характера мутации. Учитывают, каков самый распространенный тип мутации при данной болезни, размер измененной последовательности (большие перестройки или точечные мутации), относятся ли они к распространенным стабильным мутациям, или они более гетерогенны и возникли относительно недавно [44, 50].
