
- •Реферат
- •Содержание
- •Введение
- •1 Аналитический обзор
- •Транстиретин
- •1.1.1 Строение и функции ттr
- •1.1.2 Роль мутаций гена ттr в образовании амилоидов
- •1.2 Амилоидоз
- •1.2.1 Представления об амилоидозах
- •1.2.2 Структура амилоида и фибрилл
- •1.2.3 Механизм образования амилоидных фибрилл
- •Общие сведения о кардиомиопатии
- •Методы выявления мутаций
- •Патентный поиск
- •Цель и задачи работы
- •Экспериментальная часть
- •Материалы исследования
- •4.1.1 Реактивы
- •4.1.2 Лабораторное оборудование
- •4.2 Методы исследования
- •4.2.1 Стандартные растворы
- •4.2.2 Выделение днк из замороженной крови
- •4.2.3 Электрофоретическое разделение днк в агарозном геле
- •4.2.4 Выделение и очистка амплификатов из агарозного геля
- •4.2.5 Полимеразная цепная реакция
- •4.2.6 Электрофоретическое разделение продуктов амплификации в 8% полиакриламидном геле (пааг)
- •4.2.7 Окрашивание гелей
- •4.2.7.1 Окрашивание бромистым этидием
- •4.2.7.2 Окрашивание пааг нитратом серебра
- •4.2.8 Анализ конформационного полиморфизма одноцепочечной днк (sscp)
- •4.2.9 Анализ полиморфизма длин рестрикционных фрагментов
- •Результаты и обсуждение
- •5.1 Результаты
- •4 Экзона гена ttr в 9% пааг
- •2 Экзона гена ttr в 12% пааг
- •5.2 Обсуждение полученных результатов
- •Список использованных источников
- •Приложение а Охрана труда и окружающей среды
- •1 Опасные и вредные производственные факторы
- •1.1 Химические вредные и опасные факторы
- •1.2 Психофизиологические вредные и опасные факторы
- •2 Категория помещения по взрывопожароопасности
- •3 Вентиляционная установка
- •4 Освещение помещения
- •5 Аптечка и ее содержимое
- •6 Меры первой помощи
- •7 Охрана окружающей среды
- •Приложение б Оценка технико-экономических результатов исследования
- •1 Краткое резюме
- •2 Расчет затрат на проведение исследовательской работы
- •2.1 Затраты на сырье, материалы и реактивы
- •2.2 Энергетические затраты
- •2.3 Затраты на заработную плату
- •2.4 Амортизационные отчисления
- •2.5 Смета затрат на проведение научно-исследовательской работы
- •7 Расчет уровня рентабельности и цены нир
1.2.2 Структура амилоида и фибрилл
Изначально предполагалось, что амилоид относится к полисахаридам, о чем свидетельствует его название «сходный с крахмалом» («amylum» – крахмал) из-за способности окрашиваться йодом. Детальный химический анализ амилоида разного происхождения показал, что это вещество состоит в большей степени из белка [21]. Амилоид является сложным гликопротеидом, в котором фибриллярные и глобулярные белки тесно связаны с полисахаридами. С помощью электронной микроскопии (рисунок 2) и рентгеноструктурных методов четко показаны упорядоченность строения амилоида, наличие в нем волокнистых структур.
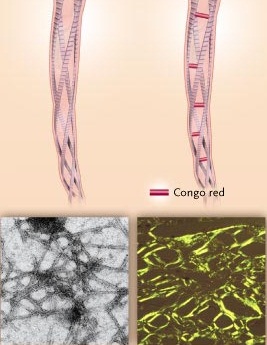
а б
а – результат электронной микроскопии; б – поляризационная микроскопия при окраске Конго красным
Рисунок 2 – Микроскопия амилоидных фибрилл [28]
Размеры фибрилл составляют 4,7 – 13 нм в поперечнике и до 1,6 мкм в длину [28, 29]. Рентгеноструктурные анализы показали, что фибриллы имеют β-складчатую структуру с отдельными β-слоями, ориентированными параллельно главной оси фибриллы, а водородные связи, которые соединяют полипептидные цепи, ориентированы вдоль оси фибриллы [30].
Кроме фибриллярного белка, в состав амилоида входит другой белок – так называемый Р-компонент, который одинаков при всех формах амилоидоза. Роль Р-компонента в амилоидогенезе неясна. В норме амилоидный Р-компонент является составной частью соединительной ткани и при иммунофлюоресцентном исследовании обнаруживается в интактных и измененных мембранах, в том числе в мембранах почек. Р-компонент составляет 15-20% общего белка амилоидных фибрилл [31]. Также в состав входят аполипопротеин Е, различные ингибиторы протеаз, внеклеточные компоненты матрикса.
Как уже упоминалось, известно около 30 белков, образующих амилоидные фибриллы. Они отличаются между собой по аминокислотным последовательностям, вторичным и третичным структурам. Несмотря на это, образованные ими амилоидные отложения имеют сходную фибриллярную структуру [32].
Все амилоидные фибриллы состоят из нескольких переплетенных протофибрилл, представляющих собой цилиндрический β-слой – полую нанотрубку (рисунок 3) диаметром 3 нм, в которой полипептидная цепь «накручена» вокруг оси фибриллы и формирует спираль. Виток такой спирали включает 20 аминокислот, витки взаимодействуют между собой водородными связями между амидами основной и боковых цепей (каждая карбоксильная группа предыдущего витка взаимодействует с аминогруппой последующего витка) [33].
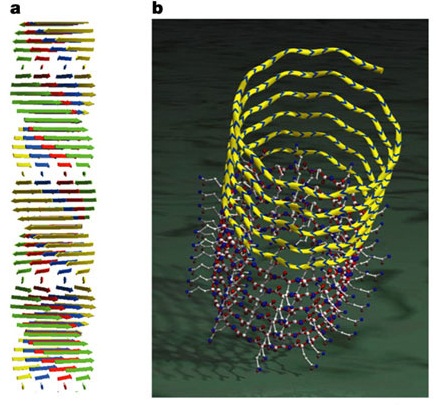
а – изображение β-складчатой структуры фибрилл;
б – изображение цилиндрического β-слоя
Рисунок 3 – Структура амилоидных фибрилл [28]
Фибриллы амилоида нерастворимы, обычно резистентны к протеолитическим ферментам и, откладываясь в органах, вытесняют и разрушают нормальную ткань. Важнейшим исследованием последних 25 лет (с 80-х гг. XX столетия) стало уточнение биохимической структуры основного белка амилоидных фибрилл, которая оказалась различной при разных формах амилоидоза.
1.2.3 Механизм образования амилоидных фибрилл
Фибриллогенез амилоида подчиняется основным принципам термодинамики, так же как и любая химическая реакция. Чем ниже свободная энергия системы, тем более устойчивым является состояние, в котором она пребывает. Так, «развернутое» состояние молекулы белка характеризуется довольно высоким уровнем свободной энергии. При переходе в «нативное» состояние с минимумом свободной энергии может происходить неправильная сборка белка, при котором он уже не способен формировать нативную структуру.
Рассмотрим рисунок 4 для изучения процесса образования фибрилл.

Рисунок 4 – Схематическое изображение механизма фибриллогенеза
Считают, что процесс фибриллогенеза можно рассматривать как двухступенчатую реакцию: на первой стадии, которая является обратимой, при определенных условиях происходит образование амилоидогенного промежуточного вещества, на второй стадии это промежуточное вещество не удаляется клеточным метаболизмом, что приводит к самосборке амилоидных фибрилл и образованию амилоида [34, 35].
После первой стадии в случае превышения порогового уровня концентрации амилоидных интермедиатов (происходит преодоление концентрационного барьера) образуются префибриллярные структуры – протофибриллы [36]. После этого процесс можно считать необратимым. Протофибриллы взаимодействуют друг с другом, формируя «зрелые» амилоидные фибриллы.
Причин неправильной сборки белков может быть несколько: 1) высокое содержание β-структур [21] ; 2) точечная замена аминокислоты в молекуле белка (при наследственных амилоидозов) [37]; 3) протеолиз белков-предшественников фибрилообразующего белка [36].
Для выяснения молекулярных механизмов амилоидозов необходимо изучить амилоидогенные свойства различных белков. Одним из таких белков, как уже говорилось, является транстиретин. Фибриллогенез TTR активно изучается, но так и не разработаны способы ингибирования образования фибрилл транстиретина [38].
