
- •Реферат
- •Содержание
- •Введение
- •1 Аналитический обзор
- •Транстиретин
- •1.1.1 Строение и функции ттr
- •1.1.2 Роль мутаций гена ттr в образовании амилоидов
- •1.2 Амилоидоз
- •1.2.1 Представления об амилоидозах
- •1.2.2 Структура амилоида и фибрилл
- •1.2.3 Механизм образования амилоидных фибрилл
- •Общие сведения о кардиомиопатии
- •Методы выявления мутаций
- •Патентный поиск
- •Цель и задачи работы
- •Экспериментальная часть
- •Материалы исследования
- •4.1.1 Реактивы
- •4.1.2 Лабораторное оборудование
- •4.2 Методы исследования
- •4.2.1 Стандартные растворы
- •4.2.2 Выделение днк из замороженной крови
- •4.2.3 Электрофоретическое разделение днк в агарозном геле
- •4.2.4 Выделение и очистка амплификатов из агарозного геля
- •4.2.5 Полимеразная цепная реакция
- •4.2.6 Электрофоретическое разделение продуктов амплификации в 8% полиакриламидном геле (пааг)
- •4.2.7 Окрашивание гелей
- •4.2.7.1 Окрашивание бромистым этидием
- •4.2.7.2 Окрашивание пааг нитратом серебра
- •4.2.8 Анализ конформационного полиморфизма одноцепочечной днк (sscp)
- •4.2.9 Анализ полиморфизма длин рестрикционных фрагментов
- •Результаты и обсуждение
- •5.1 Результаты
- •4 Экзона гена ttr в 9% пааг
- •2 Экзона гена ttr в 12% пааг
- •5.2 Обсуждение полученных результатов
- •Список использованных источников
- •Приложение а Охрана труда и окружающей среды
- •1 Опасные и вредные производственные факторы
- •1.1 Химические вредные и опасные факторы
- •1.2 Психофизиологические вредные и опасные факторы
- •2 Категория помещения по взрывопожароопасности
- •3 Вентиляционная установка
- •4 Освещение помещения
- •5 Аптечка и ее содержимое
- •6 Меры первой помощи
- •7 Охрана окружающей среды
- •Приложение б Оценка технико-экономических результатов исследования
- •1 Краткое резюме
- •2 Расчет затрат на проведение исследовательской работы
- •2.1 Затраты на сырье, материалы и реактивы
- •2.2 Энергетические затраты
- •2.3 Затраты на заработную плату
- •2.4 Амортизационные отчисления
- •2.5 Смета затрат на проведение научно-исследовательской работы
- •7 Расчет уровня рентабельности и цены нир
4.2.8 Анализ конформационного полиморфизма одноцепочечной днк (sscp)
Реагенты: общий объем 12 мл
9% гель 12% гель
36% АА 3 мл 4 мл
3×Т-F 4 мл 4 мл
PEG(6000) 60 мг 60 мг
PSA 0,12 мл 0,12 мл
TEMED 0,01 мл 0,01 мл
H2O 4,87 мл 3,87 мл
Состав буфера:
1×Т-F буфер: |
60 мМ HCOOH |
|
1 М Tris рН 9,0 |
1×T-Gly буфер: |
25 мМ Tris рН 8,3 |
|
250 мМ глицин |
Приготовление:
Смешать амплификат с формамидом в соотношении 1:5.
Прогреть на кипящей водяной бане 3 минуты.
Поставить на лед на 15-30 минут.
Нанести на гель.
Установить стекла на прибор, залить буфер. В крайние дорожки залить формамид, в самую последнюю залить краску – кселен-цианол. Нанести пробы (весь объем, который смешали). Прибор заполнить Tr-Gly буфером, установить напряжение 210 В (снижать по мере нагревания стекла).
Полученный гель окрашивать с помощью нитрата серебра.
4.2.9 Анализ полиморфизма длин рестрикционных фрагментов
Анализ ДНК проводили при помощи эндонуклеаз рестрикции («SibEnzime», Новосибирск) по стандартной методике в соответствии инструкции производителя.
Реакционная смесь имела конечный объем 20 мкл. В состав смеси входили следующие реактивы:
- эндонуклеаза рестрикции в количестве, необходимом для гидролиза заданного количества ДНК;
- 10×буфер.
Рестрикцию проводили при температуре, оптимальной для данной эндонуклеазной рестрикции.
Результаты и обсуждение
5.1 Результаты
В Отделе молекулярной генетики НИИЭМ СЗО РАМН совместно с лабораторией кардиомиопатий ИССЗ СПбГМУ им. акад. И.П. Павлова ранее проводилось комплексное исследование, направленное на изучение механизмов фибриллогенеза транстиретина. Одним из аспектов исследования являлось исследование гена ТТR у больных кардиомиопатиями [54]. В этом исследовании были обследованы 270 образцов, и найдены изменения в гене только у трех пациентов.
В ходе написания данной дипломной работы был использован материал, которым являлась коллекция геномной ДНК, полученная из крови больных с кардиомиопатиями разного генеза (гипертрофической, дилатационной, рестриктивной). Были исследованы ДНК 60 пациентов из числа жителей Санкт-Петербурга. Биоматериал также был предоставлен лабораторией кардиомиопатий ИССЗ СПбГМУ им. акад. И.П. Павлова.
Включение в исследование пациентов происходило при наличии данных морфологического и инструментального обследования и клиническим симптомам, соответствующим кардиомиопатиям различного рода [55]. Возраст пациентов – от 18 до 80 лет. У всех больных была выявлена хроническая сердечная недостаточность II – IV функционального класса NYHA (New York Heart Association), диастолическая дисфункция левого и/или правого желудочков сердца. У всех пациентов при окрашивании гистологических препаратов миокарда и/или слизистой щеки Конго красным была положительная реакция. Было получено согласие больных для изучения геномной ДНК с целью поиска мутаций в гене транстиретина.
В процессе работы было выделено ДНК из крови пациентов по стандартной методике (методом Кюнкеля) [53]. Таким образом, было получено 60 образцов. В дальнейшем все образцы были проверены на качество выделения и концентрацию с помощью электрофореза в 0,8% агарозном геле.
ПЦР-продукты каждого из четырех экзонов гена транстиретина были получены с помощью метода полимеразной цепной реакции (ПЦР). Для этого были подобраны соответствующие пары праймеров для всех четырех экзонов гена TTR. Для улучшения выхода амплификата были отработаны условия и подобраны оптимальные температуры отжига для праймеров: 1 экзон - 58°С, 2 экзон - 56°С, 3 экзон - 56°С, 4 экзон - 55°С. Была проведена амплификация ДНК всех 60 пациентов с праймерами для 1, 2, 3 и 4 экзонов.
С помощью электрофореза в 8%-ном полиакриламидном геле (ПААГ) в однократном ТВЕ-буфере была проведена проверка специфичности реакции и количества продуктов амплификации. Размер фрагмента оценивали с помощью маркера молекулярного веса от 100 до 1000 с шагом 100 пар нуклеотидов фирмы «Медиген» (Новосибирск, Россия).
Все ПЦР-продукты соответствуют своим размерам, это можно увидеть на рисунках 6-9.
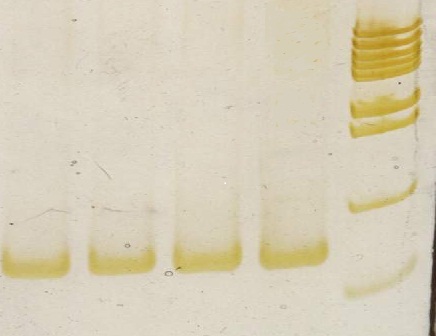
1 2 3 4 5
139 п.н.
200 п.н.
100 п.н.
1-4 – образцы ДНК исследуемых пациентов; 5 – маркер молекулярного веса от 100 до 1000 с шагом 100 пар нуклеотидов
Рисунок 6 - Электрофореграмма продуктов амплификации
участка экзона 1 гена TTR в 8% ПААГ
1 2 3 4 5

200 п.н.
178 п.н.
1 – маркер молекулярного веса от 100 до 1000 с шагом 100 пар нуклеотидов; 2-5 – образцы ДНК исследуемых пациентов
Рисунок 7 - Электрофореграмма продуктов амплификации
участка экзона 2 гена TTR в 8% ПААГ
1 2 3
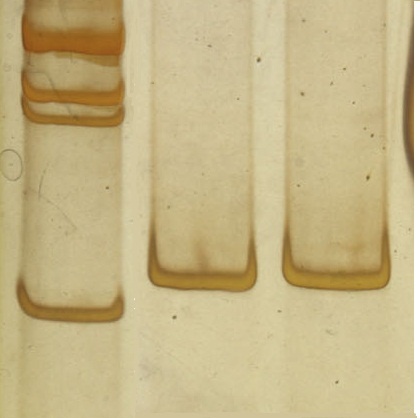
300 п.н.
200 п.н.
203 п.н.
1 – маркер молекулярного веса от 100 до 1000 с шагом 100 пар нуклеотидов; 2-3 – образцы ДНК исследуемых пациентов
Рисунок 8 - Электрофореграмма продуктов амплификации
участка экзона 3 гена TTR в 8% ПААГ
1 2 3

284 п.н.
300 п.н.
200 п.н.
1-2 – образцы ДНК исследуемых пациентов; 3 – маркер молекулярного веса от 100 до 1000 с шагом 100 пар нуклеотидов
Рисунок 9 - Электрофореграмма продуктов амплификации
участка экзона 4 гена TTR в 8% ПААГ
Поиск мутаций проводили с помощью анализа конформационного полиморфизма однонитевых фрагментов ДНК (SSCP-анализ), суть которого заключается в регистрации различий в электрофоретической подвижности однонитевых фрагментов ДНК, одинаковых по протяженности, но отличающихся по пространственной структуре молекул вследствие нуклеотидных замен.
Для лучшего разделения однонитевых конформеров ДНК при SSCP-анализе использовали трис-глициновый буфер и полиакриламидные гели (ПААГ) разной концентрации. Так, для 1 и 2 экзона использовался 12%-ный ПААГ, а для 3 и 4 экзонов – 9%-ный ПААГ. Окрашивание образцов ДНК после проведения электрофореза в ПААГ осуществляли раствором нитрата серебра.
Результаты SSCP-анализа на рисунках 10-12.
1 2 3 4
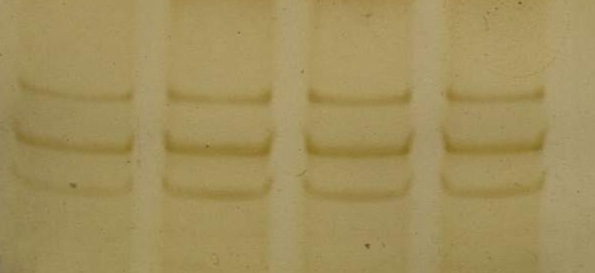
1-4 – образцы ДНК пациентов без мутаций
Рисунок 10 – Электрофореграмма SSCP-анализа продуктов амплификации 1экзона гена TTR в 12% ПААГ
1 2 3 4

1-4 – образцы ДНК пациентов без мутаций
Рисунок 11 – Электрофореграмма SSCP-анализа продуктов амплификации 3экзона гена TTR в 9% ПААГ
1 2 3 4

1-4 – образцы ДНК пациентов без мутаций
Рисунок 12 – Электрофореграмма SSCP-анализа продуктов амплификации
