
- •2011-2012 Учебного года
- •Требования к членам экзаменационной комиссии
- •Экзаменационные билеты по химии (9 класс)
- •Эталоны выполнения практико-ориентированных заданий Билет № 1
- •Билет № 2
- •Билет № 3
- •Билет № 4
- •Билет № 5
- •Билет № 6
- •Билет № 7
- •Билет № 8
- •Билет № 9
- •Билет № 10
- •Билет № 11
- •Билет № 12
- •Билет № 13
- •Билет № 14
- •Билет № 15
- •Билет № 16
- •Билет № 17
- •Билет № 18
- •Билет № 19
- •Билет № 20
- •Билет № 21
- •Билет № 22
- •Билет № 23
- •Билет № 24
- •Билет № 25
Билет № 8
Опыт. Проведение реакций, подтверждающих качественный состав предложенной соли, например сульфата меди(II).
Качественный состав соли доказывают с помощью реакций, сопровождающихся выпадением осадка или выделением газа с характерным запахом или цветом. Образование осадка происходит в случае получения нерастворимых веществ (определяем по таблице растворимости). Газы выделяются при образовании слабых кислот (для многих требуется нагревание) или гидроксида аммония.
Наличие иона меди можно доказать добавлением гидроксида натрия, выпадает голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Наличие сульфат-иона доказывается выпадением белого кристаллического осадка при добавлении растворимой соли бария:
CuSO4 + BaCl2 = BaSO4↓ + CuCl2
Билет № 9
Задача
А: Какая масса хлорида магния образуется, если в реакцию вступит 547,5 г 20% раствора соляной кислоты?
Б: Какая масса аммиака выделится, если хлорид аммония смешали с 50 г 20% раствора гидроксида кальция?

Билет № 10
Задача
А: Вычислить массовую долю химических элементов, входящих в состав метана (СН4).
Б: Вычислить массовую долю кальция, входящего в состав ортофосфата кальция.
Билет № 11
Опыт. Выделение поваренной соли из ее смеси с речным песком.
Добавить к смеси немного воды, перемешать. Соль растворится, песок осядет на дно.
Профильтровать полученную смесь. Если нет фильтра, дать отстояться и слить верхнюю часть воды с растворенной солью. (Здесь мы используем различную растворимость соли и песка в воде)
Выпарить соль из раствора в фарфоровой чашке. Прекратить выпаривание при появлении кристаллов соли, иначе чашка может треснуть. С горячей чашкой обращаться осторожно!!! Спиртовку тушить, накрывая колпачком. Спички чиркать «от себя».
Билет № 12
Опыт. Получение и собирание водорода. Доказательство наличия водорода в пробирке.
Водород можно получить взаимодействием цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2↑
Водород легче воздуха, поэтому его собирают в пробирку, перевернутую дном кверху.
Чтобы доказать наличие водорода в пробирке и проверить его на чистоту, пробирку с водородом подносят к пламени спиртовки (пробирку держим держателем для пробирок!). Чистый водород сгорает со звонким хлопком. Если водород смешан с воздухом, звук будет визгливый, говорят «сгорает со свистом».
Билет № 13
Задача
А: Определить массу йода, которая потребуется для получения иодида калия количеством 3 моль.
Б: Определить массу гидроксида алюминия, который потребуется для получения 5 моль нитрата алюминия.
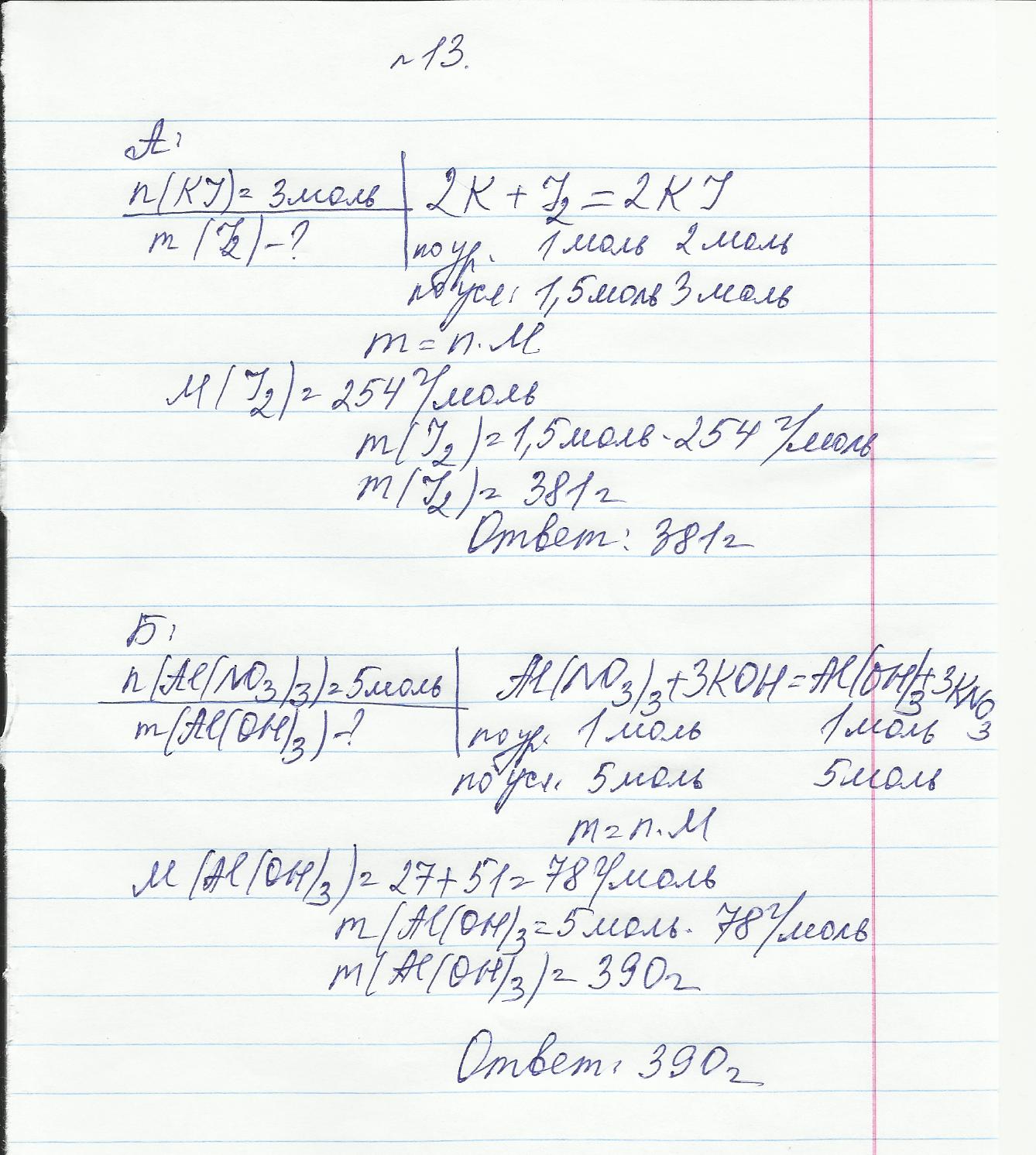
Билет № 14
Задача
А: Какой объём кислорода потребуется для сжигания 5 моль водорода?
Б: Какой объём кислорода потребуется для сжигания 4 моль аммиака?

Билет № 15
Опыт. В трёх пронумерованных пробирках выданы растворы солей: хлорид натрия, карбонат натрия, сульфат натрия. Определить с помощью характерной реакции, в какой пробирке находится карбонат натрия.
Качественной реакцией на карбонаты служит взаимодействие с кислотами, сопровождающееся бурным выделением углекислого газа:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
или, в ионном виде:
CO32- + 2H+ = H2O + CO2↑
Доказать, что выделяется именно оксид углерода (II), можно, пропуская его через раствор известковой воды, что вызывает её помутнение:
CO2 + Ca(OH)2 = CaCO3↓ + H2O
Чтобы распознать соль угольной кислоты, добавляем во все три пробирки немного кислоты (чтобы не вылилась через край при «вскипании»). Где будет выделяться бесцветный газ без запаха, там находится карбонат.
