
- •Квантовая 3 Лекция 9 Ядерная модель атома
- •Постулаты Нильса Бора
- •Расчёт атома водорода по н.Бору
- •Квантовая теория атома
- •Лекция 10 Волновые функции и квантовые числа
- •Символы состояний
- •Орбитальный магнитный момент
- •Энергетический спектр электрона в атоме водорода
- •Ширина спектральных линий
- •Лекция 11 Спин электрона
- •Атом во внешнем магнитном поле
- •Эффект Зеемана
- •Свойства вынужденного излучения
- •Среды с инверсной заселённостью энергетических уровней
- •Квантовые генераторы
- •Вопросы к рубежному контролю
Символы состояний
Различные состояния электрона в атоме принято обозначать малыми буквами латинского алфавита в зависимости от значения орбитального квантового числа l
-
Квантовое число l
0
1
2
3
4
5
Символ состояния
s
p
d
f
g
h
Значение главного квантового числа п указывают перед символом состояния с данным числом l . Например, электрон, имеющий п = 3 и l =2 обозначают символом 3d. Последовательность имеет следующий вид:
1s (для п =1) 2s, 2p (для п = 2) 3s, 3p, 3d (для п = 3) и т.д.
10 - 3
Примеры некоторых нормированных волновых функций Ψnlm для ряда квантовых состояний водородоподобных атомов
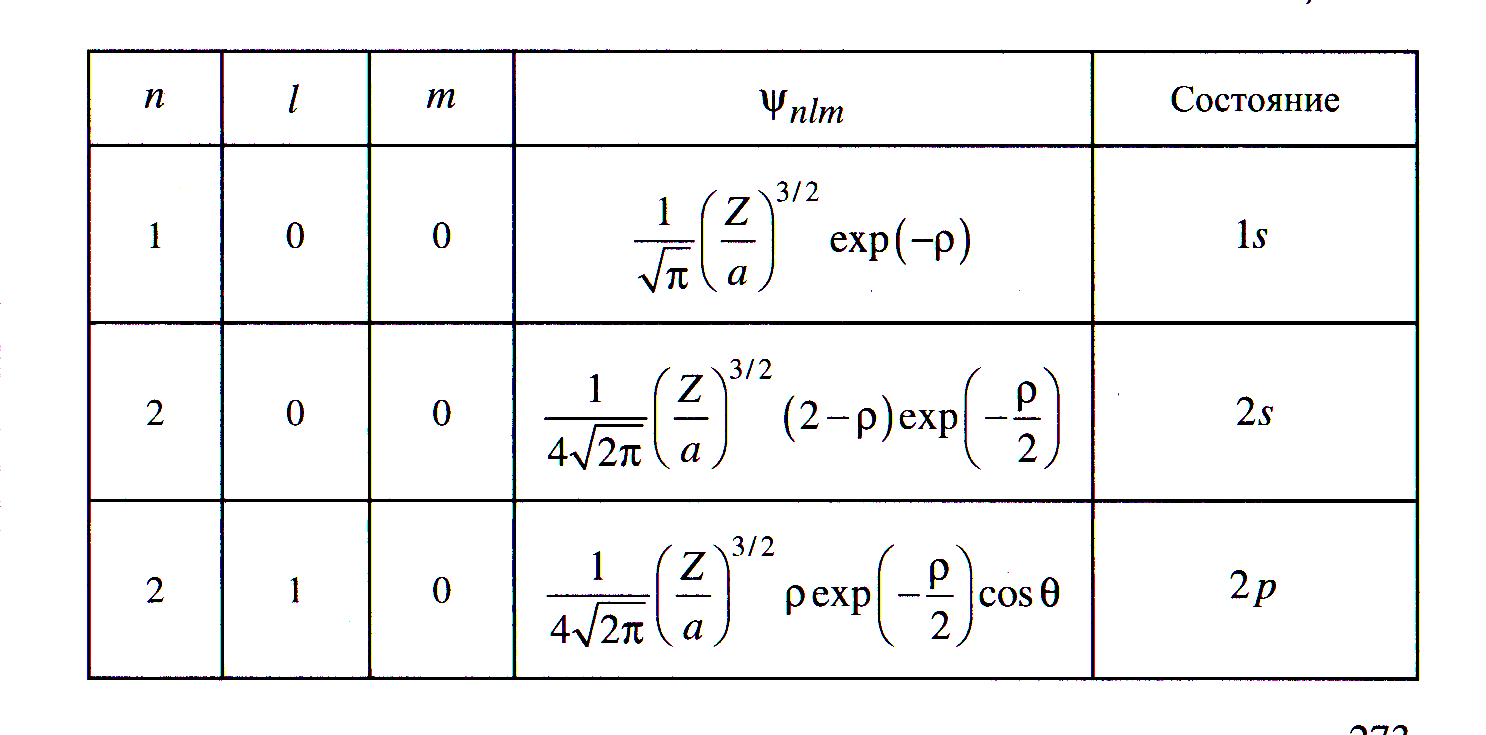
Здесь
![]() . Z – заряд ядра , r
– расстояние
от центра атома ,
. Z – заряд ядра , r
– расстояние
от центра атома ,
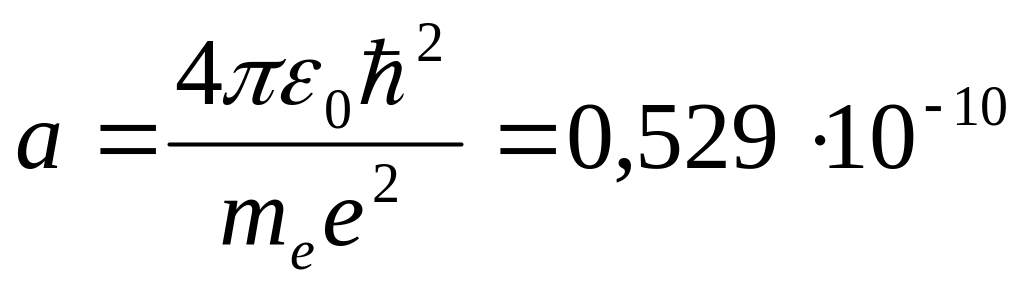 м
-
универсальная константа, равная 1-ому
м
-
универсальная константа, равная 1-ому
боровскому радиусу электрона в атоме
водорода.
Образ атома в квантовой теории может быть представлен в виде облака плотности вероятности
w =
![]()
П ространственное
распределение плотности вероятности
обнаружения электрона в различных
квантовых состояниях атома водорода
можно представить следующим образом
ространственное
распределение плотности вероятности
обнаружения электрона в различных
квантовых состояниях атома водорода
можно представить следующим образом
10 - 4
Орбитальный магнитный момент
Так как движущийся в классической теории Бора вокруг ядра электрон является заряженной частицей, то такое его движение обусловливает протекание некоторого замкнутого тока в атоме, который можно охарактеризовать орбитальным магнитным моментом рм .
Для расчёта
орбитального магнитного момента в
квантовой
теории
следует определять пространственную
плотность электрического тока
![]() через плотность
потока вероятности
через плотность
потока вероятности
![]()
![]() , где
, где
![]() .
.
Связь механического и магнитного моментов определяется гиромагнитным отношением
![]() .
.
Точный квантово-механический расчёт даёт ( причём это же выражение получается и из теории Бора )
![]() .
.
Тогда
![]() . где
. где
![]() 0,927.10-23
Дж/Тл
-
магнетон
Бора –
универсальная
постоянная, служащая единицей измерения
магнитных моментов атомов.
0,927.10-23
Дж/Тл
-
магнетон
Бора –
универсальная
постоянная, служащая единицей измерения
магнитных моментов атомов.
Возмржные значения проекции магнитного момента атома на выделенное направление Z
рмz = m.μБ .
10 – 5
Энергетический спектр электрона в атоме водорода

1 – переход в возбуждённое состояние
2 – ионизация атома Wi=-E1 = 13,6 эВ
Ширина спектральных линий
Линии в спектре излучения атомов не являются бесконечно узкими – это соответствовало бы значению неопределённости ∆Е = 0, т.е. точно определённой энергии кванта излучения.
 Спектральные
линии, наблюдае-
Спектральные
линии, наблюдае-
мые в эксперименте, имеют конечную, так называемую естественную ширину линии Г , которая представляет собой разброс энергий фотонов относительно некоторого среднего значения, характе-
ризующего центр линии.
Эта ширина связана с временем жизни атома в возбуждённом состоянии соотношением
![]()
Экспериментальное
определение ширины Г
позволило оценить время
![]() с .
с .
