
- •Введение
- •§ 1.1. Основные положения молекулярно-кинетической
- •§ 1.2. Уравнение состояния идеального газа
- •§ 2.1. Элементарные сведения из теории вероятностей
- •§2.2 Распределение молекул газа по скоростям
- •§2.3. Распределение молекул газа по кинетическим энергиям
- •§2.4. Распределение молекул газа по потенциальным
- •§3.1. Внутренняя энергия
- •§3.2. Работа газа
- •§3.3. Теплота. Первый закон термодинамики
- •§3.4. Теплоемкость
- •§3.5. Адиабатный процесс
- •§ 4.1. Второй закон термодинамики
- •§ 4.2. Энтропия
- •§ 4.3. Статистический смысл второго закона термодинамики
- •§ 4.4. Тепловые машины
- •§ 5.1. Уравнение состояния реального газа
- •§5.2. Внутренняя энергия реального газа
- •§ 5.3. Агрегатные состояния и фазы
- •§ 5.4. Фазовые переходы
- •§ 6.1. Длина свободного пробега молекул
- •§ 6.2. Диффузия
- •§ 6.3. Внутреннее трение
- •§ 6.4. Теплопроводность
- •Содержание
§3.4. Теплоемкость
Для количественного
описания тепловых свойств макроскопических
тел в термодинамике используется понятие
теплоемкости. Теплоемкостью
тела С
называется отношение переданного ему
малого количества теплоты
![]() к изменению температуры тела
к изменению температуры тела
![]() :
:
![]() . (3.14)
. (3.14)
В системе СИ теплоемкость измеряется в джоулях, деленных на кельвин (Дж/К).
Помимо теплоемкости
используют также понятия удельной
теплоемкости
![]() и молярной
теплоемкости
с.
По определению
и молярной
теплоемкости
с.
По определению
![]() , (3.15)
, (3.15)
![]() , (3.16)
, (3.16)
где m – масса тела, - количество вещества. Удельная теплоемкость измеряется в джоулях, деленных на килограмм и на кельвин (Дж/(кгК)), молярная – в джоулях, деленных на моль и на кельвин (Дж/(мольК)). Из формул (3.14) – (3.16) следует, что
![]() и
и
![]() , (3.17)
, (3.17)
где М – молярная масса.
Теплоемкость зависит от вида процесса, происходящего в макроскопической системе. Найдем молярную теплоемкость идеального газа в изохорном сV и изобарном cp процессах.
Изохорный процесс
Воспользуемся определением молярной теплоемкости (3.16) и формулой (3.13). Имеем:
![]() ,
,
![]() . (3.18)
. (3.18)
Выражение (3.18) позволяет записать внутреннюю энергию идеального газа в виде
![]() . (3.19)
. (3.19)
Изобарный процесс
Используем формулу (3.13):
![]() ,
,
![]() . (3.20)
. (3.20)
Таким образом, сV и ср не зависят ни от состояния газа, ни от его молярной массы, а определяются только числом степеней свободы молекул. Кроме того, для любого идеального газа
![]() . (3.21)
. (3.21)
Равенство (3.21) носит название уравнения (или теоремы) Майера.
Задача 3.3. Определите удельную теплоемкость смеси водорода и гелия суд при постоянном объеме, если количества вещества обоих газов в смеси одинаковы и равны .
Решение
Согласно (3.17)
удельная теплоемкость смеси
![]() ,
где масса смеси
,
где масса смеси
![]() (молярная масса водорода
(молярная масса водорода
![]() кг/моль, гелия
кг/моль, гелия
![]() кг/моль).
кг/моль).
Из определения теплоемкости (3.14) следует, что она является аддитивной величиной. Иными словами, теплоемкость смеси газов равна сумме теплоемкостей этих газов, взятых по отдельности. Имеем:
![]()
где число степеней
свободы водорода
![]() ,
гелия
,
гелия
![]() .
.
Окончательно находим:

![]() .
.
§3.5. Адиабатный процесс
Адиабатным
(или адиабатическим)
называется процесс, происходящий без
теплообмена с окружающей средой (![]() ).
На практике адиабатный процесс можно
осуществить при достаточно быстром
расширении или сжатии газа, т.е. когда
процесс протекает настолько быстро,
что теплообмен между газом и окружающей
средой не успевает произойти.
).
На практике адиабатный процесс можно
осуществить при достаточно быстром
расширении или сжатии газа, т.е. когда
процесс протекает настолько быстро,
что теплообмен между газом и окружающей
средой не успевает произойти.
Получим уравнение
состояния идеального газа, описывающее
адиабатный процесс. Из первого закона
термодинамики (3.10) следует, что в
адиабатном процессе выполняется условие
![]() .
Используя формулы (3.4) и (3.19) это условие
для идеального газа можно переписать
в виде
.
Используя формулы (3.4) и (3.19) это условие
для идеального газа можно переписать
в виде
![]() .
.
Из уравнения Менделеева-Клапейрона находим:
![]() ;
;
![]() ;
;
![]() . (3.22)
. (3.22)
Учтем, что
![]() ,
и введем безразмерную величину
,
и введем безразмерную величину
![]() ,
называемую показателем
адиабаты.
Отметим, что показатель адиабаты
идеального газа определяется только
числом степеней свободы его молекул.
Действительно, согласно (3.18) и (3.20),
,
называемую показателем
адиабаты.
Отметим, что показатель адиабаты
идеального газа определяется только
числом степеней свободы его молекул.
Действительно, согласно (3.18) и (3.20),
![]() . (3.23)
. (3.23)
Преобразуем и проинтегрируем уравнение (3.22):
![]() ;
;
![]() ;
;
![]() ;
;
![]() . (3.24)
. (3.24)
Уравнение (3.24) и есть искомое уравнение состояния идеального газа в адиабатном процессе или уравнение Пуассона. Воспользовавшись уравнением Менделеева-Клапейрона, уравнение Пуассона легко записать в других переменных:
![]() и
и
![]() . (3.25)
. (3.25)
Получите выражения (3.25) самостоятельно.
График адиабатного
процесса или адиабата
в координатах (p,V)
идет круче изотермы, уравнение которой
имеет вид
![]() (см. рис. 3.4). Это объясняется тем, что
показатель адиабаты
(см. рис. 3.4). Это объясняется тем, что
показатель адиабаты
![]() .
.
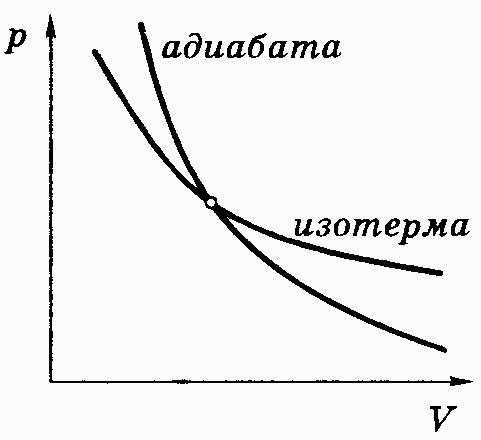
Рис. 3.4
Задача
3.4. При
адиабатном расширении кислорода с
начальной температурой
![]() К его внутренняя энергия уменьшилась
на
К его внутренняя энергия уменьшилась
на
![]() кДж, а объем увеличился в
кДж, а объем увеличился в
![]() раз. Определите массу кислорода m.
раз. Определите массу кислорода m.
Решение
Молекула кислорода
О2
состоит из двух атомов, следовательно,
число степеней свободы кислорода
.
По формуле (3.23) определим показатель
адиабаты кислорода:
![]() .
Конечную температуру кислорода
.
Конечную температуру кислорода
![]() найдем из второго уравнения (3.25):
найдем из второго уравнения (3.25):
 .
.
Согласно (3.3) изменение внутренней энергии газа равно
![]() ,
,
где
![]() кг/моль – молярная масса кислорода.
кг/моль – молярная масса кислорода.
Находим массу газа:
![]() г.
г.
Изотермический, изобарный, изохорный и адиабатный процессы являются представителями более широкого класса политропных процессов. Политропными (или политропическими) называются процессы, уравнения которых в координатах (р,V) имеют вид
![]() , (3.26)
, (3.26)
где n
– произвольное число, называемое
показателем
политропы.
Показатель политропы может быть как
положительным, так и отрицательным. В
ходе любого политропного процесса
теплоемкость газа остается постоянной,
т.е.
![]() .
Показатель политропы n
может быть выражен через cV,
cp
и сn:
.
Показатель политропы n
может быть выражен через cV,
cp
и сn:
![]() . (3.27)
. (3.27)
Из формулы (3.27)
следует, что показатель политропы для
изотермического процесса (![]() )
равен n
= 1, для адиабатного (
)
равен n
= 1, для адиабатного (![]() )
)
![]() ,
для изохорного (
,
для изохорного (![]() )
)
![]() ,
для изобарного (
,
для изобарного (![]() )
)
![]() .
.
Задача
3.5. В ходе
некоторого политропного процесса объем
кислорода был увеличен в
![]() раза, давление при этом уменьшилось в
раза, давление при этом уменьшилось в
![]() раз. Определите молярную теплоемкость
кислорода в этом процессе.
раз. Определите молярную теплоемкость
кислорода в этом процессе.
Решение
Из уравнения
политропы следует (3.26) следует, что
давление и объем газа в начальном
состоянии 1 и конечном состоянии 2 связаны
между собой соотношением
![]() ,
отсюда
,
отсюда
 .
.
Молярную теплоемкость газа в политропном процессе выразим из формулы (3.27):
![]() .
.
Учтем, что молекула кислорода О2 – двухатомная, и ее число степеней свободы . Имеем:
,
![]() ;
;
![]() (Дж/К).
(Дж/К).
Лекция 4. Второй закон термодинамики. Энтропия
