
- •Введение
- •§ 1.1. Основные положения молекулярно-кинетической
- •§ 1.2. Уравнение состояния идеального газа
- •§ 2.1. Элементарные сведения из теории вероятностей
- •§2.2 Распределение молекул газа по скоростям
- •§2.3. Распределение молекул газа по кинетическим энергиям
- •§2.4. Распределение молекул газа по потенциальным
- •§3.1. Внутренняя энергия
- •§3.2. Работа газа
- •§3.3. Теплота. Первый закон термодинамики
- •§3.4. Теплоемкость
- •§3.5. Адиабатный процесс
- •§ 4.1. Второй закон термодинамики
- •§ 4.2. Энтропия
- •§ 4.3. Статистический смысл второго закона термодинамики
- •§ 4.4. Тепловые машины
- •§ 5.1. Уравнение состояния реального газа
- •§5.2. Внутренняя энергия реального газа
- •§ 5.3. Агрегатные состояния и фазы
- •§ 5.4. Фазовые переходы
- •§ 6.1. Длина свободного пробега молекул
- •§ 6.2. Диффузия
- •§ 6.3. Внутреннее трение
- •§ 6.4. Теплопроводность
- •Содержание
§5.2. Внутренняя энергия реального газа
Внутренняя энергия
реального газа складывается из
кинетической энергии теплового движения
молекул
![]() и потенциальной энергии межмолекулярного
взаимодействия
и потенциальной энергии межмолекулярного
взаимодействия
![]() .
.
Кинетическая
энергия теплового движения молекул
представляет собой внутреннюю энергию
идеального газа (3.19) и для одного моля
газа равна
![]() .
.
Определим энергию
взаимодействия молекул
![]() .
Поскольку потенциальная энергия
взаимодействия
обусловлена действием сил межмолекулярного
притяжения, работа этих сил должна быть
равна убыли энергии взаимодействия:
.
Поскольку потенциальная энергия
взаимодействия
обусловлена действием сил межмолекулярного
притяжения, работа этих сил должна быть
равна убыли энергии взаимодействия:
![]() .
Действие сил притяжения характеризуется
внутренним давлением
.
Действие сил притяжения характеризуется
внутренним давлением
![]() .
Элементарную работу этих сил при малом
расширении газа можно найти как
.
Элементарную работу этих сил при малом
расширении газа можно найти как
![]() (знак минус обусловлен тем, что силы
межмолекулярного притяжения препятствуют
расширению газа). Имеем:
(знак минус обусловлен тем, что силы
межмолекулярного притяжения препятствуют
расширению газа). Имеем:
![]() ,
,
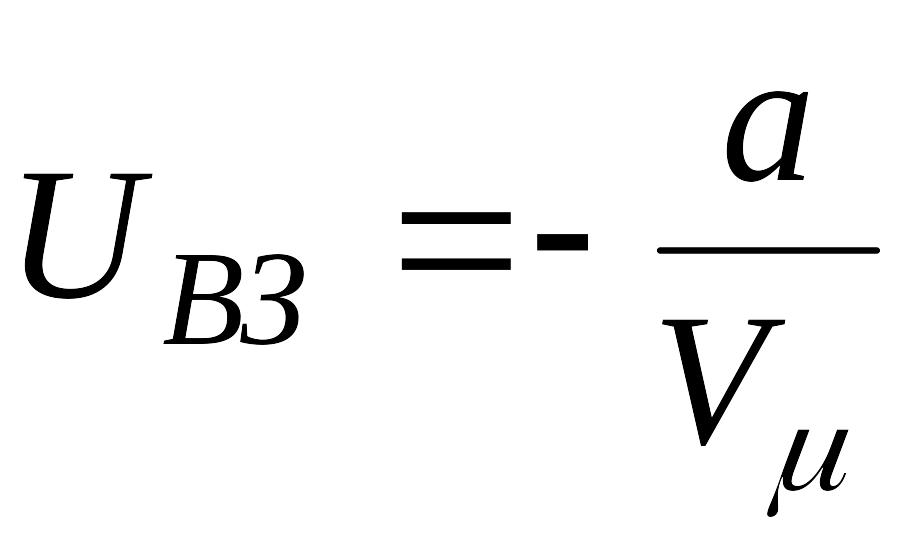 . (5.2)
. (5.2)
Таким образом, внутренняя энергия одного моля реального газа равна
![]() . (5.3)
. (5.3)
В середине XIX века английские физики Джоуль и Томсон экспериментально обнаружили, что при адиабатическом (т.е. достаточно быстром) расширении газа в пустоту его температура понижается. Данный процесс получил название адиабатического дросселирования, а явление понижения температуры – эффекта Джоуля-Томсона.
Очевидно, что
эффект Джоуля-Томсона невозможно
объяснить в рамках модели идеального
газа. Действительно, процесс адиабатный
(![]() ),
и расширение газа происходит в пустоту,
а значит – без совершения работы против
внешних сил (
),
и расширение газа происходит в пустоту,
а значит – без совершения работы против
внешних сил (![]() ).
Согласно первому закону термодинамики
изменение внутренней энергии газа
).
Согласно первому закону термодинамики
изменение внутренней энергии газа
![]() .
Для идеального газа
.
Для идеального газа
![]() ,
следовательно,
,
следовательно,
![]() и
и
![]() .
«Ответственность» за понижение
температуры газа при адиабатическом
дросселировании несет энергия
межмолекулярного взаимодействия (5.2).
.
«Ответственность» за понижение
температуры газа при адиабатическом
дросселировании несет энергия
межмолекулярного взаимодействия (5.2).
Задача
5.2. Найти
изменение температуры
![]()
![]() моль азота при расширении в пустоту от
объема
моль азота при расширении в пустоту от
объема
![]() л до объема
л до объема
![]() л.
л.
Решение
Изменение внутренней энергии моль реального газа при помощи формулы (5.3) можно найти как
 ,
,
где молярная
теплоемкость при постоянном объеме
молекулярно азота
![]() ;
постоянная
;
постоянная
![]() Пам6/моль2
(см. таблицу 5.1). Как было показано выше,
при адиабатическом дросселировании
Пам6/моль2
(см. таблицу 5.1). Как было показано выше,
при адиабатическом дросселировании
![]() ,
отсюда
,
отсюда
![]() ,
,
![]() К.
К.
§ 5.3. Агрегатные состояния и фазы
Одно и то же вещество может в зависимости от температуры и давления находиться в различных агрегатных состояниях: газообразном, жидком и кристаллическом. Например, при нормальном атмосферном давлении и температуре ниже 0 0С вода находится в кристаллическом состоянии (лед), при температуре от 0 до 100 0С – в жидком состоянии и при температурах свыше 100 0С – в газообразном состоянии (водяной пар).
Агрегатное состояние вещества определяется соотношением между кинетической энергией теплового движения молекул и энергией межмолекулярного взаимодействия. Средняя энергия взаимодействия молекул газа много меньше их средней кинетической энергии, поэтому они движутся практически свободно, в результате чего газ занимает весь предоставленный ему объем.
Среднее расстояние между молекулами жидкости много меньше, чем в газе. Молекулы жидкости расположены практически вплотную друг к другу, вследствие чего их энергия взаимодействия сравнима с кинетической энергией. Поэтому молекулы жидкости обладают большой подвижностью и расположены неупорядоченно, но при этом жидкость занимает определенный практически неизменный объем. Согласно общепризнанной модели поведения молекул жидкости, предложенной Я. Френкелем1, каждая молекула в течение некоторого времени колеблется около определенного положения равновесия. Затем молекула скачком перемещается в новое равновесное положение. В результате молекула может медленно перемещаться по всему объему жидкости, чем и объясняется характерное для жидкостей свойство текучести.
В кристаллах энергия взаимодействия частиц (молекул, атомов или ионов) превышает их кинетическую энергию теплового движения, поэтому расположение частиц является строго упорядоченным. Каждая частица совершает совершает колебания около строго определенного положения – узла кристаллической решетки. Упорядоченность строения кристаллов приводит к возникновению анизотропии – многие свойства кристаллов (механические, тепловые, электрические, оптические и др.) зависят от направления.
В зависимости от природы частиц, расположенных в узлах кристаллической решетки, различают четыре типа кристаллов.
Ионные кристаллы: в узлах решетки расположены ионы противоположных знаков. Например, кристалл поваренной соли NaCl имеет кубическую решетку, в которой чередуются ионы Na+ и Cl.
Атомные кристаллы: в узлах решетки расположены нейтральные атомы. Примеры: графит, алмаз.
Металлические кристаллы: в узлах решетки находятся положительные ионы, пространство между ионами заполнено «газом», состоящим из свободных в пределах кристалла электронов проводимости. Электронный газ компенсирует отталкивание между ионами, удерживая их вместе. В свою очередь притяжение к ионам решетки не дает электронам проводимости покинуть кристалл. Примеры: Fe, Cu и т.д.
Молекулярные кристаллы: в узлах решетки расположены молекулы. Пример: вода в форме льда.
Помимо газообразного, жидкого и кристаллического состояний вещества, существует четвертое состояние – плазма. Плазмой называется ионизированный квазинейтральный газ. Квазинейтральность означает, что алгебраическая сумма зарядов в любом макроскопическом объеме плазмы близка к нулю. Отношение числа ионизированных атомов в данном объеме к их полному числу называется степенью ионизации. Газ считается плазмой при степенях ионизации 0,001 и выше. Благодаря наличию большого числа заряженных частиц свойства плазмы кардинально отличаются от свойств обычного неионизированного газа, чем и обусловлено выделение плазмы в отдельное агрегатное состояние вещества. В повседневной жизни мы сталкиваемся с плазмой, когда пользуемся газоразрядными лампами (например, люминесцентными лампами дневного света).
Для описания различий между частями сложных неоднородных систем в термодинамике используют понятие фазы. Фазой называется совокупность всех частей системы, обладающих одинаковым химическим составом и находящихся в одном состоянии. Например, если в сосуде находятся жидкая вода и водяной пар, система будет двухфазной, если в воде при этом плавают куски льда, то трехфазной.
Следует помнить, что понятие фазы в термодинамике является более узким, чем понятие агрегатного состояния вещества. Так, разными фазами будут графит и алмаз, которые представляют собой кристаллический углерод с разными типами кристаллической решетки; разными фазами будут обычный жидкий гелий и сверхтекучий гелий, один и тот же металл в проводящем и сверхпроводящем состояниях, ферромагнетик и парамагнетик и т.д.
