
- •Введение
- •§ 1.1. Основные положения молекулярно-кинетической
- •§ 1.2. Уравнение состояния идеального газа
- •§ 2.1. Элементарные сведения из теории вероятностей
- •§2.2 Распределение молекул газа по скоростям
- •§2.3. Распределение молекул газа по кинетическим энергиям
- •§2.4. Распределение молекул газа по потенциальным
- •§3.1. Внутренняя энергия
- •§3.2. Работа газа
- •§3.3. Теплота. Первый закон термодинамики
- •§3.4. Теплоемкость
- •§3.5. Адиабатный процесс
- •§ 4.1. Второй закон термодинамики
- •§ 4.2. Энтропия
- •§ 4.3. Статистический смысл второго закона термодинамики
- •§ 4.4. Тепловые машины
- •§ 5.1. Уравнение состояния реального газа
- •§5.2. Внутренняя энергия реального газа
- •§ 5.3. Агрегатные состояния и фазы
- •§ 5.4. Фазовые переходы
- •§ 6.1. Длина свободного пробега молекул
- •§ 6.2. Диффузия
- •§ 6.3. Внутреннее трение
- •§ 6.4. Теплопроводность
- •Содержание
АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
кафедра физики
МОЛЕКУЛЯРНАЯ ФИЗИКА,
ТЕРМОДИНАМИКА
ЛЕКЦИИ
С ПРИМЕРАМИ РЕШЕНИЯ ЗАДАЧ




Астрахань – 2009
Учебное пособие включает развернутый конспект 6 лекций по молекулярной физике и термодинамике. Содержит систематическое изложение теории и большое число примеров решения задач. Предназначено для студентов первого курса инженерно-технических специальностей высших учебных заведений всех форм обучения. – Астрахань, 2009. – 72 с.
Автор:
к.ф.-м.н., доц. Карибьянц В.Р.
Рецензент:
к.п.н., доц. каф. физики АГТУ
Мирзабекова О.В.
Утверждено на заседании кафедры физики АГТУ:
Протокол № от 2009 г.
Введение
Первый семестр изучения физики в техническом университете является наиболее трудным. В течение этого семестра излагается больше новых идей, представлений и методов, чем в последующих семестрах. Студент, четко усвоивший основы физики, излагаемые в первом семестре, даже если он еще не в состоянии свободно применять их в сложных случаях, может считать, что оставил позади большинство трудностей, возникающих при изучении этого предмета. Облегчить студенту решение этой задачи и призвано данное учебное пособие, представляющее собой развернутый конспект лекционного курса, читаемого автором в течении ряда лет студентам различных специальностей Института информационных технологий и коммуникаций АГТУ.
Учебное пособие включает 6 лекций, охватывающих основные темы разделов «Молекулярная физика» и «Термодинамика» в соответствии с действующей программой по физике для студентов технических специальностей. Относительно небольшой объем пособия достигнут за счет тщательного отбора и лаконичности изложения материала. Помимо систематического изложения теории пособие включает свыше 20 примеров решения задач различного уровня сложности, что позволит студентам не только отвлеченно заучить основные физические определения, законы и формулы, но и научиться эффективно их применять в конкретных обстоятельствах.
В процессе работы над настоящим курсом лекций автор использовал следующие классические учебники и пособия, которые рекомендуются студентам в качестве учебной литературы:
Детлаф А.А., Яворский Б.М., Милковская Л.Б. Курс физики. Механика. Основы молекулярной физики и термодинамики. М.: Высшая школа, 1973, 384 с.
Трофимова Т.И. Курс физики. М.: Высшая школа, 1998, 542 с.
Сивухин Д.В. Общий курс физики. Том 2. Термодинамика и молекулярная физика. М.: Физматлит, МФТИ, 2003, 576 с.
Иродов И.Е. Физика макросистем. Основные законы. М.: Лаборатория базовых знаний, 2004, 2007 с.
Иродов И.Е. Задачи по общей физике. М.: Лаборатория базовых знаний, 2003, 423 с.
Чертов А.Г., Воробьев А.А. Задачник по физике. М.: Высшая школа, 1988, 527 с.
Лекция 1. Основные положения молекулярно-кинетической
теории. Уравнение состояния идеального газа
§ 1.1. Основные положения молекулярно-кинетической
теории
До сих пор мы не интересовались микроскопическим строением тел. Твердые тела, жидкости и газы мы считали сплошными. «Частицы», на которые мы их разбивали, обладали теми же свойствами, что и тела в целом, только имели меньшие размеры. Такой подход вполне оправдан в механике, где размеры «частиц» остаются макроскопическими, т.е. на несколько порядков превышающими размеры атомов и молекул. Однако, в механике многие свойства тел просто констатировались. Например, говорилось, что различные твердые тела обладают различными упругими свойствами, или что вязкость одних жидкостей больше, чем других и сильно зависит от температуры. Почему так? Дать ответ на этот и подобный вопросы в рамках механики невозможно. Дело в том, что для объяснения физических свойств макроскопических тел (или макросистем) необходимо исследовать их микроскопическую структуру. Раздел физики, посвященный изучению микроскопической структуры вещества, называется молекулярной физикой.
Основу современной молекулярной физики составляет молекулярно-кинетическая теория (МКТ), построенная на следующих трех основных положениях:
1. Все тела состоят из микроскопических частиц – молекул, атомов или ионов1.
2. Молекулы находятся в состоянии непрерывного хаотического движения, называемого тепловым движением.
3. Молекулы взаимодействуют между собой: при непосредственном контакте отталкиваются, на бóльших расстояниях притягиваются.
Основные положения МКТ являются обобщениями огромного количества экспериментальных фактов. В настоящее время при помощи электронного микроскопа можно получить изображения самых больших молекул (например, молекул белков), а атомно-силовые микроскопы позволяют работать с единичными атомами. Исторически же обоснованием факта существования и непрерывного хаотического движения молекул послужили явления диффузии и броуновского движения.
Диффузией называется процесс самопроизвольного взаимопроникновения двух соприкасающихся веществ (газов, жидкостей или твердых тел). Представьте себе, что мы прольем в одном углу аудитории какую-либо пахучую жидкость, например, бензин. Через некоторое время запах бензина распространится по всему помещению. Отсюда вывод: воздух и бензин не сплошные, а состоят из невидимых глазу микроскопических частиц, разделенных промежутками. Частицы (молекулы) бензина благодаря своему хаотическому движению проходят между молекулами воздуха и распространяются по всему объему аудитории. Элементарная теория диффузии газов будет рассмотрена в лекции 6.
Броуновским движением принято называть хаотическое движение малых (но макроскопических) частиц в жидкости или газе. Это явление было открыто в 1827 г. Р. Броуном1, который, рассматривая под микроскопом споры растений, взвешенные в капле воды, обнаружил их хаотическое движение. Характерная траектория движения броуновской частицы изображена на рисунке 1.1 (показаны последовательные положения частицы, зафиксированные с интервалом в 30 с).
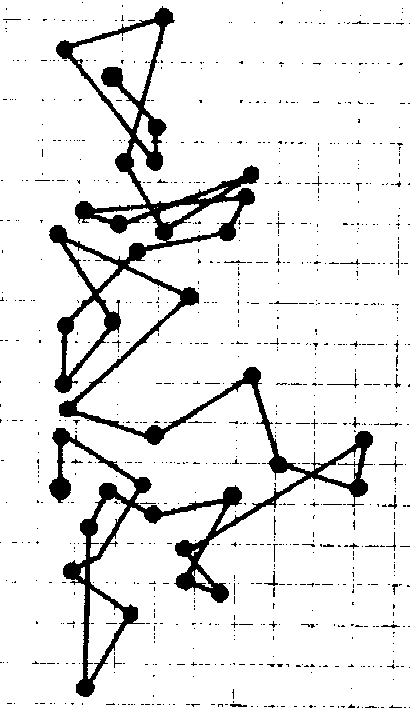
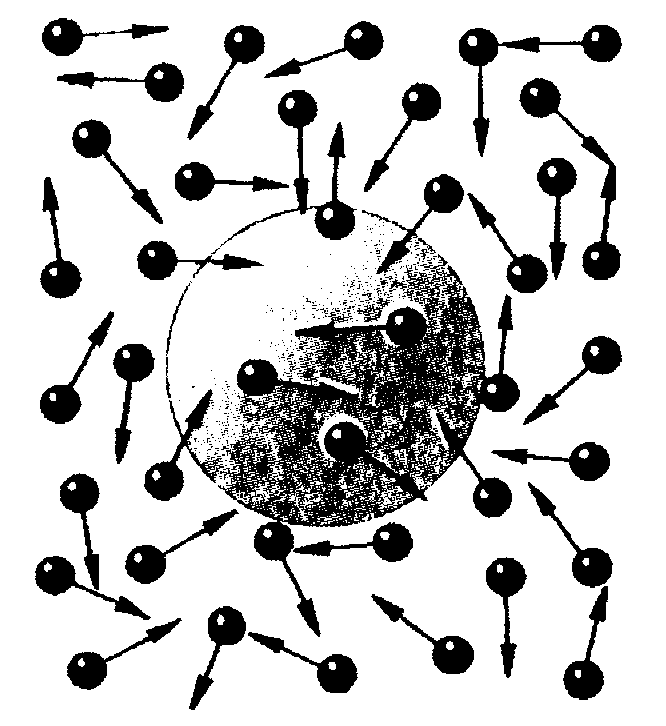
Рис. 1.1 Рис. 1.2
Объяснение броуновского движения возможно только в рамках молекулярно-кинетической теории: молекулы жидкости или газа сталкиваются с твердой частицей и изменяют направление и модуль скорости ее движения (см. рис. 1.2). Число молекул, ударяющих частицу с различных сторон, и направление передаваемого ими импульса постоянно изменяются. Чем меньше размеры и масса частицы, тем заметнее становится изменение ее скорости во времени. Таким образом, броуновское движение подтверждает и первое и второе положения МКТ. Современная статистическая теория броуновского движения была разработана в 1905 г. А. Эйнштейном.
Факт существования сил межмолекулярного притяжения и отталкивания однозначно следует из существования упругих сил (см. § 5.1).
Размеры и масса молекул очень малы. В любом макроскопическом объеме содержится огромное их число. Например, в одном кубическом сантиметре воздуха в помещении, где Вы сейчас находитесь, содержится около 2,41019 молекул. Число молекул в макроскопических телах характеризуется величиной, называемой количеством вещества . Единицей измерения количества вещества является моль. Один моль любого вещества содержит 6,021023 молекул (это число называется числом Авогадро1 NA). Таким образом, число молекул N можно найти как
![]() . (1.1)
. (1.1)
Масса одного моля вещества называется молярной массой М. Молярная масса связана с массой тела m и количеством содержащегося в нем вещества соотношением
![]() (1.2)
(1.2)
Единицей измерения молярной массы в СИ является килограмм на моль (кг/моль).
Используя формулы (1.1) и (1.2), можно получить выражение для массы m0 одной молекулы вещества:
![]() . (1.3)
. (1.3)
Задача
1.1. Определите
массу m0
одной молекулы воды и число N
молекул в капле воды сферической формы
радиуса r
= 1 мм. Молярная масса воды
![]() кг/моль; плотность воды
кг/моль; плотность воды
![]() кг/м3.
кг/м3.
Решение
Масса одной молекулы воды
![]() (кг).
(кг).
Объем капли
![]() ;
масса капли
;
масса капли
![]() .
Число молекул в капле
.
Число молекул в капле
![]()
Благодаря тепловому
движению каждая молекула обладает
определенной кинетической энергией.
Однако, информация о величине кинетической
энергии отдельно взятой молекулы из
общего числа 1023
или 1025
вряд ли может представлять интерес.
Гораздо удобнее работать со значением
кинетической энергии, усредненной по
всем молекулам, образующим данное тело.
Макроскопической1
величиной, характеризующей среднюю
кинетическую энергию теплового движения
молекул, является температура
(или
абсолютная
температура)
Т.
В СИ температура измеряется в кельвинах2
(К). Абсолютная температура Т связана с
температурой t,
измеренной в градусах Цельсия3,
соотношением
![]() .
.
Л. Больцман4 доказал, что среднюю кинетическую энергию Е0 поступательного движения молекулы тела, имеющего температуру T, можно найти как
![]() , (1.4)
, (1.4)
где m0
– масса молекулы, vкв
– среднеквадратичная скорость молекул
тела,
![]() Дж/К – постоянная
Больцмана.
Из формулы (1.4) получим следующее выражение
для среднеквадратичной скорости молекул:
Дж/К – постоянная
Больцмана.
Из формулы (1.4) получим следующее выражение
для среднеквадратичной скорости молекул:
![]() , (1.5)
, (1.5)
где
![]() Дж/(мольК)
– универсальная
газовая постоянная.
Расчеты по формуле (1.5) показывают, что
скорости теплового движения молекул
весьма велики. Например, среднеквадратичная
скорость молекул кислорода при нормальных
условиях (температура 273 К и давление
101 кПа) равна приблизительно 460 м/с.
Дж/(мольК)
– универсальная
газовая постоянная.
Расчеты по формуле (1.5) показывают, что
скорости теплового движения молекул
весьма велики. Например, среднеквадратичная
скорость молекул кислорода при нормальных
условиях (температура 273 К и давление
101 кПа) равна приблизительно 460 м/с.
