
- •Предисловие
- •Часть 1. Системы организации движения
- •1.1. Морфологическое описание сод
- •1.2. Функциональное описание сод
- •1.3. Моделирование сод
- •1.4. Техническая реализация сод
- •1.5. Генетико-прогностическое описание сод
- •Часть 2. Сенсорные системы
- •2.1. Морфологическое описание сс
- •2.2. Функциональное описание сс
- •2.3. Моделирование сс
- •2.4. Техническая реализация сс
- •2.5. Генетико-прогностическое описание сс
- •Часть 3. Нейронные сети
- •1.1.2. О методах построения функций принадлежности нечетких множеств.
- •3.1. Морфологическое описание нс
- •3.2. Функциональное описание нс
- •3.3. Моделирование нс
- •3.4. Техническая реализация нс
- •3.5. Генетико-прогностическое описание нс
- •Часть 4. Системы человек-машина
- •Послесловие
Часть 2. Сенсорные системы
2.1. Морфологическое описание сс
Три с половиной миллиарда лет назад первые предшественники прокариот возникли в уже тогда древнем океане. Еще до того в первичном бульоне появились примитивные самовоспроизводящиеся молекулы. Вероятно, наиболее ранним репликатором была РНК, а не ДНК, поскольку некоторые формы РНК (рибозимы) обладают ферментативной активностью, а репликация в этом случае протекает быстрее. Хотя репликация ДНК более эффективна, она всегда зависима от белковых ферментов, что трудно себе представить в примитивном океане. Следовательно, более сложный процесс репликации ДНК должен был развиться позднее. Однако, эффективная репликация РНК или ДНК, a fortiori (в особенности) – последней, зависит от множественности молекул. Из этого следует, что эти молекулы должны находиться в достаточной близости друг от друга. Возможно, что все началось с их адсорбции на какой-либо обычной поверхности, например на глинах. Однако наиболее эффективным средством удержания взаимодействующих молекул вместе было помещение их в тонкий мешочек или пузырек.
Простейшие современные прокариоты – это микоплазма. Самое малое из них имеет диаметр 0,3 мкм и содержит не более 750 различных типов белков, но даже эти крошечные клетки куда более продвинуты, чем протоклетки, существовавшие три с половиной миллиарда лет назад, поскольку они, как и современные клетки, используют ДНК, а не РНК, как наследственный материал. Так или иначе, рассматриваем ли мы простейшие из живых клеток или их гипотетических предшественников, одно их выделяет – они существуют как отдельности в окружающей среде. Их внешние мембраны отграничивают внутреннюю среду от внешней. Биологи с философскими наклонностями прослеживают происхождение индивидуального организма до этого изначального периода.
Все организмы живут в окружающей среде. Все организмы тем или иным образом реагируют на окружающую среду. Это то, что отличает их от неодушевленных предметов. Ясно, что поверхностная мембрана, отграничивающая организм от окружающей среды, должна играть критически важную роль. Именно здесь развиваются специализации, которые способны детектировать благоприятные и неблагоприятные изменения. Иными словами, именно здесь возникает простейшая сенсорная система. Будучи информирован об изменениях в окружающей среде, организм может реагировать на них благоприятным для себя образом. Благоприятным для чего? В конечном счете, преимущества могут быть прослежены до уровня физической химии реплицирующихся молекул. Те из них, которые реплицируются более эффективно, поглощают больше доступных ресурсов и выживают.
Итак, начнем с начала: рассмотрим элементы, из которых построена сенсорная система.
1.1.1. Аллостерические эффекторы
Ферментативные белки имеют сложную трехмерную структуру. Ковалентно связанная первичная структура, состоящая из одной или более аминокислотной цепочки, свернута в сложную конформацию, т. н. третичную структуру. Эта структура стабилизирована многочисленными «слабыми» взаимодействиями: водородными связями, вандерваальсовыми и гидрофобными силами и т. д. Стоит подчеркнуть, что каждая из этих сил по отдельности слаба. Тогда как энергия единичной ковалентной связи составляет около 100 ккал/моль (двойные и тройные связи, обладают, соответственно, большими энергиями), водородная связь характеризуется энергиями всего в 1–5 ккал/моль, а гидрофобные и очень короткодистантные вандерваальсовы силы – всего около 1 ккал/моль. Хотя, по сравнению с ковалентными связями, все они очень слабы, однако часто они чрезвычайно многочисленны. Большое число таких слабых взаимодействий и поддерживает сложную конформацию белковой молекулы.
В то же время это означает, что такая пространственная структура ферментативного белка чрезвычайно хрупка и легко ранима. Это также означает, что такая структура может легко перестраиваться из одной конформации в другую. Именно эта черта лежит в основе феномена аллостерии. В сущности, это означает, что когда молекула (или лиганд) связывается с одним из сайтов на поверхности белка, это вызывает изменения конформации, которые демаскируют активные сайты в других участках белка. В известном смысле это может рассматриваться как наиболее примитивная сенсорная система – белковая молекула меняет свое поведение в ответ на какой-либо фактор окружающей среды (рис. 1.1).
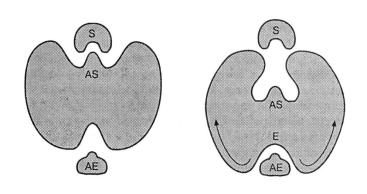
Рис.1.1. Принципиальная схема действия эффектора на активность фермента.
АЕ – аллостерический эффектор, AS – активный сайт, Е – фермент, S – субстрат.
Когда АЕ связывается с ферментом, индуцируются изменения трехмерной конформации последнего (показанные стрелками), так что AS становится недоступным для субстратной молекулы(S).
Аллостерические переходы играют настолько важную роль, что можно сказать, что они лежат в основе всей клеточной биологии. Часто такие аллостерические переходы встречаются у белков, состоящих из более чем одной субъединицы. В таких случаях связывание лиганда с аллостерическим сайтом одной из субъединиц вызывает изменения, которые облегчают связывание лигандов с аллостерическими сайтами других субъединиц. Такое явление известно как кооперативная аллостерия и может приводить к более существеннным изменениями поведения аллостерического белка.
Одним из наиболее эффективных факторов, вызывающих аллостерические переходы, является фосфорилирование. Реакция фосфорилирования катализируется протеинкиназой. Протеинкиназы образуют большое семейство из нескольких сотен белков, каждый из включает каталитический домен из 250 аминокислот. Основная реакция состоит в переносе фосфатной группы с АТФ на гидроксильную группу боковой цепи аминокислот субстратного белка. Только три аминокислоты – серин, треонин и тирозин – обладают гидроксильной группой в боковых цепях, так что только эти аминокислоты и могут участвовать в реакции, которая схематически представлена на рис. 1.2.
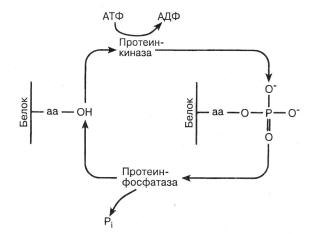
Рис.1.2. Белок с боковой цепью (серин, треонин или тирозин), обозначенной на рисунке «аа». Протеинкиназы фосфорилируют боковую цепь за счет АТФ. Протеинфосфатазы затем дефосфорилируют боковую цепь.
Протеинкиназы, фосфорилирующие субстратные белки (что ведет к аллостерическим переходам в последних) сами находятся под аллостерическим контролем. Нет необходимости углубляться в биохимические тонкости процесса, однако стоит упомянуть о других ферментах – протеинфосфатазах, которые в цитозоле присутствуют, чтобы ликвидировать последствия деятельности киназ (рис. 1.2). Эти ферменты устраняют фосфат с субстратного белка, что позволяет последнему возвратиться к исходной конформации.
1.1.2. Мембраны
Второй элемент любой сенсорной системы – это биомембраны. Хотя наиболее древние мембраны, сформировавшиеся в первобытные времена, могли быть построены из аминокислот, все современные биологические мембраны (или биомембраны) состоят из липидного бислоя с белковыми включениями. Кроме того, большинство биомембран содержит и углеводы. Липиды образуют матрикс или основу, в которую погружены белки, а углеводы (там, где они присутствуют) присоединены либо к липидам (гликолипиды) или к белкам (гликопротеины) (рис. 1.3).
Липиды
На рис. 1.3 видно, что липиды образуют бимолекулярный слой. Они разделяются на три большие группы: фосфолипиды, гликолипиды и стероиды (в частности, холестерин). Важно отметить, что все эти молекулы относятся к амфипатическим, т. е. частично растворимым в воде, а частично – в органических растворителях. Типичный мембранный липид на одном из концов молекулы несет электростатический заряд и, таким образом, может связываться с водорастворимыми веществами, а другой конец, ковалентно не связанный с электростатическим зарядом, чувствует себя, как дома, в органическом растворителе. Поскольку и внеклеточная, и внутриклеточная среда практически исключительно водные, липиды, образующие бислойную мембрану, выстраиваются так, что их гидрофильные «головы» обращены в водную среду, а гидрофобные «хвосты» – друг к другу (изолированно как от водной среды снаружи, так и внутри клетки). Некоторые типичные мембранные липиды показаны на рис. 1.4.
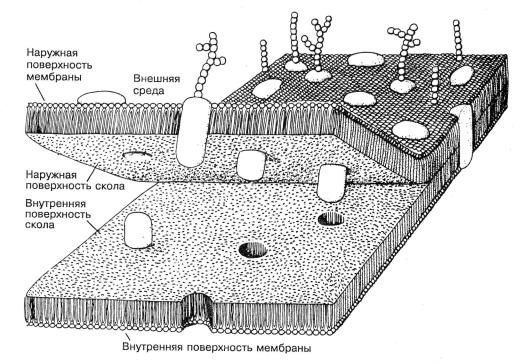
Рис.1.3. Мембрана быстро заморожена до температуры жидкого азота и вскрыта сколом. Плоскость скола проходит через середину липидного бислоя. Рисунок показывает, как белки погружены в мембрану, а также положение углеводных цепей, проецирующихся с наружной поверхности («strings of sausages»).
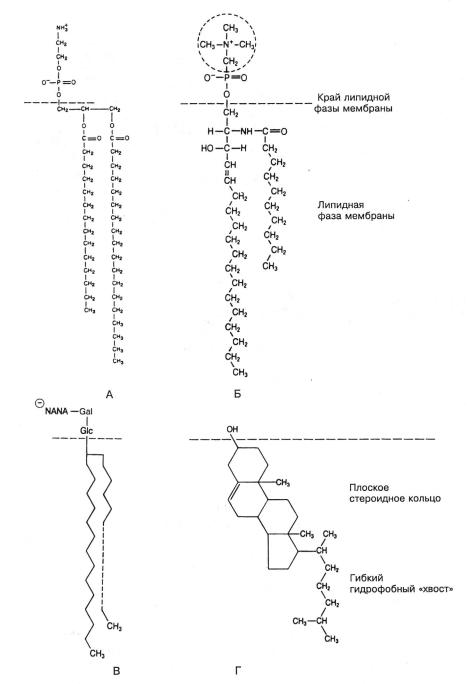
Рис.1.4. Некоторые распространенные липиды мембран.
(А) Фосфатилилхолин (лецитин); (Б) сфингомиелин; (В) ганглиозид; (Г) холестерин. Пунктирная линия символизирует длинную алифатическую цепь.
Gal – галактоза, Glc – глюкоза, NANA – N-ацетилнейраминовая кислота.
Из того, что было сказано выше, а также рис. 1.3 и 1.4 ясно, что биологические мембраны – это весьма тонкие структуры. Составляющие их липиды удерживаются гидрофобными силами и случайными электростатическими взаимодействиями их «головных» групп. Чрезвычайно свободная структура липидного бислоя означает, что при комнатной температуре индивидуальные молекулы пребывают в постоянном движении. Действительно, гидрофобные жирнокислотные хвосты молекул липидов сравнимы с корзиной змей, переплетенных в постоянном движении. Внутренность мембраны, таким образом, с любой точки зрения представляет собой органическую жидкость.
Не все липидные составляющие биомембран столь же лабильны, как фосфолипиды. Холестерин, в частности, – это совершенно другой тип молекулы. Как показано на рис. 1.4, молекула холестерина состоит из трех составных частей: гидрофильной «головы» – гидроксильной группы, жесткого тарелкообразного стероидного кольца и гибкого гидрофобного хвоста. Количество холестерина в мембране значительно варьирует; когда он присутствует, увеличивается жесткость мембраны и уменьшается ее текучесть.
Текучесть мембраны определяется, на самом деле, не только количеством присутствующего в ней холестерина, но и длиной и насыщенностью жирных кислот, образующих ее основу. Искусственные мембраны, образованные липидами только одного вида, обладают достаточно резкой характеристикой данного фосфолипида – «температурой перехода» от жидкого состояния к гелю. Эта температура варьирует в различных местах естественной биомембраны, в зависимости от количества холестерина и насыщенности фосфолипидных «хвостов». Естественная мембрана может, таким образом, рассматриваться как мозаичная структура с различной степенью текучести.
Белки
В «лоскутное одеяло» биомембраны погружены белки. Хотя гликолипиды (такие, как молекулы клеточной адгезии) очень важны для клеточного распознавания, все же наиболее важные характеристики биомембран обусловлены не липидами, в белками. Количество белка в мембранах варьирует от 20% (миелин) до прибл. 75% массы (внутренняя мембрана митохондрий). Большинство мембран содержит по массе около 50% белка.
Большинство белков (как показано на рис. 1.4), погружено в мембрану. Они «плавают», как айсберги в переменчивом «море» фосфолипидов, или, если посмотреть на это иначе, образуют мозаику в жидком фосфолипидном матриксе. По этим причинам такая концепция структуры биомембран называется «жидкостно-мозаичной» моделью. В некоторых случаях белки пронизывают весь бислой и соприкасаются как с внутриклеточным, так и внеклеточным пространствами. В других случаях белки присоединены к мембране цепью жирной кислоты, фосфолипидом или пренильной группой. В этих случаях сам белок расположен в цитозоле. Некоторые из этих вариантов присоединения белков показаны на рис 1.5. Необходимо отметить, что мембранно связанные белки образуют базовые элементы всех сенсорных рецепторов.

Рис.1.5. Некоторые пути, которыми белки ассоциируются с мембраной. Цилиндры внутри мембраны символизируют α-спирали. (А) Одиночная α-спираль проходит через мембрану; (Б) многочисленные α-спирали проходят через мембрану; (В) белок соединен с цитоплазматической частью бислоя жирнокислотной цепью или пренильной группой (важный пример такого типа связи – G-белки); (Г) белок, погруженный в мембрану, нековалентно связан с другим белком в цитозоле.
Трансмембранные белки построены таким образом, что гидрофобные домены погружены в мембрану, а гидрофильные обращены в водные – внутриклеточный и(или) внеклеточный компартменты (см. рис. 1.5) По сравнению с глобулярными белками водного цитозоля внутримембранные домены мембранных белков в известном смысле перевернуты: их гидрофобные аминокислотные остатки обращены кнаружи, а гидрофильные загнуты внутрь. Это обеспечивает способность белка удерживаться в мембране. Очень часто, как это показано на рис. 1.5, внутримембранные домены состоят из α-спиральных сегментов. Опять-таки, огромное большинство аминокислотных остатков, образующих α-спирали, гидрофобны.
Исследования включения ферментативных белков в искусственный липидный бислой показывают, что активность таких белков кондиционируется их липидным окружением. Характеристики бислоя, такие как длина жирно-кислотной цепи, степень их насыщенности и природа липидных «голов», влияют на биологическую активность фермента. Точно так же, как на водорастворимые ферменты влияют характеристики водного окружения (рН, концентрация солей и т. д.), так ферменты, погруженные в слой липидов, зависят от конкретной структуры последних.
Подвижность белков
Мы уже сравнивали мембранные белки с айсбергами, плавающими в липидном море. Поэтому неудивительно, что многие из них обладают значительной латеральной подвижностью. Эта подвижность с большим эффектом была использована в формировании сигнальных систем, основанных на перемещениях белков в плоскости мембраны. Коэффициент диффузии белков составляет от прибл. 10-9 см2/с для зрительных пигментов наружного сегмента палочек до прибл. 10-11 см2/с для других белков. В первом случае белок проходит около 0,1 мкм в секунду, а во втором – 0,001 мкм/с. Существует множество причин для таких больших различий подвижности. Во-первых, это может происходить вследствие различий липидного состава мембран, который, как указывалось выше, влияет не ее текучесть. Белок может быть также частью большого комплекса с другими белками, который оказывается слишком большим, чтобы легко перемещаться. Подвижность может быть затруднена не принадлежащими собственно мембране структурами, такими как щелевые и тесные контакты, а также десмосомы и т. д. Последнее по порядку, но далеко не последнее по важности – возможность того, что мембранные белки заякорены за элементы примембранного цитоскелета.
1.1.3. Рецепторные молекулы
На границе между организмом и окружающей средой располагаются рецепторные молекулы. Не все органы чувств обращены такими молекулами во внешнюю среду, однако две важные экстероцепторные системы организованы именно так – хеморецепторы и фоторецепторы. Даже сенсорные системы, которые не полагаются на рецепторные молекулы в детектировании изменений окружающей среды, механо- и терморецептивная, тем не менее используют (как мы увидим ниже) мембранные белки, хотя и несколько иным образом.
Хемо- и фоторецепторные клетки имеют особую белковую организацию, сходную с той, которая обнаружена в рецепторных молекулах, реагирующих на нейромедиаторы в множестве синапсов. Полипептидные цепи таких рецепторов семь раз проходят через мембрану (рис. 1.6). Из-за такой организации – с семью трансмембранными сегментами, рецепторы именуются семидоменными (или 7ТМ), а иногда и змеевидными. Многие, но далеко не все семидоменные рецепторы эволюционно связаны. Они принадлежат огромному суперсемейству белков – согласно расчетам до 2% генома может быть занято кодированием этих вездесущих рецепторов.
Схематическое изображение на рис. 1.6А показывает, как семь трансмембранных сегментов расположены в мембране. Оно также показывает наличие больших внутри- и внеклеточных доменов. Рис. 1.6Б показывает, что в реальности семь трансмембранных сегментов образуют как бы пилоны полой колонны, ориентированные подобно лепесткам диафрагмы объектива или клепкам в бочке.

Рис.1.6. Архитектура семидоменного рецептора. (А) схематическое изображение: семь трансмембранных сегментов обозначены цифрами от 1 до 7. N-конец расположен внеклеточно, к нему обычно присоединены углеводные остатки (т.е. он гликолизован), что обозначено знаками е-1, е-2, е-3, они также могут быть гликолизированы. Внутриклеточные петли i-1, i-2, i-3 представляют собой места распознавания для специфических G-белков. Темными точками обозначены места фосфорилирования для протеинкиназ, а крестиками – сайты, на которые воздействуют специфические десенситизирующие протеинкиназы. (Б) Трехмерная конформация рецептора в мембране.
Семидоменные рецепторы не только имеют общую архитектуру, но и мембранно-связанные средства усиления сигнала. Этот механизм основывается на латеральной подвижности белков, в данном случае – G-белков, в биомембранах и на том обстоятельстве, что липидный бислой удерживает эти белки в тесной близости, так что они не могут диффундировать в цитозоль. Тонкий структурно-функциональный анализ семидоменных рецепторов показал, что первая, вторая и третья цитоплазматическая петли (1-1,1-2 и 1-3), а также карбоксильный конец (рис. 1.6 А) критичны для связывания с С-белком, при этом третья петля особенно важна в распознавании специфических G-белков. Кроме того, показано, что рецептор, подвергнутый длительному воздействию лиганда, значительно уменьшает свою чувствительность – это явление известно как десенситизация. Десенситизация происходит вследствие активности специфических протеинкиназ, фосфорилирующих гидроксильные группы серинового, треонинового и тирозинового остатков карбоксильного конца рецептора. Эти остатки обозначены крестиками на рис. 1.6 А. Помимо того сериновые, треониновые и тирозиновые остатки подвергаются воздействию неспецифических протеинкиназ (обозначены кружками). Фосфорилирование меняет трехмерную конформацию рецептора. Чувствительность восстанавливается при дефосфорилировании одним из многих фосфатазных ферментов, распространенных в цитозоле.
1.1.4. Мембранные сигнальные системы
Внешние мембраны клеток, разграничивающие внешнюю среду и цитозоль, развили множество биохимических механизмов, которые преобразуют внешние стимулы в передаваемые в цитозоль сигналы.
G-белки
Когда семидоменная рецепторная молекула, локализованная в мембране сенсорной клетки, активируется какими-то изменениями во внешней среде, она претерпевает конформационные изменения. Последние детектируются G-белками, связанными с мембраной, которые, в свою очередь, активируют эффекторные молекулы в мембране. Часто это приводит к выделению вторичных мессенджеров в цитозоль. Этот процесс схематически показан на рис. 1.7.

Рис.1.7. Схема G-белок сигнальной системы. S – стимул; R – мембранный рецептор; E – эффектор (фермент, ионный канал и т.д.); M – вторичный мессенджер.
G-белки, участвующие в передаче сигнала, являются членами еще одного большого надсемейства белков, в данном случае – гуанин-связывающих белков. G-белки – это прецизионные регуляторы, включающие или выключающие активность других молекул. Все С-белки «включаются» при связывании с ГТФ и «выключаются» гидролизом ГТФ до ГДФ. Этот гидролиз катализируется ГТФ-азной активностью самих G-белков. Процесс этот сравнительно медленный, протекающий в течение секунд – десятков секунд.
G-белки биологических мембран имеют гетеротримерную структуру. Они состоят из большой α-субъединицы (около 45 килодальтон – кДа), а также меньших β- и γ-субъединиц (рис. 1.8). α-субъединица обладает ГТФ-азной активностью, в неактивной («выключенной») форме она связывает молекулу ГДФ на активном сайте. Субъединицы β и γ связаны между собой, и в физиологических условиях не могут быть диссоциированы. В неактивном состоянии β-γ-комплекс непрочно связан с α-субъединицей. β-субъединица связана с цитоплазматическим листком биологической мембраны геранил-гераниловой цепью (20 атомов углерода в цепи), близкой по структуре к холестерину, α-субъединица также связана с мембраной жирной кислотой с длиной цепи в 14 атомов углерода (миристоевая кислота). Такие связи обеспечивают то, что комплекс G-белка удерживается в плоскости мембраны, но в то же время способен легко двигаться в этой плоскости. Легко себе представить, как весь комплекс G-белка с присоединенным ГДФ перемещается в плоскости мембраны под действием тепловых сил.

Рис.1.8. Конформация гетеротримерного мембрано-связанного G-белка. α-субъединица изображена с полостью, символизирующей сайт связывания ГДФ или ГТФ.
α-субъединицы чрезвычайно вариабельны. Например те, что обнаружены в обонятельной системе, существенно отличаются от таковых в зрительной системе, β- и γ-субъединицы менее гетерогенны, хотя известно множество различных их типов. Такая молекулярная гетерогенность дает возможность организовать гибкую высокоадаптивную сигнальную систему.
Когда комплекс G-белка, перемещающийся в мембране, входит в контакт с активированным семидоменным рецептором, это приводит к освобождению ГДФ. Вследствие избытка в цитозоле ГТФ диффузия последнего обеспечивает занятие освободившегося сайта. После того, как это происходит, тримерный комплекс G-белка разделяется. β- и γ-субъединицы, остающиеся соединенными между собой, диссоциируют от α-субъединицы, далее эти части комплекса двигаются своими отдельными путями, α-субъединица с присоединенным с ней ГТФ способна взаимодействовать с «эффектором» в мембране – ферментами, такими, как аденилатциклаза, или, возможно, ионными каналами. Фермент может активироваться или ингибироваться, а ионный канал – открываться или закрываться. Конкретные примеры будут рассмотрены в последующих главах. Взаимодействие с эффектором, однако, длится до тех пор, пока α-субъединица, являющаяся ГТФ-азой, удерживает ГТФ. Так что, очень вскоре присоединенный ГТФ гидролизуется до ГДФ. Когда это происходит, α-субъединица снова меняет свою конформацию и теряет способность активировать эффектор. После этого α-ГДФ взаимодействует с β-γ-комплексом и снова образует тримерный комплекс, завершая, таким образом, цикл (рис. 1.9). До недавнего времени полагали, что β - γ -комплекс не играет серьезной роли в мембранной сигнализации. Теперь это ставится под сомнение – существуют данные о том, что этот комплекс может играть независимую роль. Возможно, что он способен ингибировать активность свободной α-субъединицы или независимо влиять на мембранные эффекторы.
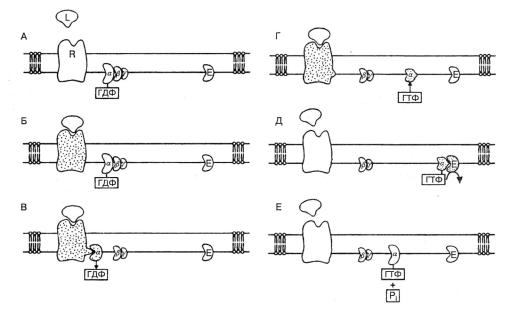
Рис.1.9. Сигнальная система G-белка в биологической мембране. (А) фаза покоя; (Б) лиганд присоединяется и активирует рецептор; (В) G-белок сталкивается с активированным рецептором, диссоциирует, и α-субъединица теряет ГДФ; (Г) α-субъединица активируется, присоединяя ГТФ; (Д) α-субъединица присоединяется к эффектору и активирует его, эффектор, в свою очередь, катализирует синтез вторичного мессенджера; (Е) дефосфорилиррование ГТФ деактивирует α-субъединицу, которая отсоединяется от эффектора, готовая начать весь цикл сначала. Пунктирное окрашивание рецептора на рисунке символизирует активацию; Е – эффектор; L – лиганд, R – рецептор.
Эффекторы и вторичные мессенджеры
Существует целый ряд классов эффекторных молекул: циклазные ферменты, фосфолипазы, фосфодиэстеразы, мембранные каналы. Соответственно, существуют и различные типы вторичных мессенджеров: цАМФ, цГМФ, инозитолтрифосфат (ИФ3), диацилглицерин (ДАГ) и вездесущий ион Са2+. В данном разделе будут рассмотрены только два типа эффекторов – аденилат-циклазы (АЦ) и фосфолипаза С-β (ФИФ2-фосфолипаза), которые продуцируют важные вторичные мессенджеры.
Аденилатциклазы
Эти ферменты катализируют формирование цАМФ, вездесущего и, возможно, самого важного вторичного мессенджера в клетках животных. Наиболее существенная роль цАМФ состоит в активации цАМФ-зависимых протеинкиназ (ПК). Будучи активирован, этот мультимерный фермент фосфорилирует (при участии АТФ) тот или иной из множества биологически активных белков, представленных в клетке – ферментативных, рецепторных и канальных белков, ядерных гистонов, факторов транскрипции и т. д. Фосфорилируются, как правило, сериновые, треониновые или тирозиновые остатки, что приводит либо к ингибированию (ср. упомянутую выше десенситизацию G-белок-связанных рецепторов), либо активации белка. Последующее дефосфорилирование, восстанавливающее исходное состояние, обеспечивается одним из множества фосфатазных ферментов цитозоля.
Молекулярно-биологическими методами показано существование в клетках млекопитающих по крайней мере шести различных аденилатциклаз. Все они имеют молекулярную массу около 120–130 кДа, а исследование их гидрофобной части показывает наличие 12 трансмембранных сегментов. Шесть циклаз различаются по чувствительности к β-γ-комплексу G-белков и к Са2+-связывающему белку кальмодулину. Аденилатциклаза типа 1, например, стимулируется Са2+-кальмодулином и ингибируется β-γ-димером, тогда как аденилатциклаза типа 2 не реагирует на первый и стимулируется вторым.
Фосфолипаза С-β (ФЛС-β или ФИФ2-фосфолипаза)
Активация этого важного вторичного эффектора приводит к продукции двух вторичных мессенджероь: инозитолтрифосфата (ИФ3) и диацилглицерина (ДАГ С-β фосфолипида – фосфатидилинозитол 4,5 бифосфата (ФИФ2), который в основном содержится во внутреннем листке плазматической мембраны (рис. 1.10).
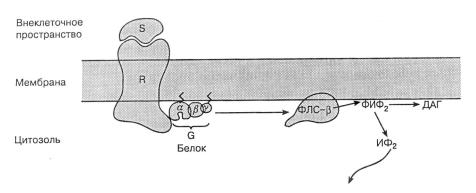
Рис.1.10. Путь формирования вторичного мессенджера, включающий ФЛС-β. Активация рецептора ведет через G-белок-связывающий систему к активации ФЛС-β. Последняя расщепляет мембранный липид фосфатидилинозитол-дифосфат на ИФ3 и ДАГ. ИФ3 диффундирует в цитозоль; ДАГ остается в мембране.
Более полное рассмотрение – в тексте.
Рис. 1.10 показывает рецептор, взаимодействующий с неким внешним сигналом, что приводит через G-белковый механизм к активации погруженной в мембрану ФЛС-β. Последняя реагирует с ФИФ2, образуя ИФ3 и ДАГ. ИФ3 – это водорастворимая молекула и потому легко диффундирует в цитозоль. Здесь он может взаимодействовать с соответствующими рецепторами в мембранах эндоплазматического ретикулума, что приводит к освобождению Са2+. Эти ионы имеют многочисленные эффекты на клеточную биохимию. В конце концов ИФ3 инактивируется инозитолтрифосфатазой. С другой стороны, ДАГ – гидрофобное вещество и потому остается в мембране.
Мы не закончили рассмотрение данной системы, поскольку еще не рассмотрели функцию ДАГ. Он взаимодействует с мембранно-связанной протеинкиназой – протеинкиназой С (ПКС), эта реакция является Са2+-зависимой. Следовательно, когда концентрация Са2+ в цитозоле повышается (эффект, который мы видели в случае ИФ3), ДАТ активирует ПКС. Такая активация также требует участия фосфолипида – фосфатидилсерина, который присутствует во внутреннем листке мембраны. Активированная ПКС может активировать белки, вызывающие специфические биохимические ответы. В нейронах продемонстрирован целый ряд таких реакций, в том числе синтез и секреция нейромедиаторов, изменение чувствительности рецепторов и функции цитоскелета.
Из изложенного выше ясно, что G-белковая система обеспечивает чрезвычайно гибкий способ трансформаци внешнего сигнала во вторичный мессенджер, который может диффундировать в цитозоль. Вторичных мессенджеров достаточно много (в зависимости от эффекторного фермента), однако наиболее распространенным является циклический АМФ (цАМФ). Альтенативным вариантом, как упоминалось выше, может быть воздействие α-субъединицы на работу мембранного канала, что в свою очередь может изменять электрическую полярность мембраны.
1.1.5. Каналы и воротные механизмы
Как показано выше, биомембрана состоит из белков, погруженных в липидный бислой, эффективно препятствующий проникновению гидрофильных веществ через мембрану. Погруженные в бислой белки часто формируют гидрофильные каналы, через которые могут проходить неорганические ионы и другие водорастворимые вещества. Некоторые из этих каналов, т. н. «каналы утечки», позволяют ионам, например ионам калия, перемещаться по градиенту концентрации в клетку или из нее; другие играют более активную роль и действуют как воротный механизм, контролирующий ионные потоки.
Каналы разделяются на две основные категории: активируемые лигандам и потому называемые медиаторными ионными каналами (МК) и управляемые потенциалом на мембране (потенциал-зависимые каналы, ПЗК).
Медиаторные каналы (МК)
Существует множество МК. Наиболее интенсивно исследуемым является никотиновый ацетилхолиновый рецептор (н-АХР). Он представляет собой большой (268 кДа) пентамерный белок, погруженный в мембрану. Пентамер объединяет две (по 461 аминокислоте) α-субъединицы, одну (493 аминокислоты) β-субъединицу, одну – (506 аминокислот) γ-субъединицу и одну (522 аминокислоты) δ-субъединицу. Каждая из субъединиц образует 4 трансмембранных сегмента (рис. 1.11 А), а все вместе 5 субъединиц компактно собраны вокруг центральной ионной поры (рис. 1.11 Б). Когда лиганд, в данном случае ацетилхолин (АХ), присоединяется к сайтам связывания двух α-субъединиц, канал открывается и одновалентные катионы двигаются по электрохимическому градиенту.
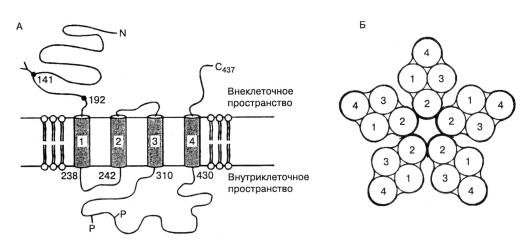
Рис.1.11.(А) Схематическое изображение α-субъединиц н-АХ-рецептора. Четыре спирали, представленные цилиндрами, пересекают мембрану. И С-, и N-концы локализованы внеклеточно. (Б) Сечение рецептора. Пентамерная структура целого рецептора сверху. Предполагается, что вторая спираль каждой субъединицы образует поверхность поры.
Известно много других типов МК, они активируются различными медиаторами (серотонином, глицином, γ -аминомасляный кислотой – ГАМК и т. д.) и все эти основные типы МК подразделяются на множество подтипов. Что касается сенсорных систем, наиболее важные МК, обнаруженные в обонятельных и фоторецепторных клетках, чувствительны к циклическим нуклеотидам (ЦНВ). В отличие от н-АХР-каналов, белок субъединицы образует 6 трансмембранных сегментов, а целый канал состоит из четырех субъединиц.
Потенциал-зависимые ионные каналы (ПЗК)
Существует также множество типов ПЗК. Все они активируются изменениями мембранного потенциала и различаются по типу ионов, движение которых регулируют. Таким образом, есть огромное множество потенциал-зависимых К+-каналов, а также различные типы С1–, Са2+- и Nа+-каналов. Рассмотрим потенциал-чувствительного Nа+-канала. Именно этот канал ответствен за восходящую фазу потенциала действия и является, таким образом, определяющим элементом возбудимых тканей, таких, как нервы и поперечно-полосатая мускулатура.
Потенциал покоя на мембране большинства клеток составляет около 50-60 мВ (заряд внутриклеточной среды отрицательный по отношению к внеклеточной). Казалось бы – немного. Однако следует помнить, что биологические мембраны очень тонки – не более 6-7 нм, так что разность потенциалов, на самом деле, очень значительна. Градиент потенциала в 60 мВ на 6 нанометрах составляет 105 В/см. Потенциал-зависимые белки в этом интенсивном электрическом поле ведут себя очень специфически. Любые изменения градиента потенциала воздействуют на конформацию ПЗК и, соответственно, открытое или закрытое состояние ионного канала.
Структура Nа+-канала была объектом интенсивных исследований и к на стоящему времени хорошо известна (схематически показана на рис. 1.12). Этот массивный полипептид (1820 аминокислот), как показано на рис. 1.12, состоит из четырех последовательных гомологичных друг другу доменов, каждый из которых образует шесть трансмембранных спиралей. Четвертая из них (54) в каждом домене содержит множество положительно заряженных аминокислотных остатков (особенно, аргинина и лизина), что и образует, как полагают, «сенсор потенциала», чувствительный к изменениям потенциала на мембране. Предполагается, что между пятой (85) и шестой (56) трансмембранной спиралями в каждом домене полипептидной цепи формируется «шпилька» (Н5), входящая в мембрану. Если представить трехмерную форму белка как полого цилиндра, «шпилька» выстилает пору и обеспечивает ионную селективность. Наконец, внутриклеточный сегмент полипептида между гомологичными доменами III и IV ответствен за инактивацию канала.

Рис.1.12. Схема расположения Nа+-канала в мембране. Четыре домена помечены I, II, III, IV. В реальности четыре домена формируют трехмерный агрегат с центральным каналом. Дальнейшие объяснения – в тексте.
Физиология Nа+-канала также глубоко исследована. Показано, что, когда разность потенциала на мембране падает ниже определенного порога, канал открывается на прибл. 1 мс и пропускает ток порядка 2 пА. По прошествии 1 мс времени открывания канал закрывается и не откроется больше, пока мембрана остается деполяризованной. Инактивация, как говорилось выше, связана с сегментом полипептида между доменами III и IV, блокирующим канал. Таким образом, канал существует в трех основных конформациях: закрытой, открытой и инактивированной. Этот цикл показан на рис. 1.13.

Рис.1.13. Цикл изменения конформации натриевого канала. (А) В покоящейся мембране натриевый канал закрыт. Активирующий воротный механизм (AG) закрыт, инактивирующий (IG) – открыт. (Б) Когда мембрана деполяризуется, изменение потенциала детектируется «сенсором потенциала», и активирующий механизм открывается. Ионы натрия двигаются по электрохимическому градиенту. Они перепрыгивают с одного сайта в канале на другой (как показано на рисунке) и, таким образом, «двигаются колонной». (В) через 1 мс инактивирующий механизм закрывается. (Г) Когда мембрана возвращается к уровню потенциала, активирующий механизм закрывается, а инактивирующий – открывается снова.
Точное время открывания и закрытия канала точно непредсказуемо, иными словами – это стохастический процесс. Кроме того, каждый участок возбудимой мембраны обладает большой популяцией Nа+-каналов, и порог открывания каждого из них несколько варьирует. По мере того, как возбудимая мембрана деполяризуется, открывается все больше Nа+-каналов. Входящий поток ионов Nа+ деполяризует и, в конце концов, даже реполяризует мембрану, образуя то, что электрофизиологи называют потенциалом действия (спайк).
2.2. Мембрана и потенциал действия
Как было показано ранее, с самого начала липидная биомембрана является границей между первичными клетками и окружающей средой. Поскольку ныне существующие клетки эукариот содержат множество внутренних мембран (митохондриальные, мембраны эндоплазматического ретикулума, лизосом и т. д.), стоит выделить внешнюю мембрану как плазматическую. Мы видели выше, что белковые элементы плазматической мембраны эволюционировали в направлении детектирования изменений во внешней среде и (в некоторых случаях) сигнализации об этих изменениях через мембранно-связанный G-белок. Плазматическая мембрана также развила средства контроля движения различных веществ в клетку и из нее. Следует помнить, что основой современных биомембран является липидный бислой. Гидрофильные вещества не могут (по определению) диффундировать через гидрофобный барьер липидного бислоя. Здесь не место для рассмотрения множества механизмов, которые сформированы клеткой, чтобы обойти это препятствие, однако, один из них должен быть рассмотрен здесь в некоторых деталях. Это – механизм или, скорее, группа механизмов, которые контролируют движение малых неорганических ионов через мембрану.
Неорганические ионы, конечно, водорастворимы. Электростатический заряд позволяет им входить в водную структуру и смешиваться с ней (рис. 2.1). С другой стороны, он препятствует их смешиванию с органической фазой, которая в данном случае представлена липидным бислоем. Чтобы пропустить их внутрь, необходимы гидрофильные «поры» в биомембране. Множество видов таких пор возникло с тех пор, как первые прокариоты возникли три с половиной миллиарда лет назад. Во всех случаях – это сложные белковые структуры, погруженные в мембрану. В целом, каналы очень специфичны в отношении того, какие ионы они пропускают.

Рис.2.1. Ионы в водной структуре. Молекулы воды электрически поляризованы. Поскольку кислород оттягивает на себя электрон от водорода, локальный отрицательный заряд связан с этим концом молекулы. Равный ему и противоположный по знаку заряд связан с другим концом. Вследствие этого молекулы воды стремятся образовать структуру вокруг положительно или отрицательно заряженных ионов, таких как С1– или Nа+, изолируя их друг от друга в растворе.
Сам факт, что ионы – это заряженные частицы, означает что их распределение у мембраны может быть выражено в электрических величинах. Еще со времен Гальвани и Вольта в конце восемнадцатого столетия известно, что функционирование нервной системы связано с электрическими явлениями. Однако только к середине XX века, когда были развиты электрические (в особенности, электронные) технологии, а также адекватные биологические препараты (гигантский аксон) удалось добиться истинного понимания «животного электричества».
Рассмотрим в первую очередь происхождение потенциала покоя (Vm), который существует на плазматической мембране, и покажем, как он меняется, когда рецепторные клетки подвергаются воздействию стимула и формируют т. н. «рецепторные потенциалы». Затем мы рассмотрим пассивные свойства электрических токов – т. н. кабельное или электротоническое проведение, которое играет важную роль во всех сенсорных и нейросенсорных клетках. Наконец, мы кратко рассмотрим природу рецепторного и генераторного потенциалов, сенсорной адаптации и важного феномена потенциала действия.
2.2.1. Измерение потенциала покоя
Уже говорилось, что потенциал покоя формируется на всех плазматических мембранах. Большинство клеток, в особенности нейронов и сенсорных клеток, крайне малы. Хотя сейчас методы исследования их электрических характеристик уже развиты, очень долго не удавалось провести точные измерения. Осознание того факта, что огромная трубчатая структура с диаметром 500–600 мкм у кальмара Loligo представляет собой гигантский аксон, имело огромное значение для электрофизиологов. Наконец-то они получили возможность ввести тонкие стеклянные микропипетки, заполненные электролитом, в аксон и измерить электрическую полярность мембраны непосредственно (рис. 2.2). Оказалось возможным и выдавить аксоплазму, как пасту из тюбика, и подвергнуть ее химическому анализу (табл. 2.1). Большинство пионерских работ, которые установили физические основы потенциалов покоя и действия были выполнены на этом общепринятом препарате.
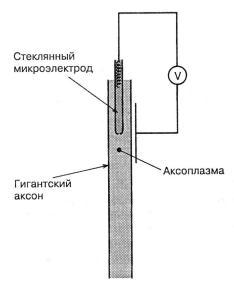
Рис.2.2. На схеме показан стеклянный микроэлектрод, заполненный раствором KCl, введенный в гигантский аксон. Электрический контур проходит через вольтметр на пластину электрода на внешней поверхности аксона.
Используя условия, показанные на рис. 2.2, было обнаружено, что внутриклеточный электрод регистрирует на мембране падение потенциала на прибл. 50 мВ. Этот потенциал был определен как потенциал покоя, Vm. Что же вызывает формирование разности потенциалов на мембране?
2.2.2. Ионные основы потенциала покоя
Мы уже отмечали, что был определен ионный состав аксоплазмы (табл. 2.1). Известно также, что существуют уравнения физической химии, которые связывают электрический потенциал на мембране с распределением ионов, способных проникать через нее. Наиболее известно уравнение Нернста, которое может быть записано в форме:
 (2.1)
(2.1)
В
уравнении 2.1
 – потенциал на мембране (в вольтах, хотя
обычно это величины порядка милливольт),
возникающий вследствие распределения
иона I;
R
– газовая константа; Т–
температура по Кельвину; F–
число Фарадея (величина электрического
заряда на моль одновалентного иона);
– потенциал на мембране (в вольтах, хотя
обычно это величины порядка милливольт),
возникающий вследствие распределения
иона I;
R
– газовая константа; Т–
температура по Кельвину; F–
число Фарадея (величина электрического
заряда на моль одновалентного иона);
 – валентность иона
(+1 для Nа+
и К+;
–1 для С1–);
ln
– натуральный логарифм;
– валентность иона
(+1 для Nа+
и К+;
–1 для С1–);
ln
– натуральный логарифм;
 и
и
 –
концентрации иона I
по внешнюю и внутреннюю стороны мембраны,
соответственно. Важно отметить, что
одной из посылок, из которой получено
уравнение Нернста, является то, что
мембрана полностью проницаема для
рассматриваемого иона. При выполнении
этого условия и известных равновесных
концентрациях иона на мембране можно
предсказать равновесный электрический
потенциал.
–
концентрации иона I
по внешнюю и внутреннюю стороны мембраны,
соответственно. Важно отметить, что
одной из посылок, из которой получено
уравнение Нернста, является то, что
мембрана полностью проницаема для
рассматриваемого иона. При выполнении
этого условия и известных равновесных
концентрациях иона на мембране можно
предсказать равновесный электрический
потенциал.

Табл.2.1. Концентрации ионов внутри и во внешней среде некоторых из обсуждаемых клеток.
Проверим уравнение заменой некоторых значений концентраций К+ по обе стороны мембраны. Во-первых, если предположить, что концентрации К+ по обе стороны мембраны равны, тогда подстановка их в уравнение Нернста обращает часть под логарифмом в единицу. Поскольку логарифм 1 – ноль, то уравнение дает нулевой потенциал на мембране. Это, собственно, то, что и наблюдается. Когда клетка погибает, мембрана утрачивает целостность, а ее насосные механизмы исчезают. Ионы движутся по своим градиентами концентраций до тех пор, пока их концентрации по обе стороны мембраны не уравниваются, а потенциал на ней не исчезает.
Теперь проверим уравнение подстановкой значений концентраций [К+]0 (около 5,5 мМ) и [К+]i (около 150 мМ), показанных в табл. 2.1. Тогда

Эта величина известна как нернстовский калиевый потенциал Vm или потенциал реверсии для калия. Смысл последнего термина состоит в том, что, когда на мембране удерживается такой градиент потенциала, отсутствует какой-либо результирующий поток этого иона через мембрану. Измерение реального потенциала покоя Vm на клеточной мембране обычно дает значения между –50 мВ и –75 мВ. Vk очевидно больше этих величин, однако совпадает по знаку и порядку величины. Если, однако, подставить в уравнение Нернста значения концентраций других существенных ионов (С1–, Nа+ и т. д.) получающиеся значения (VCl, VNa и т. д.) отличаются от Vm очень сильно. Особенно это заметно, если подставить значения концентраций для Nа+.
Причины таких отклонений понять нетрудно. Клеточные мембраны – это очень сложные структуры. Их проницаемость для разных ионов резко различается и, как было отмечено выше, уравнение Нернста работает только в случае ионов, для которых мембрана полностью проницаема. Известно, однако, что и ионы натрия, и ионы хлора имеют очень маленькие коэффициенты проницаемости через покоящиеся биомембраны.
Далее, важно, что Vm зависит не от трансмембранного распределения какого-то одного вида ионов, а от распределения всех ионов. Таким образом, для более полного понимания природы потенциала покоя следует обобщить уравнение Нернста. Оно должно учитывать различную проницаемость мембраны для разных ионов и то, что существенен не один тип ионов, а много.
Уравнение, о котором идет речь, выведено Дэвидом Голдманом и впоследствии стало известно как уравнение Голдмана. Его иногда называют и «уравнением постоянного поля», поскольку предполагается, что электрическое поле на мембране (градиент электрического потенциала Vm) неизменно, что, конечно, очень большое допущение. Тем не менее, уравнение Голдмана дает полезное первое приближение оценки биофизической ситуации на мембране. Оно записывается следующим образом:
 (2.2)
(2.2)
где Р – константа проницаемости иона, квадратные скобки обозначают, как это принято, концентрации иона с внутренней (обозначены «i») и внешней (обозначены «о») стороны мембраны, а R, T и F– их обычные значения.
Отметьте, что, если внешние концентрации катионов К+ и Na+ помещены в числитель уравнения, то внешняя концентрация аниона С1– – в знаменатель.
Проведем еще несколько опытов. Во-первых, если мы примем константы проницаемости для Nа+ и С1– равными нулю, то уравнение вырождается в уравнение Нернста для калия. Сходным образом, если принять РК = РС1 = 0, уравнение сводится к уравнению Нернста для Nа+ и дает VNa равным потенциалу на мембране (величина проницаемости для Nа+ удалена).
Липидный бислой плазматической мембраны, как это было показано в начале данной главы, полностью непроницаем для неорганических ионов. Они перемещаются через мембрану по каналам, образованным мембранными белками. Многие из этих т. н. «каналов утечки» еще не охарактеризованы полностью. Проницаемость плазматической мембраны для гидрофильных ионов зависит от этих каналов. «Пропускная способность» этих каналов у разных клеток варьирует. Нейроглиальные клетки, например, вероятно, более проницаемы для К+, чем нейроны.
Большинство сенсорных клеток, однако, сходны с нейронами по их большей проницаемости к К+, чем к С1– и Nа+:

Можно привести некоторые данные по сравнительной проницаемости, полученные из измерения потоков радиоизотопов ионов через плазматические мембраны:

Подставим эти константы проницаемости и соответствующие концентрации ионов (табл. 2.1 – мотонейрон кошки) в уравнение Голдмана:

Это значение Vm действительно очень близко к значению потенциала покоя у мотонейронов кошки, наблюдаемого при микроэлектродной регистрации.
Теперь посмотрим, что происходит, если повысить калиевую проницаемость на порядок. Если подставить в уравнение величину Рк = 1·10-6 см/с, все остальные параметры оставив неизменными, получим
Vm = –83 мВ
Уже было отмечено, что некоторые глиальные клетки существенно более проницаемы для К+, чем мембраны нейронов. Потому-то Vm на мембранах глиальных клеток заметно выше, чем потенциал покоя мембран нейронов. В сетчатке крупные глиальные клетки – мюллеровские клетки, имеют Vm от –70 до –90 мВ. Эта большая, чем обычно, К+-проницаемость, вероятно, имеет существенное значение для устранения избытка К+, образующегося в клетках сетчатки в ответ на освещение. Избыток К+ затем растворяется в жидкости стекловидного тела. Напротив, если повысить в уравнении Голдмана константу проницаемости для Nа+, можно предсказать значительное понижение Vm.
Необходимо отметить, что значительно легче измерять относительные, а не абсолютные проницаемости для ионов, поэтому уравнение Голдмана часто записывают в несколько ином виде:
 (2.3)
(2.3)
где
 и
и

Поскольку ион хлора играет меньшую роль во многих нейрофизиологических функциях, уравнение иногда упрощают еще больше:
 (2.3)
(2.3)
Однако, хотя ион хлора несущественен в многих областях нейрофизиологии, он играет ключевую роль в гиперполяризации в тормозных синапсах и в других случаях. В таких и подобных случаях важно использовать полную форму уравнения Голдмана.
2.2.3. Электротонические потенциалы и кабельное проведение
Рассмотрим рис. 2.3. Невозбудимая мембрана слабо деполяризована. Это следует особо подчеркнуть – на невозбудимой мембране нет риска вызвать формирование потенциала действия. Подобраны условия для детектирования очень маленьких, т. н. локальных токов. Внутренняя среда клетки, по сути дела, – ионный раствор, так же как и внеклеточная жидкость. Из этого следует, что они пропускают электрический ток. Если деполяризовать мембрану в точке «х», установится некоторая разность потенциалов между ней и точкой «у», находящейся от нее на некотором расстоянии. Расстояние, конечно, небольшое – редко больше, чем 1 микрон. Тем не менее, на этой дистанции малые электрические токи протекают до тех пор, пока не будет устранена разность потенциалов. Следовательно, и в точке «у» мембрана будет слегка деполяризована. Такие небольшие потенциалы известны как электротонические, а локальные токи – как электротонические токи или кабельное проведение.

Рис.2.3. Электротоническое проведение. Ток входит в точке «х» и приводит к формированию потенциала на мембране Vx. Отводящий электрод в точке «y» измеряет электротонический потенциал. Локальные токи показаны стрелками. Для упрощения рисунка токи из внешней среды не показаны.
Амплитуда электротонических потенциалов по крайней мере на порядок, а иногда и на два или более порядков, меньше, чем потенциала действия. Тем не менее, как ни малы электротонические потенциалы, их эффекты могут быть весьма значительны. Чтобы убедиться в этом, достаточно лишь вспомнить о чрезвычайной чувствительности потенциал-зависимых ионных каналов, таких как Ка+-каналы. Если локальные токи, распространяющиеся из области, где мембрана деполяризована, достигнут участка, изобилующего Nа+-каналами, возникающая деполяризация может запустить потенциал действия, передающийся в мозг, что само по себе может иметь непредсказуемые последствия.
2.2.4. Рецепторный и генераторный потенциалы
Рецепторный и генераторный потенциалы – это частные случаи электротонических потенциалов. Когда рецепторная (сенсорная) клетка, например механочувствительная волосковая или вкусовая, подвергается воздействию соответствующего стимула, реализуется более или менее сложный набор событий (который будет рассмотрен в деталях в последующих главах), ведущих к изменениям электрической полярности участка их мембраны. Это явление именуется рецепторный потенциалом. В большинстве случаев рецепторные потенциалы – это деполяризация, в других, однако, в частности в палочках и колбочках сетчатки, – это гиперполяризация. Так или иначе, результат – одни и тот же – возникают токи между подвергающимся воздействию участком мембраны и другими участками мембраны рецепторной клетки (рис. 2.4). В общем случае, изменения электрической полярности (увеличение ее или уменьшение) влияет на выделение медиатора на подлежащий сенсорный нейрон.
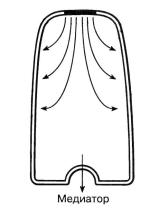
Рис.2.4. Рисунок показывает локальные токи, распространяющиеся от деполяризованного участка мембраны (отмечен черным) рецепторной клетки. В общем случае это ведет к деполяризации клетки, а это путем сложного биохимического процесса к выделению медиаторного канала.
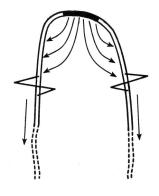
Рис.2.5. Деполяризация окончаний нейросенсорной клетки ведет к формированию локальных токов, которые инициируют потенциал действия.
Не все сенсорные системы развили специализированные семерные клетки. Обонятельные и некоторые механорецептивные системы построены на нейросенсорных клетках. В таких случаях функции детектирования соответствующих факторов внешней среды и передачи информации в мозг совмещаются в одной клетке (рис. 2.5). Электрофизиологические феномены при этом аналогичны только что описанным. Когда чувствительные окончания нейросенсорной клетки подвергаются воздействию стимула, ряд биохимических процессов приводит к изменению электрического потенциала (в случае нейросенсорных клеток – это всегда деполяризация). Механизмом локальных токов деполяризация распространяется в область мембраны, изобилующую потенциал-зависимыми Nа+-каналами. Если деполяризация достаточно велика, Nа+-каналы открываются, в результате чего генерируется потенциал действия, который без декремента передается в центральную нервную систему. Поскольку первоначальная деполяризация происходит не в специальной рецепторной клетке, она часто именуется генераторным потенциалом. Многие, однако, оба варианта называют рецепторными потенциалами.
Амплитуда генераторных и рецепторных потенциалов зависит от величины стимула – между потенциалом и интенсивностью стимула существует практически прямая пропорциональная зависимость (рис. 2.6). Из-за того, что локальные токи должны быть достаточно значительными по величине, чтобы запустить выделение медиатора (рис. 2.4) или активировать хотя бы часть популяции потенциал-зависимых Nа+-каналов до порогового уровня, запуск потенциала действия в сенсорном нерве наблюдается только, когда рецепторный или генераторный потенциал достигают определенной амплитуда. Иными словами, потенциал действия не генерируется до тех пор, пока стимул не достигнет критической величины (Sс на рис.2.6).

Рис.2.6. Соотношение интенсивностей стимула и величины рецепторного (генераторного) потенциала. График показывает первичные ответы на стимулы разной интенсивности. Как указывается в тексте, адаптация снижает амплитуду рецепторного (генераторного) потенциала при большой продолжительности стимула.
2.2.5. Сенсорная адаптация
Все сенсорные системы демонстрируют адаптацию. Это означает, что ответ (каким бы они ни был) на постоянный стимул с течением времени уменьшается. В сенсорных системах многоклеточных это выражается в том, что частота импульсации в волокне сенсорного нерва со временем снижается. В таких системах присутствует несколько форм адаптации. Обычно различают две крайние формы – быструю и медленную адаптацию (рис. 2.7). В первом случае при включении стимула сначала наблюдается быстрый залп активности в сенсорном волокне, которая быстро уменьшается еще до того, как стимул будет выключен. Выключение стимула также сопровождается залпом активности. Во втором случае также наблюдается залп активности при включении стимула, которая, хотя и уменьшается со временем, никогда не достигает нуля. Активность остается на некотором уровне плато до выключения стимула, когда она переходит на исходный уровень. В обоих случаях именно частота первого залпа характеризует интенсивность стимула.
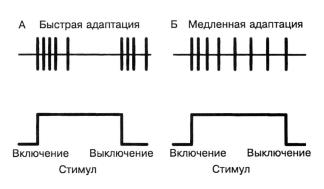
Рис.2.7.Сенсорная адаптация. (А) Быстро адаптирующееся волокно; (Б) медленно адаптирующееся волокно.
Биологические причины сенсорной адаптации многочисленны и разнообразны. Например, в некоторых случаях бактериальной хемочувствительности это происходит в результате метилирования белков «переноса рецептора». В многих животных системах, в которых рецепторные молекулы связаны с системой G-белков, это – результат инактивации рецепторной молекулы путем дефосфорилирования. Присутствие Са2+-каналов и кальций-зависимых К+-каналов (КСа) наряду с Nа+-каналами, в которых зарождается потенциал действия в сенсорных нервных окончаниях, также очень существенно. Когда мембрана деполяризуется в ответ на локальные токи, приходящие от стимулированных окончаний, потенциал-зависимые Са2+-каналы открываются, и поток Са2+ устремляется по градиенту концентрации в нейрон. Повышение внутриклеточного уровня Са2+ внутри клетки открывает Са2+-зависимые К+-каналы и избыток К+ также двигается по градиенту концентрации вовне клетки. Другими словами, мембрана становится необычно проницаемой для К+. Если подставить эту увеличенную константу проницаемости для К+ в уравнение Голдмана, то оно предскажет гиперполяризацию мембраны. В таких условиях локальным токам значительно труднее открыть потенциал-зависимые Nа+-каналы и инициировать потенциал действия. Таким образом, скорость импульcации снижается, в чем и проявляется сенсорная адаптация. Эта последовательность событий схематически отражена на рис. 2.8.

Рис.2.8.Один из механизмов, вызывающих адаптацию сенсорных окончаний. Деполяризация вызывает открытие Са2+-воротного механизма; ионы Са2+ входят в цитоплазму и воздействуют на Са2+-зависимые К+-каналы, что ведет к увеличению мембранной полярности, вследствие чего снижается вероятность инициации потенциала действия.
Биофизическая и молекулярно-биологическая ситуация в сенсорных окончаниях животных несомненно чрезвычайно сложна.
2.2.6. Потенциал действия
Поскольку органы чувств животных передают информацию в аналитический аппарат центральной нервной системы в форме потенциалов действия в сенсорных нервных волокнах, то их следует описать хотя бы в общих чертах.
Мы уже отмечали выше, что когда мембранное окружение популяции Nа+-канальных белков деполяризовано, каналы с наиболее низким порогом открываются, и Nа+ начинает по градиенту концентрации поступать в аксон. Этот процесс имеет эффект положительной обратной связи. По мере того, как Nа+ во все большем количестве входит в клетку, мембрана деполяризуется еще больше, вследствие чего открываются соседние более высокопороговые Nа+-каналы. Поток Nа+ увеличивается, мембрана деполяризуется и так далее. Мембрана достигает нулевого потенциала и реполяризуется (отрицательный заряд снаружи, положительный – внутри) до достижения нернстовского потенциала для Nа+ (VNa). Вследствие эффекта положительной обратной связи реверсия потенциала происходит очень быстро. В большинстве случаев VNa достигается в течение 0,5 мс, затем воротный механизм для Nа+ начинает закрываться.
Очень вскоре после открытия Nа+-каналов (<0,5 мс) срабатывает другой воротный механизм – открывается калиевый. Это позволяет ионам К+ покинуть аксон, а, поскольку Nа+-механизм закрывается, мембрана возвращается к исходной полярности, несколько превышает ее и приближается к нернстовскому К+-потенциалу, VK. Активность АТФ-зависимого Nа+/ К+-насоса в мембране возвращает ее к нормальному уровню потенциала покоя (Vm). Все эти события и результирующие изменения мембранной полярности показаны на рис. 2.9.

Рис. 2.9. Основные ионные каналы и характеристики проведения, ответственные за формирование потенциала действия. (A) Na+- и К+-проведение показано кривыми, помеченными gNa и gK (левая ордината градуирована в мСи/см2). Пунктирная линия показывает потенциал на мембране, образующийся за счет этих проводимостей. Горизонтальные пунктирные линии вверху и внизу рисунка показывают VNa и VK, соответственно. (Б) Ось времени сильно растянута по сравнению с (А). Верхнюю часть рисунка (Б) следует сравнивать с пунктирной линией на рисунке (А). Нижняя часть рисунка (Б) показывает потоки Na+ и К+, которые возникают вследствие открывания и закрывания Na+- и К+-каналов аксональной мембраны.
Ну, теперь все в порядке, однако смысл потенциала действия (нервного импульса) заключается в его распространении. Как это драматическое изменение мембранной полярности распространяется? И снова ответ заключается в локальных токах. Мы уже видели, что деполяризация небольшого участка мембраны ведет к возникновению малых электрических токов, распространяющихся отсюда и деполяризующих следующие участки мембраны на небольшом расстоянии. То же самое происходит и когда мембрана резко меняет полярность при прохождении потенциала действия, описанного выше. Локальные токи, деполяризуя соседний участок мембраны, так же открывают в нем Nа+-каналы и запускают последовательность событий, ответственную за формирование потенциала действия, описанную выше. Можно сказать, что потенциал действия похож на огонь, бегущий по дорожке из пороха. Каждый активированный участок запускает последующий, оставляя за собой дорожку из пепла. В случае нервного волокна инактивация, символизируемая пеплом, представляет собой гиперполяризацию мембраны вслед за прошедшим потенциалом действия (рис. 2.9) и, что более существенно, то, что Ка+-воротный механизм остается в закрытом состоянии в течение прибл.1,5 мс после их потенциал-зависимого открывания. Это состояние мембраны именуется рефрактерностью.
Рефрактерный период длительностью 1,5–2 мс имеет существенное значение для сенсорной сигнализации. Он ограничивает частоту, с которой импульсы могут следовать по сенсорному нервному волокну. Такая длительность означает, что сенсорное волокно в состоянии проводить импульсы с частотой не выше 500 Гц. Это важно, например, в детектировании частоты звука и частотной дискриминации в слуховой системе.
В то время, как рефрактерный период ограничивает частоту, с которой импульсы могут проводиться по нервному волокну, диаметр последнего (при прочих равных) определяет скорость проведения (табл. 2.2). Чем больше диаметр, тем дальше по аксоплазме распространяются локальные токи и на большем расстоянии они могут открыть Nа+-воротный механизм. Поэтому у многих беспозвоночных, например, кольчатых червей и головоногих моллюсков, развились гигантские волокна, обеспечивающие быстрое проведение, необходимое для реакции избегания. Позвоночные развили иной механизм увеличения скорости проведения – миелинизацию.
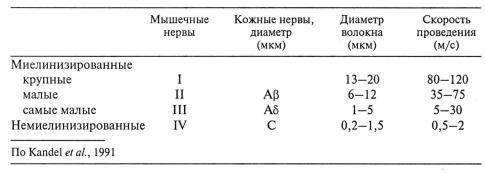
Табл.2.2.Некоторые характеристики афферентных волокон млекопитающих.
Миелин состоит из нескольких слоев мембран шванновских клеток, обвивающихся вокруг аксон, и обеспечивает очень эффективную электрическую изоляцию. Последняя предупреждает утечку внутриклеточного компонента локального тока из аксоплазмы, «удерживая» его внутри волокна, и обеспечивает его распространение. У беспозвоночных такого специфического и эффективного механизма повышения скорости проведения не развилось.
Табл. 2.2 показывает скорость проведения импульсов в афферентных волокнах млекопитающих. Афферентные волокна мышц состоят из четырех перекрывающихся классов (I–IV), чья скорость проведения составляет от 120 м/с в наиболее крупных миелинизированных волокнах (диаметр ок. 20 мкм) до прибл. 0,5 м/с в самых тонких немиелинизированных (диаметр ок. 0,5 мкм). В сенсорных нервах кожи отсутствуют наиболее быстрые волокна класса I (или Аα). Кожные нервы, таким образом, подразделяются на три группы Аβ, Аδ и С, что соответствует группам II, III и IV мышечных афферентов.
