
Лекція №13
Тема: РЕГУЛЯЦІЯ КЛІТИННОГО МЕТАБОЛІЗМУ
Регуляція клітинного метаболізму можлива наступними шляхами:
Компартменталізація – локалізація метаболітів і ферментів у різних частинах клітини, утворення метаболічних каналів.
Регуляція активності ферментів (стимулювання або інгібування).
Регуляція синтезу ферментів.
КОМПАРТМЕНТАЛІЗАЦІЯ
Найбільш загальний «канальний» механізм – це компартменталізація – розташування ферментів і метаболітів у різних клітинних структурах або органелах. Особливо вона важлива для еукаріотних мікроорганізмів, які мають багато оточених мембраною органел. Наприклад: окиснення жирних кислот відбувається всередині мітохондрій, в той час як їх синтез проходить у цитоплазматичному матриксі. Компартменталізація робить можливим одночасне, але відокремлене протікання подібних метаболічних процесів та їх регуляцію. Більш того, активність шляху може координуватись шляхом транспорту метаболітів і коензимів у той чи інший компартмент клітини.
Допустимо, два шляхи в різних відділах клітини потребують НАД+ для своєї активності. Розподіл НАД+ між цими двома відділами визначить відносну активність цих двох конкуруючих шляхів. Матиме переваги той шлях, який отримає більше НАД+. Так само і з ферментами: якщо два ферменти потребують один субстрат, то «виграє» той фермент, у якого спорідненість до субстрату буде більшою.
КОНТРОЛЬ ЗА ФЕРМЕНТАТИВНОЮ АКТИВНІСТЮ
Коректування активності регуляторних ферментів контролює функціонування багатьох метаболічних шляхів. Існує декілька механізмів такого регулювання.
Алостеричне регулювання
Як правило, регуляторні ферменти є алостеричними. Такі ферменти місять активний (каталітичний) і алестеричний (регуляторний) центри. Вони відрізняються місцем розміщення і конфігурацією.
Речовини, які впливають на активність алостеричних ферментів, називаються ефекторами або модуляторами. Якщо вони підвищують активність ферменту, їх відносять до активаторів, якщо знижують – до негативних ефекторів. В якості ефекторів можуть виступати субстрати, проміжні та кінцеві продукти, АТФ, АДФ, ацетилкофермент-А, НАДН2 тощо.
Регуляторний вплив ефектора на алостеричний фермент відбувається на рівні утворення фермент-субстатного комплексу. Приєднання ефектору до алостеричного центру змінює конформацію каталітичного центру і, відповідно, спорідненість ферменту до субстрату. Вплив негативного ефектора зображений на рис. 1.
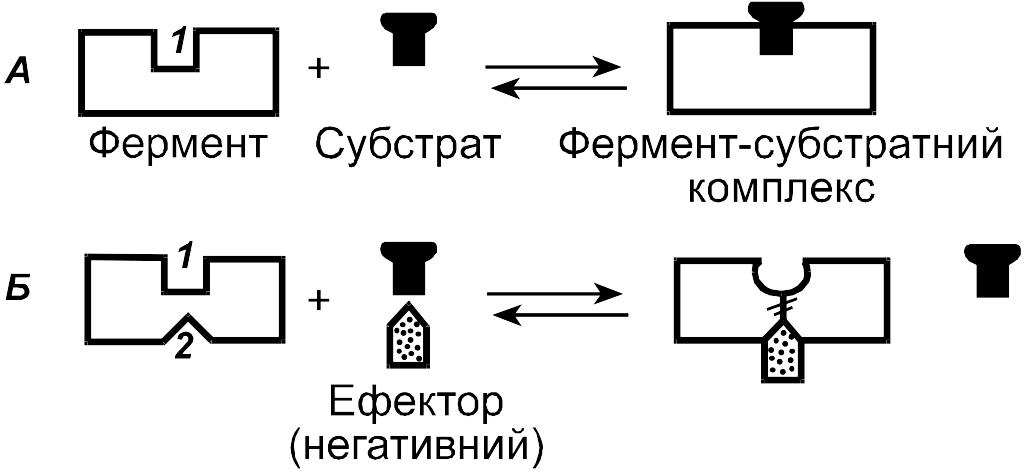
Рис. 1. Схема взаємодії простого (А) і алостеричного (Б) ферментів зі субстратом і ефктором: 1 – активний центр; 2 – алостеричний центр
BOX
Кінетичні характеристики нерегуляторних ферментів показують, що константа Міхаеліса (Кm) – це концентрація субстрату, необхідна для того, щоб фермент працював вполовину своєї максимальної швидкості. Вона дійсна тільки для процесів, які описуються гіперболою. Залежність швидкості протікання реакцій від субстрату у алостеричних ферментів описується сигмоїдальною кривою. Концентрація субстрату для половини від максимальної швидкості в даному випадку називається К0,5. Один з найбільш вивчених алостеричних регуляторних ферментів у E.coli – аспартаткарбомоїлтрансфераза (АКТаза). Він каталізує конденсацію карбамоїлфосфату і аспартату з утворенням карбамоїласпартату, який далі іде на біосинтез піримідинів. Фермант має більше, ніж один активний центр. Приєднання молекули субстрату до одного активного центру збільшує спорідненість субстрату до іншого. Цитідин трифосфат (ЦТФ) – кінцевий продукт піримідинового біосинтезу - інгібує фермент, а АТФ – активує його. Обидва ефектори змінюють значення К0,5, але не змінюють максимальної швидкості роботи ферменту. Коли присутній ЦТФ – фермент гальмується. В присутності активатору АТФ фермент максимально активний у широких межах концентрацій субстрату. Таким чином, коли шлях дуже активний, то концентрація ЦТФ швидко зростає, АКТ-азна активність зменшується, і рівень кінцевого продукту падає. В протилежність цьому, АТФ стимулює синтез ЦТФ. Аспартаткарбомоїлтрансфераза E.coli – це великий білок, який складається з двох каталітичних і трьох регуляторних субодиниць. Каталітичні субодиниці містять тільки каталітичні центри, на них не впливає ні ЦТФ, ні АТФ. Регуляторні центри не каталізують реакцію, однак до них приєднуються або ЦТФ, або АТФ. Коли приєднується ефектор, від спричинює конфірмаційні зміни в регуляторному центрі і, відповідно, в каталітичному. Фермент перетворюється з менш активної Т-форми на більш активну R-форму. |
