
- •2 Курсу всіх форм навчання)
- •Лабораторна робота № 1 термодинаміка розкладання карбонатів
- •Теоретичні відомості
- •Зміст роботи
- •Проведення досліду
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 2 кінетика розкладання вапняку
- •Теоретичні відомості
- •Зміст роботи
- •Проведення досліду
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 3 розподіл сірки між металом і шлаком
- •Теоретичні відомості
- •Зміст роботи
- •Порядок роботи
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 4 розчинність азоту в розплавах заліза
- •Теоретичні відомості
- •Зміст роботи
- •Порядок роботи
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 5 розчинність кисню в розплавах заліза
- •Теоретичні відомості
- •Зміст роботи
- •Порядок роботи
- •Розрахунки
- •Зміст роботи
- •Проведення дослідів
- •Розрахунки
- •Контрольні питання
- •Вимоги до техніки безпеки
- •Вимоги до оформлення звіту
- •Перелік рекомендованої літератури
Контрольні питання
1. Азот і водень в металі: їх джерела, вплив на якість металу.
2. Способи дегазації металу та їх ефективність.
3. Закон Генрі.
4. Як впливає парціальний тиск двоатомних газів (водню, азоту) на їх розчинність в металі?
5. Як впливає температура системи на розчинність двоатомних газів (водню, азоту) в металі?
6. Як впливає хімічний склад металу на розчинність в ньому двоатомних газів (водню, азоту)?
Лабораторна робота № 5 розчинність кисню в розплавах заліза
Ціль роботи: експериментально визначити активність кисню в розплаві заліза; встановити вплив температури і вмісту вуглецю на активність кисню в розплаві; навчитися розраховувати концентрацію кисню в розплаві.
Теоретичні відомості
У сталеплавильних агрегатах для окислення вуглецю, розчиненого в рідкому чавуні, використовують газоподібний кисень. При продуванні рідкого металу киснем протікає реакція:
[С] + [О] = СО
Аналогічним чином окислюються і інші елементи чавуну. Термодинамічний аналіз показує, що кисень може розчинятися в рідкому залізі. Чіпман і Тейлор встановили, що:
lg [О]max = -6320/Т + 2,734.
Розчин кисню в рідкому залізі дещо відхиляється від ідеального. У рівнянні аО =fО × [О]max коефіцієнт активності fО < 1. Знайдено, що:
lg fО = еОО× [О]max =(-1750/Т + 0,76) × [О].
Рівноважна кількість розчиненого кисню залежить від температури металу і вмісту в ньому інших розчинених елементів (С, Si, Mn та ін.). Надмірний вміст кисню в металі призводить до погіршення його якості, інтенсивного окислення заліза і втрат його зі шлаком і газами, що відходять. Для контролю окисленості розплавів на основі заліза широко використовують електрохімічні вимірювання активності кисню методом електрорушійної сили (е.р.с.) з твердим електролітом (звичайно це ZrO2). Одним з електродів є рідкий метал, іншим – суміш Mo-MoO2.
В розплаві залізо-вуглець концентрація і активність кисню пов'язані рівнянням (нехтуючи еОО × [О], оскільки [О] - незначна):
lg [O] = lg aO + 0,45×[C].
Зміст роботи
Робота виконується під керівництвом викладача на комп'ютерному тренажері, схема якого наведена на рис. 4.1.
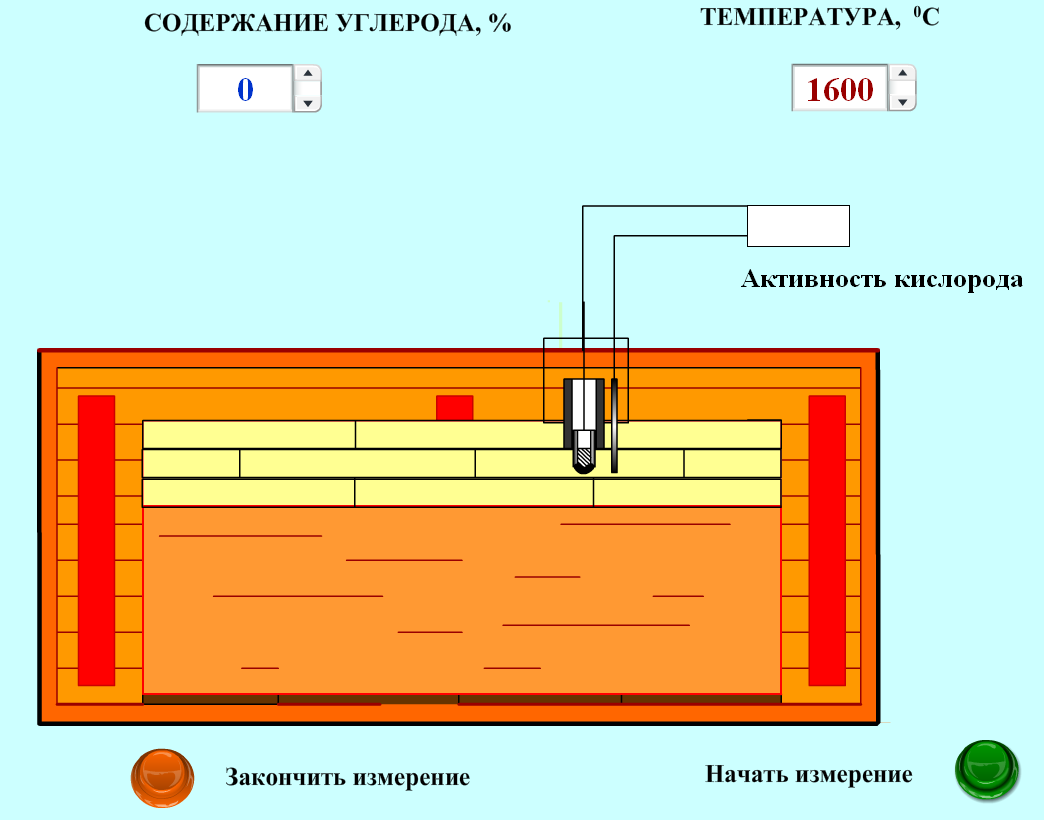
Рисунок 5.1 – Схема комп’ютерного тренажера
Модель установки складається з ковша, в якому знаходиться рідкий метал. Приймаємо, що в металі після продування киснем досягнута рівноважна його концентрація. Можна встановити температуру металу і задати вміст в ньому вуглецю. Опустивши киснево-концентраційний датчик в метал, можна заміряти виниклу е.р.с, яка перераховується на активність кисню (мікропроцесор встановлено в приладі) і видається на дисплей. Вимір вимагає певного часу для встановлення рівноваги між датчиком і металом.
Порядок роботи
1. Дослідити вплив температури металу на розчинність в ньому кисню. Встановлюється певний постійний вміст вуглецю. При різних температурах здійснюються виміри активності кисню.
2. Дослідити вплив вуглецю на рівноважний вміст кисню. Встановлюється певна постійна температура і при різних вмістах вуглецю заміряється активність кисню.
3. Після проведення вимірів розраховуються концентрації кисню, відповідні отриманим активностям.
