
- •2 Курсу всіх форм навчання)
- •Лабораторна робота № 1 термодинаміка розкладання карбонатів
- •Теоретичні відомості
- •Зміст роботи
- •Проведення досліду
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 2 кінетика розкладання вапняку
- •Теоретичні відомості
- •Зміст роботи
- •Проведення досліду
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 3 розподіл сірки між металом і шлаком
- •Теоретичні відомості
- •Зміст роботи
- •Порядок роботи
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 4 розчинність азоту в розплавах заліза
- •Теоретичні відомості
- •Зміст роботи
- •Порядок роботи
- •Розрахунки
- •Контрольні питання
- •Лабораторна робота № 5 розчинність кисню в розплавах заліза
- •Теоретичні відомості
- •Зміст роботи
- •Порядок роботи
- •Розрахунки
- •Зміст роботи
- •Проведення дослідів
- •Розрахунки
- •Контрольні питання
- •Вимоги до техніки безпеки
- •Вимоги до оформлення звіту
- •Перелік рекомендованої літератури
Контрольні питання
1. Які карбонати є найбільш застосовуваними в металургії? Наведіть приклади їх застосування.
2. Що таке пружність дисоціації карбонатів?
3. Що таке температура хімічного кипіння карбонатів?
4. Дайте визначення основних термодинамічних характеристик процесу дисоціації (парціальний тиск, константа рівноваги, вільна енергія, внутрішня енергія, ентальпія, ентропія).
5. Як впливає температура на величину пружності дисоціації карбонатів?
Лабораторна робота № 2 кінетика розкладання вапняку
Ціль роботи: вивчення впливу температури і крупності шматків вапняку на швидкість його розкладання.
Теоретичні відомості
Сукупний процес дисоціації карбонату кальцію
СаСО3(т) = СаО(т) + СО2(г)
складається з наступних стадій.
1. Розпад аніону СО32- з утворенням адсорбованих на твердій поверхні молекул СО2, СО32-→О2- · СО2(адс).
2. Десорбція цих молекул О2- · СО2(адс) → О2- + СО2(г).
У результаті 1 і 2 стадій в карбонаті залишаються пари іонів О2- та Са2+, які з початку розташовуються у кристалічній решітці СаСО3, утворюючі розчин СаО в карбонаті.
3. Утворення кристалів нової фази вапна з перенасиченого розчину та їх ріст.
Оксид кальцію має дуже малу розчинність в карбонаті. По мірі розвитку реакції і накопичення вказаних іонів розчин швидко стає насиченим, а в подальшому – перенасиченим. Угрупування іонів Са2+ та О2- вже не можуть довго утримуватись на старих позиціях, вони прагнуть відділитися і створити енергетично більш вигідну конфігурацію, з меншим значенням ізобарного потенціалу у вигляді кристалічної решітки вапна; відбувається розпад перенасиченого розчину.
Стадії 1, 2 і 3 разом являють собою кристалохімічне перетворення, в якому хімічна реакція супроводжується перебудовою кристалічної решітки.
4. Дифузія двоокису вуглецю. Для безперервного протікання процесу необхідно весь час відводити газоподібний продукт дисоціації з реакційної зони, інакше відбудеться накопичення СО2 до рівноважної концентрації, і реакція припиниться.
Дослідження в кінетиці показали, що швидкість розкладання карбонатів при постійній температурі змінюється з часом по певній залежності. Спочатку, на протязі деякого відрізку часу, що називають індукційним або інкубаційним періодом, не спостерігається явного перетворення. З деякого моменту вже можна спостерігати ознаки реакції, її швидкість спочатку повільно, а потім все сильніше зростає. Це так званий період автокаталізу, самопришвидшення. Після досягнення максимуму швидкість починає зменшуватись і реакція вступає в період «усередненого фронту».
Схема і закономірності розвитку зворотної реакції утворення карбонату приблизно такі ж, як і для прямої. Описаний механізм процесу зветься автокаталітичним, він характерний для топонімічних перетворень, тобто перетворень, що йдуть на поверхні розділу фаз, і багатьох інших реакцій.
Зміст роботи
Робота виконується під керівництвом викладача на комп’ютерному тренажері, схема якого приведена на рис. 2.1.
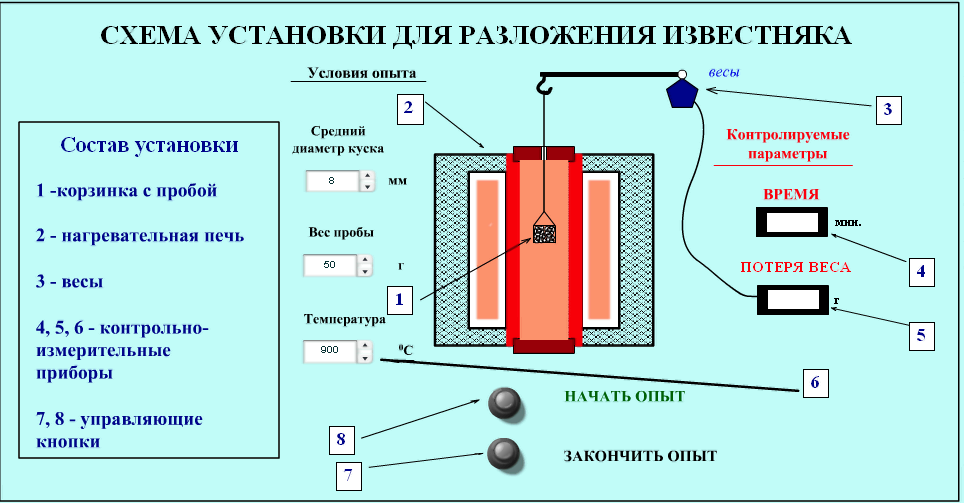
Рисунок 2.1 – Схема комп’ютерного тренажера.
Проведення досліду
1. Задати "Условия опыта": крупність шматків, величину проби, температуру кліканнями по кнопках у відповідних віконцях.
2. Кліканням по кнопці "Начать опыт" запустити систему контролю часу і втрати ваги проби.
3. Записувати контрольовані параметри: час і втрату ваги.
4. Дослід закінчується, коли втрати ваги стануть рівними нулю.
5. Кліканням по кнопці "Закончить опыт" система переводиться у вихідний стан.
Умови дослідів (і їхня кількість) задаються викладачем.
Для повторення досліду виконати пункти 1 - 5.
Кліканням на кнопці "Отчет" можна перейти до описання порядку складання звіту.
