
- •10.1.2. Методы получения
- •10.1.3. Физические свойства
- •10.1.4. Химические свойства
- •10.1.5. Многоатомные спирты
- •10.2. Фенолы
- •10.2.1.Классификация и номенклатура
- •10.2.2.Методы получения
- •10.2.3.Физические свойства
- •10.2.4.Химические свойства
- •Глава 11 альдегиды и кетоны
- •11.1. Классификация и номенклатура
Глава 10
ГИДРОКСИЛПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Гидроксилпроизводные
содержат в молекуле одну или несколько
ОН-групп. Гидроксилпроизводные,
содержащие связь
![]() ,
называют спиртами.
Соединения, в которых группа ОН связана
с ненасыщенным атомом углерода, называют
енолами,
с атомом углерода ароматического кольца
– фенолами.
,
называют спиртами.
Соединения, в которых группа ОН связана
с ненасыщенным атомом углерода, называют
енолами,
с атомом углерода ароматического кольца
– фенолами.
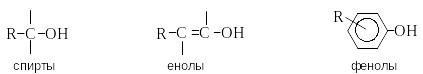
10.1. Спирты
10.1.1. Классификация и номенклатура
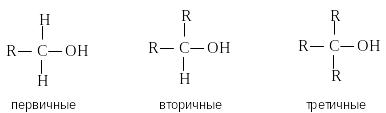
В зависимости от типа атома углерода, с которым связана гидроксильная группа, различают первичные, вторичные и третичные спирты.
В заместительной номенклатуре гидроксильная группа как старшая характеристическая группа обозначается суффиксом “-ол”. Если в молекуле имеются группы, превосходящие ее по старшинству, то гидроксильную группу обозначают префиксом “гидрокси-“. Согласно радикально-функциональной номенклатуре алканолы называются спиртами.

10.1.2. Методы получения
1) Гидролиз галогенпроизводных:
![]()
Hal = Cl, Br
2) Гидратация алкенов:
![]()
![]()
3) Восстановление карбонильных соединений:
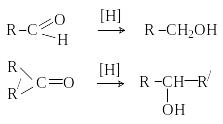
[H]:
![]() /кат.,
кат. – Ni,
Pt,
Pd;
/кат.,
кат. – Ni,
Pt,
Pd;
![]() ;
;
![]() .
.
10.1.3. Физические свойства
Спирты являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены ряда имеют приятный запах, у бутанолов и пентанолов запах становится неприятным («сивушным»).
Отличительная черта алканолов - аномально высокая температура кипения, что обусловлено сильными межмолекулярными взаимодействиями в спиртах за счет образования водородных связей.
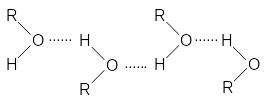
Низшие спирты С1-С4 хорошо растворимы в воде, что связано с их способностью к образованию водородных связей с молекулами растворителя.
Биологическая роль и применение в медицине
Большинство
спиртов являются физиологически
активными соединениями. Они обладают
токсическим и наркотическим действием,
которое возрастает с увеличением длины
цепи, проходя через максимум при
![]() .
.
Первый член гомологического ряда - метанол – сильный яд с кумулятивным действием. При приеме внутрь даже в небольших количествах (5 -10 г) вызывает слепоту, большие дозы (30 г) смертельны.
Этанол действует опьяняюще, а в больших дозах вызывает состояние, близкое к наркозу. Используется в медицине как наружное антисептическое средство, а также для приготовления настоек и экстрактов лекарственных веществ.
Бутиловые и амиловые спирты известны как компоненты сивушных масел, образующихся в качестве побочных продуктов при производстве этанола сбраживанием углеводов.
К одноатомным спиртам алициклического ряда относятся такие биологически активные соединения, как ментол, ретинол (см. 18.2.1), холестерин (см. 18.2.2).
10.1.4. Химические свойства
Реакции спиртов определяются присутствием группы ОН и протекают по следующим основным направлениям.
Замещение водорода ОН группы под действием оснований (кислотные свойства).
Взаимодействие с электрофильными реагентами по атому кислорода с неподеленной парой электронов (основные и нуклеофильные свойства).
Взаимодействие с нуклеофильными реагентами по -углеродному атому, несущему частичный положительный заряд (реакции нуклеофильного замещения ОН группы).
Дегидратация (участвуют связь С-Н в -положении и связь С-О).
Окисление (участвуют связь С-Н в -положении и связь О-Н).

Кислотные свойства. Спирты взаимодействуют с активными металлами (Na, K, Mg, Al и др.) с образованием алкоголятов.
![]()
![]()
этилат натрия
![]()
изопропилат алюминия
Алкоголяты образуются также при действии на спирты сильных оснований.
-

+


+

 =15,9
=15,9=33
При взаимодействии спиртов со щелочами равновесие сдвинуто в сторону гидролиза алкоголятов, так как спирты являются более слабыми кислотами, чем вода:
-
+

+
NaOH
=15,7
=15,9
Кислотность спиртов в водных растворах уменьшается в ряду с увеличением длины и разветвленности радикала:
|
CH3OH |
первичный |
вторичный |
третичный |
|
15,2 |
~16 |
~16,5 |
~17 |
Нуклеофильные свойства. Нуклеофильные свойства спиртов проявляются в их реакциях с карбоновыми и неорганическими кислотами и их производными, которые приводят к образованию сложных эфиров.

Для увеличения нуклеофильности спирты превращают в алкоголяты, которые способны взаимодействовать с галогенпроизводными с образованием простых эфиров:
R-Hal + R/ONa R-OR/ + NaHal
Однако алкоголят-ионы не только сильные нуклеофилы, но и сильные основания. Поэтому их взаимодействие с алкилгалогенидами может привести как к замещению, так и к элиминированию в зависимости от температуры и структуры алкилгалогенида и алкоголята. Например, для получения метилизопропилового эфира необходимо использовать метилиодид и изопропилат-анион, а не изопропилиодид и метилат-анион, так как в последнем случае будет доминировать реакция отщепления:
![]() (
(![]() )
)
![]() (E)
(E)
Основные свойства и реакции нуклеофильного замещения. Протекание реакции по схеме: R-OH + Y R-Y + OH-
невозможно,
поскольку гидроксид-анион – это сильное
основание и плохая уходящая группа. Для
проведения
![]() -реакций
необходимо предварительно модифицировать
ОН группу, превратив ее в хорошую уходящую
группу. Для этого спирты переводят в
оксониевые соединения или эфиры
неорганических кислот:
-реакций
необходимо предварительно модифицировать
ОН группу, превратив ее в хорошую уходящую
группу. Для этого спирты переводят в
оксониевые соединения или эфиры
неорганических кислот:

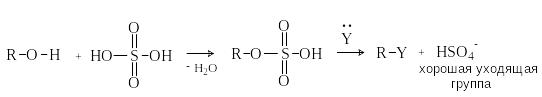
В биохимических процессах замещение ОН группы протекает через стадию превращения спиртов в эфиры фосфорной, дифосфорной и трифосфорной кислот, анионы которых являются легко уходящими группами:
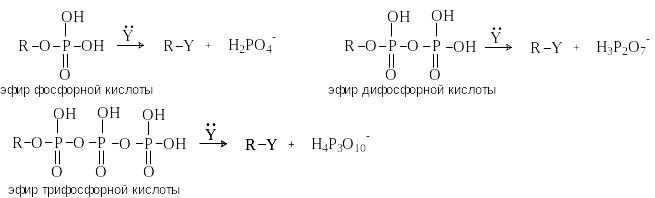
Замещение ОН группы на галоген. Спирты взаимодействуют с галогеноводородами и галогенидами фосфора и серы с образованием галогенпроизводных.
Действие галогеноводородов
R-OH + HHal R-Hal +
Реакция
протекает через стадию протонирования
ОН-группы с последующим нуклеофильным
замещением по механизму
![]() или
или
![]() .
.
R-OH
+ HHal
![]()
R-Hal +
R-Hal +
Первичные спирты реагируют по механизму . Реакция идет медленно, так как в протонных растворителях (вода, спирты) галогенид-ионы – слабые нуклеофилы. Вторичные и третичные спирты реагируют по механизму . Таким образом, реакционная способность спиртов возрастает в ряду:
первичный < вторичный < третичный
Реакционная способность галогеноводородов увеличивается в ряду:
HCl < HBr < HI
параллельно с возрастанием силы кислот и нуклеофильности галогенид-анионов. Однако HI не может быть использована, так как легко восстанавливает спирты до углеводородов. HBr реагирует с первичными, вторичными и третичными спиртами. HCl при обычных условиях действует только на третичные спирты.

Для вторичных и первичных спиртов требуется присутствие катализатора – кислоты Льюиса.
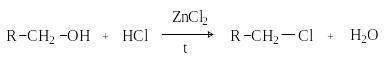
Действие галогенидов фосфора и серы
Замещение
ОН группы действием
![]() ,
,
![]() ,
,
![]() ,
,
![]() основано на предварительном превращении
спирта в эфиры кислот фосфора и серы,
которые затем атакуются галогенид-анионом.
основано на предварительном превращении
спирта в эфиры кислот фосфора и серы,
которые затем атакуются галогенид-анионом.
ROH
+
RCl +
![]() + HCl
+ HCl
ROH
+
RCl +
![]() + HCl
+ HCl
![]()
Образование простых эфиров. При нагревании спиртов в присутствии серной кислоты происходит замещение ОН группы на группу OR и образуются простые эфиры.
![]()
Реакция протекает через стадию протонирования спирта с последующим нуклеофильным замещением, в котором одна молекула спирта (протонированная) выполняет роль субстрата, а вторая – нуклеофила.

Дегидратация спиртов. При нагревании в присутствии кислотных катализаторов спирты отщепляют воду с образованием алкенов.
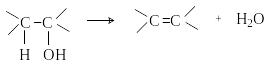
В случае вторичных и третичных спиртов процесс протекает по правилу Зайцева.

Дегидратация протекает преимущественно по механизму Е1 в соответствии со схемой:
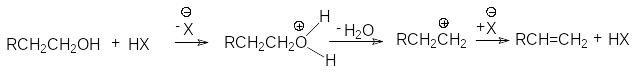
Х=
![]()
Атака аниона на промежуточно образующийся карбокатион может завершиться как отщеплением протона, так и присоединением к карбокатионному центру. Поэтому реакции дегидратации (элиминирования) протекают параллельно с образованием простых эфиров (нуклеофильным замещением). Склонность спиртов к дегидратации возрастает в ряду:
первичный < вторичный < третичный
Дегидратации способствует также высокая температура, например:
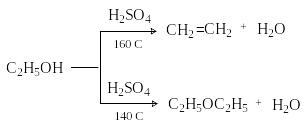
Окисление спиртов. Под окислением в органической химии понимают процессы, приводящие к обеднению субстрата водородом (дегидрирование) или к обогащению его кислородом. Окисление спиртов осуществляют при помощи двух основных приемов – дегидрирования и действия окислителей.
Дегидрирование
Первичные и вторичные спирты отщепляют водород при нагревании в присутствии медно-серебряного катализатора с образованием карбонильных соединений.

Третичные спирты в таких условиях не реагируют, а в более жестких – разрушаются.
Действие окислителей
Для
окисления спиртов используют
![]() ,
,
![]() ,
,
![]() .
.
Первичные спирты окисляются до альдегидов, которые далее легко окисляются до карбоновых кислот.
![]()
Реакцию можно остановить на стадии альдегида, если использовать кислый раствор дихромата натрия и отгонять образующийся альдегид из реакционной смеси:
![]()
Вторичные спирты окисляются до кетонов под действием или .

Окисление третичных спиртов протекает в жестких условиях и сопровождается деструкцией углеродного скелета.
