
- •«Элементы подгруппы углерода»
- •Оглавление
- •Введение
- •Модуль 1. Общая характеристика подгруппы, получение и свойства простых веществ.
- •1.1 Содержание модуля
- •1.1.1 Простые вещества.
- •1.1.2 Химические свойства простых веществ. Химические свойства углерода.
- •Химические свойства кремния.
- •Химические свойства Ge, Sn, Pb.
- •1.2 Проектное задание:
- •Тест рубежного контроля:
- •Бланк ответов
- •Модуль 2. Водородные соединения, гидриды и их производные
- •2.1 Содержание модуля.
- •2.1.1 Водородные соединения элементов подгруппы углерода
- •2.1.2 Карбиды
- •2.1.3 Силициды
- •2.1.4 Германиды, станниды, плюмбиды
- •2.2 Проектное задание:
- •2.3 Тест рубежного контроля:
- •Бланк ответов
- •3.1 Содержание модуля.
- •3.2 Проектное задание:
- •Бланк ответов
- •4.1 Содержание модуля.
- •4.2 Проектное задание.
- •4.3 Тест рубежного контроля
- •5.1 Содержание модуля
- •5.2 Проектное задание
- •5.3 Тест рубежного контроля
- •Бланк ответов
- •6.1 Содержание модуля
- •6.1.1 Оксид углерода (II) и оксид кремния (II)
- •6.1.2 Оксиды германия, олова и свинца (II).
- •Проектное задание
- •Тест рубежного контроля
- •Бланк ответов
- •7.1 Содержание модуля
- •7.1.1 Галогениды элементов подгруппы углерода Галогениды углерода
- •Галогениды кремния.
- •Галогениды германия
- •Галогениды олова
- •Галогениды свинца
- •7.1.2. Соединения с серой.
- •7.1.3 Азотсодержащие соединения
- •7.2 Проектное задание
- •7.3 Тест рубежного контроля
- •Бланк ответов
- •Список литературы
Галогениды олова
Известны все четыре тетрагалогенида олова SnГ4. Молекулы SnГ4 представляют собой правильные тетраэдры с атомом Sn в центре. Все SnГ4, кроме SnF4, не содержат мостиковых атомов галогена, благодаря чему эти соединения легкоплавки и легколетучи.
SnГ4 |
Tпл, º С |
Tкип, º С |
ΔfHº298 кДж/моль |
Энергия связи Sn-Г, кДж/моль |
Окраска |
SnF4 |
- |
705 (возг) |
- |
414 |
Бесцветная |
SnCl4 |
-36 |
114 |
-529 |
323 |
Бесцветная |
SnBr4 |
33 |
203 |
-406 |
273 |
Бесцветная |
SnI4 |
146 |
346 |
-215 |
205 |
Красная |
Тетрафторид олова (IV) SnF4 – бесцветное кристаллическое вещество, растворяется в воде с выделением тепла. В водных растворах фторидов SnF4 образует фторстаннаты К2[SnF6].
Структура SnF4 состоит из октаэдрических фрагментов [SnF6], образующих слои за счёт мостиковой функции четырёх (экваториальных) атомов фтора, т.е. олово (IV) в SnF4 имеет КЧ = 6. Естественно, что мостиковый характер и больший ионный вклад в связь Sn-F по сравнению со связью Sn-Г в других тетрагалогенидах обеспечивает большую прочность кристаллической структуры SnF4 (Твозг=705ºС).
Тетрахлорид олова (IV) SnCl4 – бесцветная, дымящая на воздухе подвижная жидкость, растворяется в неполярных органических растворителях, с бензолом и сероуглеродом смешивается в любых соотношениях. Тетрахлорид олова растворяет серу, фосфор, йод, тетрайодид олова. При растворении в воде SnCl4 подвергается гидролизу с образованием SnO2∙nH2O и гексахлороловянной кислоты H2[SnCl6]:
3SnCl4 + (2+n)H2O = SnO2∙nH2O + 2H2[SnCl6].
Гексахлороловянная кислота является сильной кислотой; растворы её солей, образованных щелочными и щелочно-земельными металлами, не гидролизуются, имеют нейтральную реакцию и не разрушаются даже при кипячении.
Тетрабромид олова (IV) SnBr4 – бесцветное кристаллическое вещество, растворимое в ацетоне и трихлориде фосфора, в водном растворе гидролизуется, но из кислых растворов кристаллизуется тетрагидрат SnBr4∙4H2O.
Тетрайодид олова (IV) SnI4 – кристаллическое вещество красного цвета, растворяется в спирте, эфире, бензоле, сероуглероде; в водном растворе гидролизуется; йодостаннаты Э2[SnI6] получены только для рубидия и цезия. В отличие от других тетрагалогенидов олова (IV), SnI4 устойчив на воздухе.
Все SnГ4, кроме SnF4, получают взаимодействием олова с избытком галогена:
Sn + 2Г2 = SnГ4.
Тетрафторид олова синтезируют по реакции безводного фтороводорода с SnCl4.
Для олова (II) получены все четыре дигалогенида SnX2 .
SnГ2 |
Tпл, º С |
Tкип, º С |
ΔfHº298 кДж/моль |
Растворимость в воде |
Окраска |
SnF2 |
210 |
- |
-648 |
Растворим |
Бесцветная |
SnCl2 |
247 |
623 |
-352 |
Растворим (73%, 15ºС) |
Бесцветная |
SnBr2 |
232 |
620 |
-254 |
Растворим |
Бледно-желтая |
SnI2 |
320 |
720 |
-152 |
Нерастворим |
Оранжево-красная |
Дихлорид олова (II) SnCl2 – бесцветное кристаллическое вещество; легко растворяется в воде, спирте. Из водных растворов кристаллизуется в виде SnCl2∙2H2O (“оловянная соль”). В водном растворе SnCl2 подвергается гидролизу, но в существенно меньшей степени, чем SnCl4, так как основные свойства у олова (II) выражены сильнее, чем у олова (IV):
SnCl2 + H2O ↔ Sn(OH)Cl + HCl.
В растворе содержатся не только SbOH+, но и более сложные ионы, например [Sn3(OH)4]2+ и [Sn(OH)2Cl2]2-, которые могут взаимодействовать между собой.
Твёрдый SnCl2 имеет полимерное строение. Его слоистая структрура составлена из тригонально-пирамидальных групп [SnCl3], связанных друг с другом через атомы хлора:
• • • • • • • •
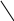
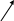
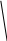 Sn
Sn
Sn
Sn
Sn
Sn
Sn
Sn
Cl Cl Cl Cl Cl
Cl Cl Cl Cl
В парах SnCl2 представляет собой угловую молекулу. Несвязывающая электронная пара олова направлена к вершине треугольника. Твёрдый SnCl2 легко диспропорционирует: 2SnCl2 = SnCl4 + Sn
Дихлорид SnCl2 – сильный восстановитель. Он восстанавливает из растворов солей до металлического состояния золото, серебро, ртуть, висмут, Fe3+ до Fe2+, хроматы до Cr3+, перманганаты до Mn2+, нитрогруппу до аминогруппы, бром до бромид-иона, сульфит-ион до серы, например:
SnCl2 + Br2 + (2+n)H2O = 2HCl + 2HBr + SnO2∙nH2O↓
2SnCl2 + H2SO3 + (2n+1)H2O = 2(SnO2∙nH2O)↓ + S↓ + 4HCl
2SnCl2 + H2SO3 + 8HCl = S↓ + 2H2[SnCl6] + 3H2O.
В водном растворе SnCl2 медленно окисляется кислородом воздуха. Чтобы препятствовать этому, в раствор добавляют металлическое олово. Остальные дигалогениды олова сходны по свойствам с SnCl2.
Дигалогениды олова синтезируют, нагревая олово в токе галогенводорода. Безводные SnГ2 получают также непосредственным взаимодействием галогенов с избытком олова.
Все дигалогениды олова образуют комплексы К[SnГ3] и К2[SnГ4], но они менее устойчивы, чем аналогичные производные олова (IV). Получают их, добавляя SnГ2 в растворы соответствующих галогенводородных кислот или их солей:
SnГ2 + 2NaГ ↔ Na2[SnГ4].
Устойчивость галогенидных комплексов уменьшается в ряду: F-Cl-Br-I.
Многие галогениды олова, такие как SnCl4, SnCl2, а также продукты их гидролиза, например Na2[Sn(OH)6], используют в качестве протрав при крашении тканей. Тетрахлорид SnCl4 применяют для получения дымовых завес и в качестве катализатора при хлорировании, а в органической химии – как стимулятор процесса конденсации.
