
- •11.2. Введение в эксплуатацию новых аккумуляторов
- •11.3. Эксплуатация щелочных аккумуляторов
- •11.5. Заряд аккумуляторов
- •11.6. Разряд аккумуляторов
- •11.7. Хранение аккумуляторов
- •11.8. Восстановление аккумуляторов переводом их на составной электролит
- •Неисправности аккумуляторов
- •Работа аккумуляторной батареи на электровозе
11.7. Хранение аккумуляторов
Аккумуляторы выпускаются заводом готовыми для хранения. При получении новых аккумуляторов необходимо проверить плотность привернутых пробок, убедиться в целости резины, нанести тонкий слой вазелина на никелированные пробки, гайки и металлические части аккумуляторов. Корпуса аккумуляторов с черным битумным покрытием вазелином смазывать запрещается.
Помещение для хранения должно быть сухим, вентилируемым. Запрещается совместное хранение щелочных и кислотных аккумуляторов.
Аккумуляторы, находящиеся в эксплуатации, для перевода на длительное хранение (более одного года) следует разрядить до напряжения 1 В током нормального 8-часового режима, вылить электролит, плотно закрыть пробками (не промывая аккумуляторы), протереть сухой тряпкой, чтобы очистить от пыли и соли. Аккумуляторы, периодически бездействующие (от одного месяца до одного года), могут храниться с электролитом в разряженном или полуразряженном состоянии.
При хранении аккумуляторы и аккумуляторные батареи следует содержать в чистоте и периодически очищать от ползучей соли.
Для дальних транспортировок аккумуляторы рекомендуется приводить в состояние, соответствующее длительному хранению.
11.8. Восстановление аккумуляторов переводом их на составной электролит
Щелочные аккумуляторы, емкость которых в эксплуатации снизилась до 60 % номинальной, могут быть восстановлены для последующей их эксплуатации на составном электролите.
Составной электролит для восстановления состоит из раствора едкого кали плотностью 1,21 —1,22 г/см3 с добавкой 60 г моногидрата лития на 1 л. При отсутствии едкого кали возможно применение составного электролита из едкого натра плотностью 1,20—1,21 г/см3 с добавкой 30 г на 1 л моногидрата лития.
Восстановлению могут быть подвергнуты как аккумуляторы, находящиеся на складах как непригодные из-за значительно снизившейся емкости, так и аккумуляторы, находящиеся в эксплуатации.
Аккумуляторы, находящиеся на складах как негодные, прежде всего проверяют, чтобы убедиться в отсутствии механических дефектов, течи и короткого замыкания. Аккумуляторы тщательно осматривают и отбирают те, которые не имеют непоправимых механических дефектов. Затем их моют снаружи горячей водой, заливают дистиллированной водой (температура от 15 до 25 °С) и оставляют на сутки для вымывания карбонатов из пластин и проверки на течь.
Через сутки аккумуляторы, не имеющие течи, тщательно промывают водой и заливают свежим электролитом из едкого натра плотностью 1,20 г/см3 или едкого кали плотностью 1,22 г/см3. После этого аккумуляторы соединяют последовательно и включают на заряд током нормального режима. Через 2—3 мин после включения на заряд измеряют напряжение каждого аккумулятора. Аккумуляторы, у которых напряжение больше 0,2 В, не имеют короткого замыкания и подлежат дальнейшему заряду.
У аккумуляторов, находящихся в эксплуатации и предназначенных для восстановления, следует сменить электролит на свежеприготовленный раствор едкого натра плотностью 1,18 г/см3 или едкого кали плотностью 1,19 г/см3.
Для аккумуляторов, отобранных для восстановления, проводят следующие циклы: заряд в течение 12 ч нормальным током, разряд в течение 3 ч током 8-часового режима. При разряде через 3 ч у всех аккумуляторов замеряют напряжение.
Аккумуляторы, имеющие напряжение 1 В и выше, подвергают восстановлению составным электролитом.
Слив раствор едкого натра или едкого кали, аккумуляторы промывают дистиллированной водой и тут же заливают заранее приготовленным электролитом — раствором едкого кали плотностью 1,21 — 1,22 г/см3 с добавкой 60 г моногидрата лития на 1 л или раствором едкого натра плотностью 1,20— 1,22 г/см.3 с добавкой 30 г моногидрата лития.
Составные электролиты приготовляют следующим образом. Берут необходимое количество готового раствора едкого кали плотностью 1,21 —1,22 г/см3 и к нему, постоянно перемешивая, добавляют моногидрат лития из расчета 60 г на 1 л (например, на 5 л раствора 300 г моногидрата лития). К раствору едкого натра плотностью 1,20—1,21 г/см3 добавляют 30 г моногидрата лития на 1 л раствора.
Аккумуляторы, залитые составным электролитом, должны постоять не менее 6 ч для пропитки активной массы электролитом.
Таблица 11.1
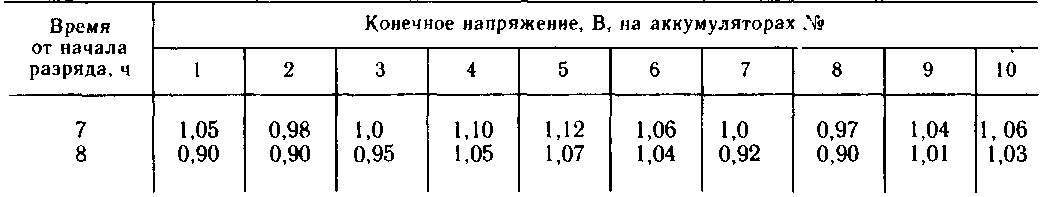
После этого их испытывают следующим образом: 1-й цикл-—заряд в течение 12 ч нормальным током, разряд в течение 4 ч током 8-часового режима; 2-й цикл — заряд в течение 12 ч нормальным током, разряд в течение 8 ч током 8-часового режима. Во время разряда замеряют общее напряжение через каждый час.
Емкость аккумуляторов восстанавливается постепенно в течение работы их на составном электролите. Поэтому первоначальное увеличение емкости не может служить для оценки полной степени восстановления. Обычно на первых циклах увеличение емкости равно 25—30 % относительно первоначальной и лишь постепенно достигает 50—80 %. Исходя из этого аккумуляторы, имеющие на 2-часовом контрольном цикле емкость, равную 50 % и выше, комплектуют в батареи.
В каждую батарею подбирают аккумуляторы примерно одинаковой емкости, т. е. разрядившиеся до напряжения 1 В за одинаковое число часов (табл. 11.1). Аккумуляторы
№ 1,2, 3, 7, 8 собирают в одну батарею, а № 4, 5, 6, 9, 10 — в другую.
Аккумуляторы после восстановления передают в эксплуатацию с тем же составным электролитом, на котором производилось восстановление (не меняя его). При эксплуатации первое время после 3—5-го циклов аккумуляторы следует заряжать в течение 12 ч нормальным током или давать усиленный заряд; при разряде снимать около, 70% емкости или доводить напряжение до 1,1 В на аккумулятор. Последующие циклы проводят в нормальном режиме.
Не чаще чем через год электролит заменяют на электролит состава: раствор едкого кали плотностью 1,19—1,21 г/см3, гидрата лития 20 г на' 1 л.
Если после достижения максимальной емкости (что наблюдается через 5—100 циклов) она начнет заметно уменьшаться и это уменьшение не ликвидируется путем двух-трех последовательных зарядов, следует сменить электролит.
На некоторых электровозах установлены железо-никелевые аккумуляторы типа ЖН-100 (железо-никелевые, ёмкость 100 а-ч). Положительные пластины железо-никелевых аккумуляторов не отличаются от положительных пластин никель-кадмиевых; отрицательные же пластины выполнены из губчатого железа. Во время разряда аккумулятора кислород отнимается у никелевой (положительной) пластины и присоединяется к железной (отрицательной) пластине. Во время заряда происходит обратное явление.
АККУМУЛЯТОРНАЯ БАТАРЕЯ Аккумуляторная батарея служит источником энергии для питания цепи низкого напряжения электровоза при неработающем генераторе тока управления. Во время подготовки электровоза к работе, а также при повреждении генератора тока управления в пути аккумуляторная батарея питает электроэнергией катушки различных аппаратов, осветительные и сигнальные лампы. После включения генератора тока управления питание низковольтных цепей электровоза производится от генератора, который одновременно заряжает аккумуляторную батарею. Аккумуляторная батарея состоит из ряда аккумуляторных элементов, соединённых последовательно один с другим. В отличие от так называемых первичных элементов, к которым относятся гальванические элементы, преобразующие химическую энергию в электрическую, аккумуляторы представляют собой вторичные элементы, способные накапливать (аккумулировать) подведённую к ним извне при заряде электрическую энергию в виде постоянного тока и по мере надобности отдавать эту энергию также в виде постоянного тока. Следует заметить, что выражение «накапливать электрическую энергию» неправильно, и оно приведено лишь как наиболее ясно выражающее видимые результаты. В действительности в аккумуляторе происходит превращение электрической энергии в химическую с последующим ее преобразованием в электрическую. В практике получили широкое распространение два типа аккумуляторов: кислотные (свинцовые) и щелочные (железо-никелевые и никель-кадмиевые), отличающиеся друг от друга применением разных пластин и растворов (электролитов). На электровозах железных дорог СССР до последнего времени применялись только свинцовые аккумуляторы; с 1955 г. на некоторых электровозах устанавливаются никель-кадмиевые и железо-никелевые аккумуляторы. В своей простейшей форме свинцовый аккумулятор представляет собой сосуд 1 (фиг. 451), наполненный раствором серной кислоты (электролитом)! В сосуд погружены две свинцовые пластины 2 и 3, называемые электродами. Как только свинцовые пластины погружаются в раствор серной кислоты, они под действием этой кислоты покрываются тонким слоем сернокислого свинца. Происходящий при этом химический процесс можно выразить следующей формулой: Pb + H2S04 = PbS04 + На. свинец серная сернокислый водород кислота свинец Если к пластинам, опущенным в электролит, приложить напряжение, то под воздействием возникшего тока отдельные частицы (молекулы) серной кислоты H2S04 разлагаются. Водородная часть молекул пойдёт к свинцовой пластине, соединённой с отрицательным полюсом (к катоду), и выделится на ней в виде тонкого слоя водорода На, который, соединяясь с кислотным остатком S04 сернокислого свинца PbS04, образует серную кислоту H2S04; катод при этом начнёт покрываться чистым свинцом РЬ. Другая часть молекулы серной кислоты S04 под влиянием электрического тока пойдёт к свинцовой пластине, соединённой с положительным полюсом (к аноду), где при отдаче ей своего заряда вступает в химическое взаимодействие с водой Н20 электролита, отнимая у молекулы воды её водородную часть Н2. В этом случае у анода молекула серной кислоты H2S04 полностью восстанавливается, а освободившийся кислород воды окисляет поверхность положительной свинцовой пластины в перекись свинца Pb02, принимающую тёмно-коричневый цвет. Процесс, происходящий у отрицательной пла:ти-ны (катода), можно выразить так: PbS04 + Н2 = Pb + H2S04. сернокислый водород свинец серная свинец кислота Процесс, происходящий у положительной пластины (анода), выражается формулой PbS04 + S04 + 2 H20 = РЬ02 + 2 H2S04. сернокислый кислотный вода свинец остаток перекись свинца серная кислота Таким образом, при прохождении тока анод покроется перекисью свинца и приобретёт темно коричневый цвет, а катод покроется чистым свинцом губчатого строения. Описанный процесс происходит до тех пор, пока на пластинках будет находиться сернокислый свинец. Когда же сернокислый свинец полностью превратится в перекись свинца на аноде и в чистый свинец на катоде, то электрический ток не будет производить изменения химического состояния пластин, а будет разлагать воду электролита на её составные части. На аноде при этом начнёт выделяться кислород О, а на катоде — водород Н2. Такое выделение газа, весьма сходное с кипением воды, носит название кипения аккумулятора. В случае появления «кипения» следует прекратить питание аккумулятора электрической энергией, так как оно показывает на окончание процесса окисления положительной пластины (анода), т. е. на окончание процесса заряда аккумулятора. Дальнейшее питание аккумулятора энергией будет вести лишь к разложению воды, содержащейся в электролите аккумулятора, увеличению плотности его и нагреву. Механическая смесь выделяемых во время «кипения» аккумулятора водорода и кислорода представляет собой взрывчатый гремучий газ, к которому весьма опасно приближаться с огнём. В результате заряда аккумулятора получается своего рода гальванический элемент, электроды которого (перекись свинца РЬ02 и металлический свинец РЬ) погружены в разбавленную серную кислоту. При замыкании заряженного аккумулятора на внешнюю цепь разрядный ток во внешней и внутренней цепях элемента будет иметь обратное направление по сравнению с тем, какое направление имел зарядный ток (фиг. 452). В этом случае в аккумуляторе происходит обратный процесс, и химическая энергия вновь обращается в электрическую. Разрядный ток разложит серную кислоту H2S04 на водород Н2 и кислотный остаток S04. Водород выделится на положительной пластине, покрытой перекисью свинца Pb02. Вступая в химическое соединение с перекисью свинца РЮ2, водород отнимет от неё часть кислорода, и в результате пластина будет покрыта слоем окиси свинца РЬО. Эта реакция может быть выражена формулой РЬ02 + Н2 = Н20 + РЬО. перекись водород вода окись свинца свинца Кислород выделится на отрицательной пластине, окислит её и образует окись свинца: РЬ + О == РЬО. свинец кисло- окись род свинца Разрядный ток прекратится, когда весь запас перекиси свинца перейдёт в окись свинца и свинцовая пластина покроется слоем окиси свинца. Окись свинца вступает в реакцию с серной кислотой и постепенно образует на обоих электродах труднорастворимую сернокислую соль свинца: РЬО + H2S04 = Н20 + PbS04. окись свинца серная кислота вода сернокислый свинец Чтобы аккумулятор вновь сделать пригодным к действию, необходимо его опять зарядить. Во время заряда процесс повторяется, как ранее указывалось, Т. е. на положительной пластине выделяется кислород О; последний, соединяясь с окисью свинца РЬО, снова даёт перекись свинца РЬОг. Отрицательная же пластина, покрываясь водородом Н2, отдаёт ему свой кислород О, образуя воду Н20 и превращаясь вновь в металлический свинец с поверхностью губчатого строения. 2. Напряжение аккумуляторов При разомкнутой внешней цепи напряжение на зажимах аккумулятора равно его э. д. с. Электродвижущая сила аккумуляторного элемента при нормальной плотности электролита и средней его температуре равна 2,0—2,1 б независимо от размеров пластин аккумулятора. Величина э. д. с. аккумулятора тем больше, чем больше плотность электролита (фиг. 453). Так как аккумулятор обладает внутренним сопротивлением ReH, то при токе / падение напряжения в нём равно IReH. Поэтому во время разряда аккумулятора напряжение на его зажимах U выразится формулой Если при заряде нормально разряженного свинцового аккумулятора измерять через определённые промежутки времени напряжение на его зажимах, то можно обнаружить, что величина напряжения будет заметно изменяться. На фиг. 454 изображены кривые изменения напряжения во время заряда и разряда свинцового аккумулятора. Как видно из кривых, напряжение одного элемента в начале заряда составляет около 1,7—1,8 в. После включения тока напряжение быстро возрастает до 2,2 в и затем почти не изменяется. Лишь к концу заряда напряжение достигает 2,4 в, а когда зарядка окончена, доходит до 2,6—2,7 в. Когда напряжение аккумулятора достигает 2,2 в, у положительной пластины начинают появляться пузырьки, а при напряжении 2,3 в пузырьки начинают также выделяться на отрицательных пластинах. Когда напряжение достигает 2,6—2,7 в, около пластин начинают интенсивно выделяться газы, т. е. аккумулятор закипает. Это означает, что заряд окончен. После прекращения заряда аккумулятора напряжение его с 2,6—2,7 в быстро падает до 2,1—2,2 в, В процессе разряда аккумулятора (нижняя кривая) напряжение его очень быстро падает до 2 в, а затем медленно и плавно уменьшается до 1,7 е. Ниже этой величины разряжать аккумулятор не рекомендуется, так как это значительно уменьшает продолжительность его работы. В процессе заряда аккумулятора происходит увеличение плотности элек^ тролита за счёт дополнительного образования кислоты, что вызывает повышение э. д. с. аккумулятора. Во время разряда происходит образование дополнительного количества воды в электролите, что влечёт за собой уменьшение э. д. с. аккумулятора. Чем ниже температура, тем больше падение напряжения внутри аккумулятора, так как с понижением температуры сопротивление электролита увеличивается и кислота становится вязкой и малоподвижной. С понижением температуры кривые заряда идут выше, а кривые разряда — ниже. Влияние температуры на кривые заряда и разряда показано на фиг. 455. С повышением температуры электролита зарядить аккумулятор до наивысшего значения напряжения нельзя. Так, при температуре электролита 45°, которая является максимально допустимой, поднять напряжение на зажимах аккумуляторного элемента выше 2,6 в не удаётся.-
