
- •Вяжущие вещства.
- •1. Виды гипсовых вяжущих веществ, особенности технологии их производства. Характеристика свойств гипсовых вяжущих и их рациональное применение при производстве строительных материалов и изделий.
- •3. Бетонополимеры и полимербетоны: состав, свойства, области применения.
- •6.Портландцемент. Вещественный состав, маркировка но гост 10178, гост 31108-2003 и за рубежом.
- •7. Цементы. Характеристики и регулирование свойств цементного теста. Нормальное и аномальное структурообразование.
- •Модификаторы цементных систем и разновидности модифицированных цементов. Пластификаторы, регуляторы схватывания и твердения, пенообразователи, гидрофобизаторы.
- •9. Гиперпластификаторы – поликарбоксилаты. Электростатический и стерический факторы стабилизации цементных систем. Самоуплотняющиеся бетонные смеси.
- •10. Быстротвердеющие (бтц) и высокомарочные цементы, их состав, свойства и рациональное применение.
- •Пуццолановые портландцементы и шлакопортландцементы.
- •12.Проблемы производства гипсовых вяжущих из промышленных отходов.
- •13. Белый и цветной цементы. Особенности технологии производства, рациональное применение в строительном комлексе.
- •14. Сульфатостойкий портландцемент. Обоснование минералогического состава. Применение в строительном комплексе.
- •Способы ускорения твердения и повышения класса прочности цементов.
- •16. Пластификаторы и суперпластификаторы цементных систем. Механизм действия. Сп нового поколения. Эффективность применения пластификаторов и суперпластификаторов.
- •17. Шлакопортландцемент. Особенности технологии производства. Требования к доменным шлакам как компонентам шпц. Рациональное применение шпц.
- •18. Высокопрочный гипс. Технология производства, свойства, применение в строительном комплексе.
- •19. Влияние основности цементов на процессы коррозии в различных агрессивных средах. Теория кальматации и ее применение при выборе коррозионностойких цементов.
- •21. Цементно-полимерные композиционные материалы, их состав, свойства, применение.
- •22. Обоснование состава и условий твердения известково – песчаных вяжущих автоклавного твердения.
- •23. Углекислотная коррозия под влиянием углекислого газа и водных растворов углекислты. Отличие механизма этих двух видов коррозии. Защита цементных систем от углекислотной коррозии.
- •24. Пластификаторы и суперпластификаторы. Рациональное применение суперпластификаторов.
- •25. Кислотная агрессия. Общая характеристика кислотных сред. Влияние минерального состава цемента, добавок, вида заполнителя и др. Факторов на кислотостойкость. Меры по защите от кислотной коррозии.
- •26. Солевая коррозия. Общая характеристика солевой коррозии. Сульфатная коррозия. Способы повышения стойкости.
- •27. Методы оценки коррозионной стойкости и способы прогнозирования долговечности. Коэффициент коррозионной стойкости.
- •Способы ускоренных испытаний
- •Современные методы
- •28. Влияние СаСl2 и других электролитов на схватывание и твердение портландцемента. Бесхлоридные ускорители твердения цементных систем.
- •29. Влияние гипса и Nа2 sо4 на твердение цементов
- •30 . Биологическая коррозия.
- •31.Коррозия выщелачивания.
- •32. Вяжущие низкой водопотребности.
- •33. Комплексные органо-минеральные добавки в бетон.
22. Обоснование состава и условий твердения известково – песчаных вяжущих автоклавного твердения.
И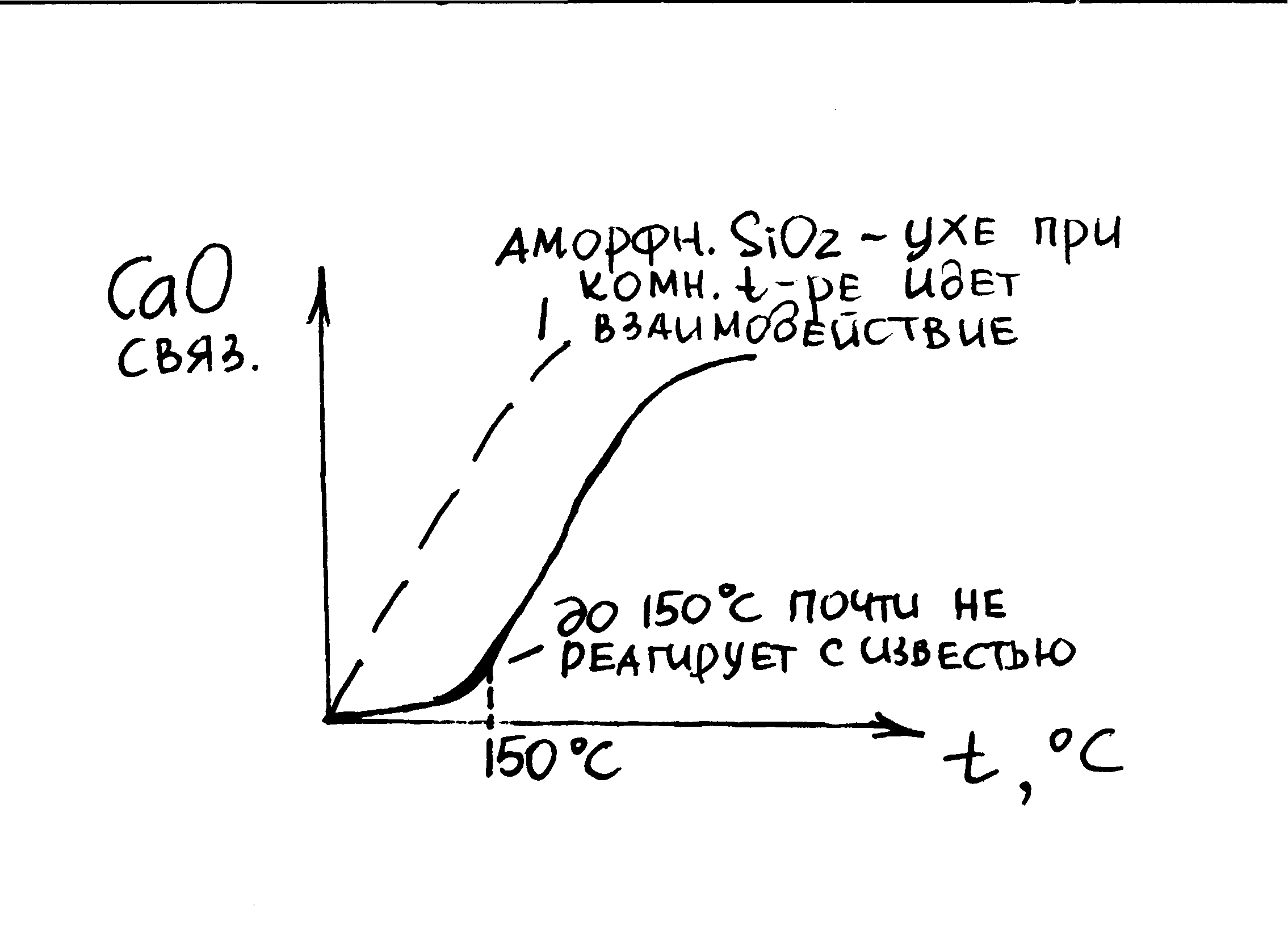 звесть
– вяж.в-во воздушного тверд. Бывает
гашеная (Са(ОН)2) и негашеная (СаО). Для
получения извести исп.известняк, плотную
разновидность карбонатн.г.п. и мел. Песок
д.б. молотый, удельн.поверхн.200-300 м2/кг.
звесть
– вяж.в-во воздушного тверд. Бывает
гашеная (Са(ОН)2) и негашеная (СаО). Для
получения извести исп.известняк, плотную
разновидность карбонатн.г.п. и мел. Песок
д.б. молотый, удельн.поверхн.200-300 м2/кг.
Реальная температура твердения 180-200◦С. В РФ исп.t=180◦С, на Западе и в США-200.
В качестве теплоносителя исп. насыщен. водяной пар, Р= 0,8 до 1МПа. Исп. толстостенные цилиндрические автоклавы с герметическими крышками.
При t=180◦С образуется:
2 СаО·SiO2·H2O –C2SH(A) –крупные столбчатые кристаллы, которые плохо срастаются друг с другом, образуя слабую структуру твердения→ плохой камень.
Или: СаО·SiO2·H2O – тоберморит- слабозакристаллизованный материал с высокой прочностью. Поэтому нужно, чтобы в процессе твердения изв.-песч.вяжущего при гашении образ.тоберморит. Для этого соотношение извести к песку д.б. 1:1.
Смесь 1:1 перемешивается в мельнице, затем добавляется заполнитель -8-9 весовых частей кварцевого песка +вода (влажность 10-12%). Далее осуществляется формование силикатного кирпича, погрузка его на вагонетки и отправка в автоклав. Условия автоклавирования: Р=20-30 МПа, насыщенный пар. Происходит реакция м/д СаО и H2O. (применяется и гашеная и негашеная изв.)
1 ступень – образование C2SH2 реагирует с избытком кварцевого песка – процесс длится около 8ми часов при 180-200◦С, образуется тоберморит. Прекращается подача пара. Изделия отгружается. Марка кирпича – 100-150-200.
У силикатного кирпича имеются недостатки по сравнению с глиняным. Кирпич не достаточно водостоек, не рекомендуется использовать в воде, строить фундаменты. Ниже морозостойкость +долговечность низкая, больше коэф.теплопроводности.
λ = 1Вт/м◦С – силикатн.кирпич.
λ = 0,8-0,9 Вт/м◦С – глиняный кирпич.
Согласно современным требованиям теплопроводность д.б. не более 0,3 (пенополистирол).
На основе изв.-песч. вяж.можно получ.эффективные стеновые материалы с высокими теплотехнич.св-ми. Добавляется алюмин.пудра – 1-2%, реагир.с гидроксидом Са, образуется гидроаллюминат Са:
Al + 3 Са(ОН)2→ 3CaOAl2O3 · 6 H2O+ H2 ↑ -вспучивание. Получается пористый материал – газосиликат.
23. Углекислотная коррозия под влиянием углекислого газа и водных растворов углекислты. Отличие механизма этих двух видов коррозии. Защита цементных систем от углекислотной коррозии.
Два вида коррозии: 1- водными растворами угольной кислоты; 2- газообразная (СО2)
1. Углекислота содержится во всех природных водах. Источником ее является, как правило, биохимические процессы (гниение).
При коррозии водными растворами (предприятия пищевой промышленности, где производится газированная вода, пиво и.т.п.). Иногда на пол или стены попадает раствор угольной кислоты. Угольная кислота – слабая кислота, но она сильнее, чем кремнекислота.
СО2 +Н2О=Н2СО3
Она разлагает гидроалюминаты и гидросульфоалюминаты кальция и связывается с известью, образуя кислую соль угольной кислоты. При взаимодействии с цементным камнем в 1-ю очередь она реагирует с известью, образуя малорастворимый карбонат кальция: Са(ОН)2+ Н2СО3=СаСО3+2Н2О
Карбонат кальция образует на поверхности цементного камня уплотненный тонкий слой, замедляющий процесс коррозии. Чтобы этот слой не разрушался необходимо, чтобы углекислота находилась в постоянном количественном составе. Как только в растворе появляется дополнительное количество углекислоты она реагирует с пленкой карбоната кальция с образованием гидрокарбоната кальция, который легко растворяется и вымывается водой, в результате чего происходит разрушение цементного камня. Такое избыточное количество углекислоты называют агрессивным.
СаСО3+ Н2СО3= Са(НСО3)2
Далее углекислота вступает в реакцию с гидросиликатами и гидроалюминатами кальция.
4Н2СО3+2СаО*SiО2*2Н2О=2Са(НСО3)2+ SiО2*nН2О
Гель кремнекислоты является единственным нерастворимым продуктом, который откладывается в зоне коррозии и закупоривает поры, тем самым затрудняя коррозию. Надо использовать низкоосновные вяжущее, с большим содержанием SiО2. (ШПЦ, ППЦ и т. п.)
2. этот вид является одним из распространенных видов коррозии, так как СО2 количестве 0,02% всегда находится в атмосфере. Эта коррозия на 95% влияет на долговечность бетонных изделий. Уменьшает несущую способность зданий и сооружений.
Механизм коррозии: реакция идет ступенчато.
1.Ступень – растворение СО2 в порах цементного камня и бетона, скорость коррозии зависит от относительной влажности воздуха. Если относительная влажность ниже 20 – 30%, то поры цементного камня сухие и СО2 не растворяется, скорость коррозии равна 0.
2. Если относительная влажность воздуха приблизительно равна 50 – 70%, то скорость коррозия максимальная и СО2 растворяется в воде с образованием углекислоты. Эта ступень самая опасная, так как достаточно Н2О и много свободного места для проникновения СО2 вглубь цементного камня.
СО2 +Н2О=Н2СО3
3.Относительная влажность 90 – 100% дает хорошие условия для растворения СО2, но скорость проникновения маленькая.
1.ступень![]() 2.ступень
2.ступень![]() 3.ступень
3.ступень![]()

Отличие механизма этих двух видов коррозии:
В атмосфере, где находится СО2 – дефицит жидкой фазы, а в водном растворе СО2 избыток воды. Поры цементного камня имеют щелочную среду, а водный раствор Н2СО3 кислую, в связи с этим: Са(ОН)2+ Н2СО3=СаСО3+2Н2О
Взаимодействие СО2 с гидросиликатами кальция: СО2+ СаО*SiО2*2Н2О= СаСО3+ SiО2*nН2О
Продукты коррозии не растворяются и не вымываются, а остаются в порах и закупоривают их
В данном случае СаСО3 образуется в 3 – 4 раза больше, чем геля кремнекислоты, так как он образуется на основе СаО, которого в цементе 64%, а SiО2 – 20%. Поэтому в этом случае целесообразно применять высокоосновное вяжущее с высоким содержанием извести и высокоосновного гидросиликата кальция.
Защита: для повышения стойкости бетона и Ж/Б в среде СО2 необходимо использовать высокоосновные цементы, обеспечивать надежную толщину защитного слоя, использовать гидрофобизацию и пластифицирующие добавки и при необходимости наносить защитные покрытия.
При коррозии в водном растворе необходимо использовать только низкоосновные вяжкщие.
