
- •Глава 3. Титриметрия (титриметрический анализ)
- •3. 1. Основные понятия
- •Способы титрования
- •3.2. Метод нейтрализации
- •Характеристика некоторых кислотно-основных индикаторов
- •Результаты расчета
- •3.3. Осадительное титрование (метод осаждения)
- •Классификация методов осадительного титрования
- •Скачки титрования для AgHal
- •Окраска адсорбционных индикаторов
- •3.4. Комплексометрия. Комплексонометрическое титрование
- •Константы устойчивости некоторых комплексов металлов с эдта
3.3. Осадительное титрование (метод осаждения)
Осадительное титрование – метод титриметрии, основанный на применении титрантов, образующих с определяемым веществом малорастворимые соединения. Требования к реакциям осаждения в методе несколько отличаются от таковых в гравиметрии. Так, скорость реакции осаждения должна быть высокой, иначе титрование замедляется и фиксирование ТЭ становится затрудненным. Для ускорения образования осадка используют добавки органических растворителей (например, спирта) или нагревание. Считают, что реакция осаждения протекает до конца, если растворимость образующегося соединения 10–5моль/л. Образование осадка сопровождается его загрязнением за счет адсорбции, окклюзии, сорбции (см. гл. 2); подобные явления нарушают стехиометрический состав осадка и снижают точность анализа. Применение осадительного титрования ограничено. Метод используют, например, для определения содержания Cl–, I–, Zn2+ (и других ионов):
Cl– + Ag+ AgCl
2 I– + Hg22+ Hg2I2
3Zn2+ + 2K+ + 2[Fe(CN)6]4- K2Zn3[Fe(CN)6]2
Титрование анализируемого раствора ведут до прекращения выпадения осадка (ТЭ). Методы осадительного титрования обычно классифицируют по виду титранта (табл.6).
Кривую титрования в методе осаждения строят в координатах С – V, где С – концентрация определяемого иона, V – объём титранта, или рС – V, где рС = –lgC (рис.2). Расчет точек для построения кривой аналогичен расчету в методе нейтрализации. Например, при проведении в растворе реакции
Ag+ + Cl– AgCl
следят за изменением концентрации ионов Cl– при добавлении определенного объёма титранта – раствора NaCl.
Таблица 6
Классификация методов осадительного титрования
Название метода |
Титрант, С, моль/л |
Индикатор |
Примеры определений |
Аргентометрия |
AgNO3 C=0,1; 0,05 |
K2CrO4 |
Cl–, Br–, I–, NCS– органические вещества: бромкамфора, барбитураты |
Тиоцианатометрия |
KNCS или NH4NCS C = 0,1 |
NH4Fe(SO4)2 |
Ag+ (в неорганических и органических соединениях) |
Меркурометрия |
Hg2(NO3)2 C=0,05 |
Д дифенилкарбазон; Т тиоцианатные комплексы железа |
Cl–, I– |
Гексацианоферратометрия |
K4[Fe(CN)6] С = 0,05 |
дифениламин и др. |
Zn2+, Mn2+, Cu2+, Cd2+, Pb2+ |
Сульфатометрия |
H2SO4 C = 0,05 |
нитрохромазо ортаниловый А |
Ba2+ |
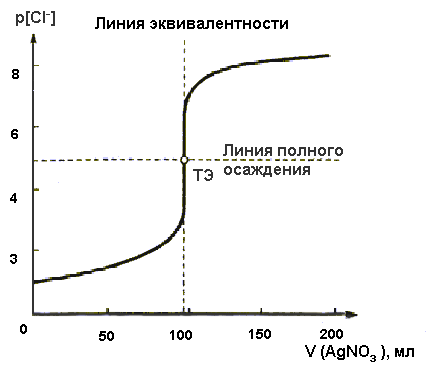
Рис.2. Рассчитанная кривая осадительного титрования 100 мл 0,1 М раствора NaCl стандартным 0,1 М раствором AgNO3
Кривая рС = f(V) (рис.2) характеризуется скачкообразным изменением концентрации ионов Cl– вблизи ТЭ. Относительную ошибку титрования теоретически можно выразить как отношение концентрации Cl– в ТЭ к исходной концентрации C0(Cl–). В ТЭ
С(Cl–)
= S(AgCl)
=

 =
10–5
моль/л,
=
10–5
моль/л,
где S – растворимость AgCl. Тогда при C0(Cl–) = 0,1 моль/л относительная ошибка составит
=
 100%
=
100%
=
 100%
=
100%
=
 %
= 0,01 %
%
= 0,01 %
Ошибка определения возрастает при осаждении из разбавленных растворов, она зависит от растворимости осадка (чем меньше S, тем меньше ошибка). До ТЭ концентрация Cl– уменьшается из-за связывания их ионами Ag+. После достижения ТЭ дальнейшее прибавление титранта приводит к уменьшению растворимости AgCl из-за влияния избытка одноименных ионов Ag+, т.е. к уменьшению С(Cl–), так как
С(Cl–)
=

где С(Ag+) – избыточная концентрация ионов осадителя (Ag+).
Величина скачка титрования в методе зависит от нескольких факторов: величины ПР (или S) осадка, температуры, концентраций реагентов. Так, с уменьшением значения ПР увеличивается скачок титрования (рис.3).
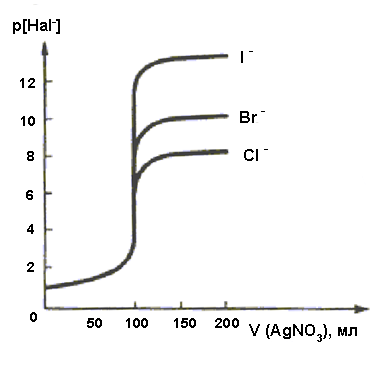
Рис.3. Сравнение кривых титрования 0,1 М растворов KHal стандартным 0,1 М раствором AgNO3, где Hal: Cl–, Br–, I–
В табл.7 приведены данные о рС (Hal–) (где Hal– – галогенид-ион) при титровании растворов KHal с концентрацией 0,1 моль/л раствором AgNO3 той же концентрации. Влияние температуры на скачок титрования проявляется только в случае заметной зависимости растворимости вещества от температуры.
Таблица 7
