
- •Тема 14. Відновлення деталей гальванічним покриттям. Класифікація способів
- •1. Суть процесу нанесення гальванічних покриттів
- •2. Технологічний процес нанесення гальванічних покриття
- •3. Хромування деталей
- •4.Залізнення деталей
- •5. Електролітичне і хімічне нікелювання
- •6. Електролітичне натирання
- •7. Захисно-декоративні покриття
- •8. Автоматизація процесу нанесення гальванічних покриттів
- •9. Організація робочих місць і техніка безпеки
Тема 14. Відновлення деталей гальванічним покриттям. Класифікація способів
1. Суть процесу нанесення гальванічних покриттів
У авторемонтному виробництві при відновленні деталей знайшли широке застосування гальванічні і хімічні процеси. Вони застосовуються для компенсації зносу робочих поверхонь деталей, а також при нанесенні на деталі противо корозійних і захисно-декоративних покриттів.
З гальванічних процесів найбільш ширше застосовуються хромування і залізнення, а також нікелювання, цинкування і міднення.
Застосовуються також хімічні процеси;
хімічне нікелювання,
оксидування
і фосфатування.
Процес отримання гальванічних покриттів на виробах був розроблений в 1838 р. відомим російським ученим акад. Б. С. Якоби.
Гальванічні покриття одержують з електролітів, як які застосовують водні розчини солей тих металів, якими необхідно покрити деталі.
Катодом при гальванічному осадженні металів з електролітів є відновлювана деталь, анодом — металева пластина.
Застосовують два види анодів:
розчинні
і нерозчинні.
Розчинні аноди виготовляють з металу, який осідає на деталі, а нерозчинні — з свинцю.
При проходженні постійного струму через електроліт на катоді розряджаються позитивно заряджені іони і, отже, виділяються метал і водень.
На аноді при цьому відбуваються розряд негативно заряджених іонів і виділення кисню. Метал анода розчиняється і переходить в розчин у вигляді іонів металу замість тих, що виділилися на катоді.
Відповідно до закону Фарадея маса речовини, що виділилася при електролізі на катоді, може бути визначена:
Gт =c*I*t0
Де:
с—електрохімічний еквівалент, г/А-год;
I — сила струму, А;
t0 —тривалість електролізу, год.
Зважаючи на те що при електролізі струм витрачається не тільки на відкладення металу, але і на інші супутні процеси (електроліз води, нагрів електроліту і т. п.), фактичну кількість металу, що виділився на катоді, буде меншим і рівно:
Gф=с* I*t0
Де:
с — коефіцієнт виходу металу по струму.
Коефіцієнт виходу металу по струму показує, яка частина струму витрачається на відкладення металу, і визначається експериментально по формулі:
g2 - g1
= -----------*100%
c*I*t0
де :
g2 ; g1— маса деталі відповідно після і до покриття її металом.
Товщина гальванічних покриттів на поверхні деталі звичайно виходить нерівномірною. Причиною цього є незадовільна розсіююча здатність електролітів.
Під розсіюючою здатністю електроліту розуміють його властивість забезпечувати отримання рівномірних по товщині покриттів на деталях.
Чим вище розсіююча здатність електроліту, тим більше рівномірними по товщині виходять покриття на деталях.
Розсіююча здатність електроліту залежить від ступеня рівномірності розподілу електричних силових ліній, що йдуть від анода до катода. Ці силові лінії розподіляються в об'ємі електроліту не рівномірно, а концентруються на краях катода і виступаючих його частинах (мал..1).
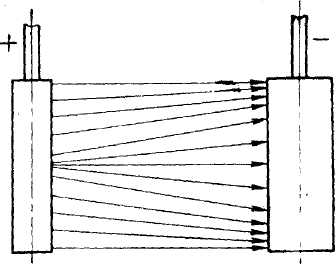
Мал. 1. Розподіл силових ліній і електроліті
На тих ділянках катода, де силових ліній більше, густина струму буде вищим і, отже, товщина покриття буде найбільша.
Розсіююча здатність електроліту може бути підвищена за рахунок зміни складу електроліту.
Електроліти з малою концентрацією основної солі мають вищу розсіюючу здатність.
Більш рівномірне по товщині покриття може бути:
також одержане при застосуванні фігурних анодів, що копіюють форму деталі;
за рахунок раціонального розміщення анодів щодо катода;
постановкою додаткових катодів і струмопроводящих екранів.
Окрім розсіюючої здатності, розрізняють ще так звану криючу здатність електроліту, під якою розуміють властивість електроліту забезпечувати отримання покриття на поглиблених частинах деталей незалежно від його товщини.
Криюча здатність електроліту в основному визначається його концентрацією. Із збільшенням концентрації основної солі в електроліті криюча здатність електроліту поліпшується.
Металеві покриття, одержані в гальванічних ваннах, мають кристалічну будову. Проте їх кристалічні грати в значній мірі спотворені. Причинами цього є великі внутрішні напруги і упровадження водню, що виділяється на катоді.
Такий стан структури електролітичного металу обумовлює його властивості, які значно відрізняються від властивостей литого металу.
Гальванічні покриття мають, як правило, високу твердість і крихкість. У покриттях мають місце вельми значні внутрішні напруги, які негативно позначаються на втомній міцності деталей. На величину внутрішніх напруг і інші властивості покриттів великий вплив роблять режим їх нанесення і склад електроліту.
Змінює режим електролізу і склад електроліту, можна управляти якістю гальванічних покриттів.
